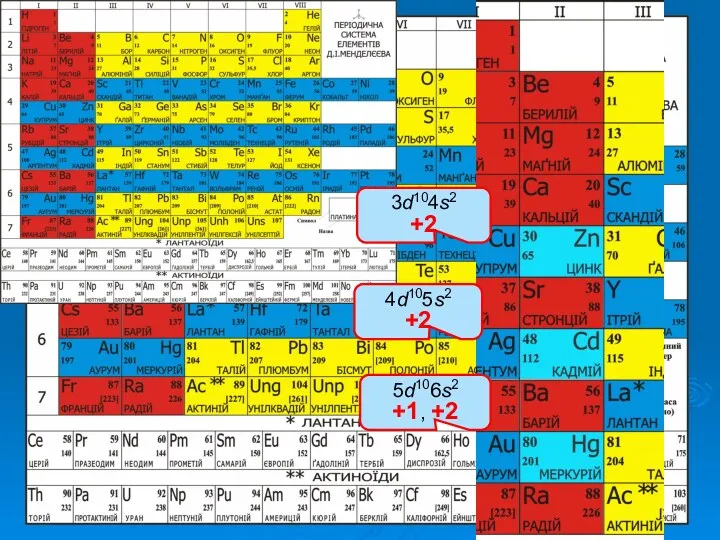
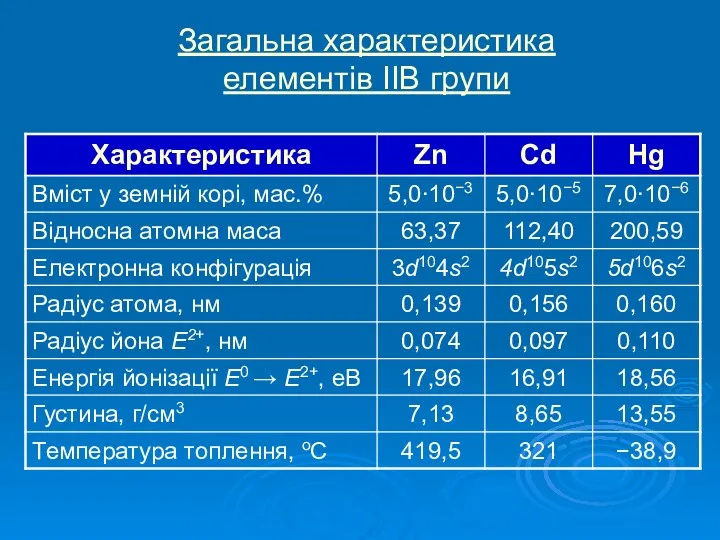
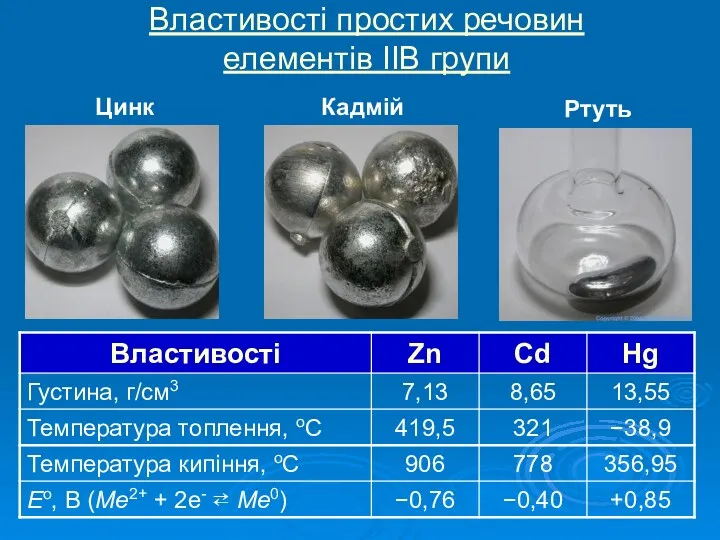
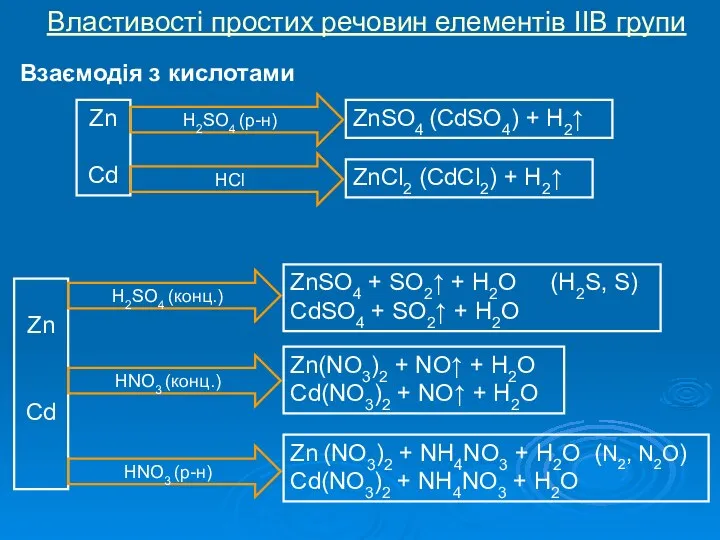
Історія відкриття елементів ІІВ групи
Відкритий у 1721 р.
Відкритий у 1817
р.
Відома з давніх часів
Сплави цинку з міддю (латуні) були відомі давнім грекам та єгиптянам.
ГЕНКЕЛЬ
(1678 – 1744 р.р.)
Андреас Сигізмунд МАРГГРАФ
(1709 – 1782 р.р.)
Фрідріх ШТРОМЕЙЕР
(1776 – 1835 р.р.)
Самородна ртуть була відома за 2000 років до н.е. народам Стародавньої Індії і Стародавнього Китаю. Грецький лікар Діоскорид (І ст. н. е.), нагріваючи кіновар з вуглем у залізній посудині з кришкою, отримав ртуть у вигляді пари, яка конденсувалася на холодній внутрішній поверхні кришки. Продукт реакції був названий hydrargyros (від грец. hydor - вода і argyros - срібло), тобто рідким сріблом, звідки походить латинська назва hydrargyrum, а також argentum vivum - живе срібло.
Педаній ДІОСКОРИД
(І ст. н. е.)







![Сполуки Меркурію в ступені окиснення +1 Hg22+ [Hg–Hg]2+ –Hg–Hg– Одержання](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/581109/slide-14.jpg)


 Классификация химических реакций в неорганической химии
Классификация химических реакций в неорганической химии Химические свойства металлов
Химические свойства металлов Гетероциклды қосылыстар. Алкалоидтар
Гетероциклды қосылыстар. Алкалоидтар Классы органических соединений
Классы органических соединений Применение здм к кислотно-основным равновесиям и их роль в аналитической химии
Применение здм к кислотно-основным равновесиям и их роль в аналитической химии Дисперсные системы
Дисперсные системы Електролітична дисоціація
Електролітична дисоціація Явище ізомерії. Структурна ізомерія, номенклатура насичених вуглеводнів
Явище ізомерії. Структурна ізомерія, номенклатура насичених вуглеводнів Основы коррозии и защиты металлов. Методы исследования коррозии
Основы коррозии и защиты металлов. Методы исследования коррозии Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Сложные эфиры
Сложные эфиры Respiration Module
Respiration Module Синтетические моющие средства
Синтетические моющие средства Катионы IV аналитической группы
Катионы IV аналитической группы Генетическая связь между классами неорганических веществ. 8 класс
Генетическая связь между классами неорганических веществ. 8 класс Бытовая химия
Бытовая химия Стекловолокно. Что такое стекловолокно?
Стекловолокно. Что такое стекловолокно? Создание косметических средств
Создание косметических средств Фазовые равновесия и учение о растворах
Фазовые равновесия и учение о растворах Серная кислота и её свойства
Серная кислота и её свойства Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома
Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома Химический элемент, минерал, горная порода. (Лекция 6)
Химический элемент, минерал, горная порода. (Лекция 6) Щелочноземельные металлы
Щелочноземельные металлы Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Электроотрицательность химических элементов
Электроотрицательность химических элементов