ИСТОРИЧЕСКИЕ СВЕДЕНИЯ
Серная кислота известна с древности. Первое упоминание о кислых газах,
получаемых при прокаливании квасцов или железного купороса «зеленого камня», встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну.
Позже, в IX веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (FeSO4•7H2O и CuSO4•5H2O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в XIII веке.
Абу Абдаллах Джабир ибн Хайян ад-Азди ас-Суфи (ок. 721 г., — ок. 815г.)
Абу Бакр Мухаммад ибн Закария Ар-Рази (около 865 г.— около 925 г.)
Алберт Магнус (ок. 1193г.— 15 ноября 1280 г.)







 Минералогия литофильных редких элементов. Цезий и рубидий
Минералогия литофильных редких элементов. Цезий и рубидий Изучение состава и свойств противогололедного материала Бионорд
Изучение состава и свойств противогололедного материала Бионорд Щелочные металлы
Щелочные металлы Элемент 7 группы, побочной подгруппы, d-элемент - Mn (марганец)
Элемент 7 группы, побочной подгруппы, d-элемент - Mn (марганец) Крахмал. Физические свойства
Крахмал. Физические свойства Теория электролитической диссоциации
Теория электролитической диссоциации Химическая промышленность России. 9 класс
Химическая промышленность России. 9 класс Основы кристаллохимии
Основы кристаллохимии Скорость химических реакций. Факторы, влияющие на скорость химической реакции (лекция № 5)
Скорость химических реакций. Факторы, влияющие на скорость химической реакции (лекция № 5) Строение и функции биополимеров
Строение и функции биополимеров Вуглеводи
Вуглеводи Хлороводород. Соляная кислота
Хлороводород. Соляная кислота Термо-и радиационностойкие полимерные матрицы для композиционных материалов
Термо-и радиационностойкие полимерные матрицы для композиционных материалов Типы химических реакций
Типы химических реакций Буферное кислотно - основное взаимодействие
Буферное кислотно - основное взаимодействие Розв’язування задач на приготування розчинів із кристалогідратів
Розв’язування задач на приготування розчинів із кристалогідратів Сорбіт C6H14O6
Сорбіт C6H14O6 Алкены – непредельные углеводороды. Получение, химические свойства и применение
Алкены – непредельные углеводороды. Получение, химические свойства и применение Реакции ионного обмена
Реакции ионного обмена Подготовка к ВПР по химии. 11 класс
Подготовка к ВПР по химии. 11 класс S-элементтердің жалпы сипаттамасы
S-элементтердің жалпы сипаттамасы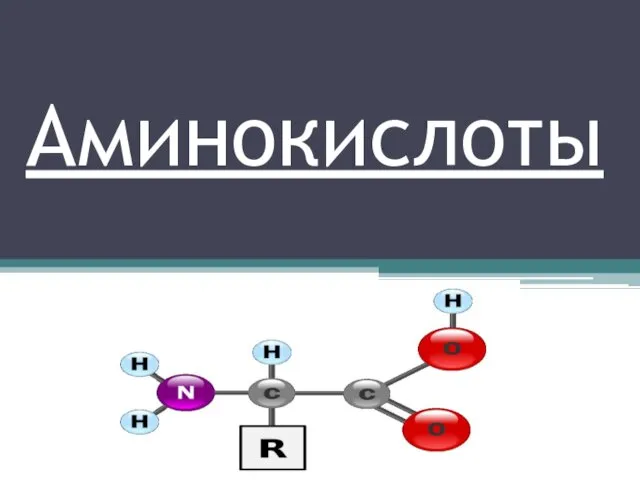 Аминокислоты. Классификация аминокислот
Аминокислоты. Классификация аминокислот Геохимические методы исследований
Геохимические методы исследований Основные интермедиаты в органических реакциях. Часть 1
Основные интермедиаты в органических реакциях. Часть 1 Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння ФОСФОР и его соединения
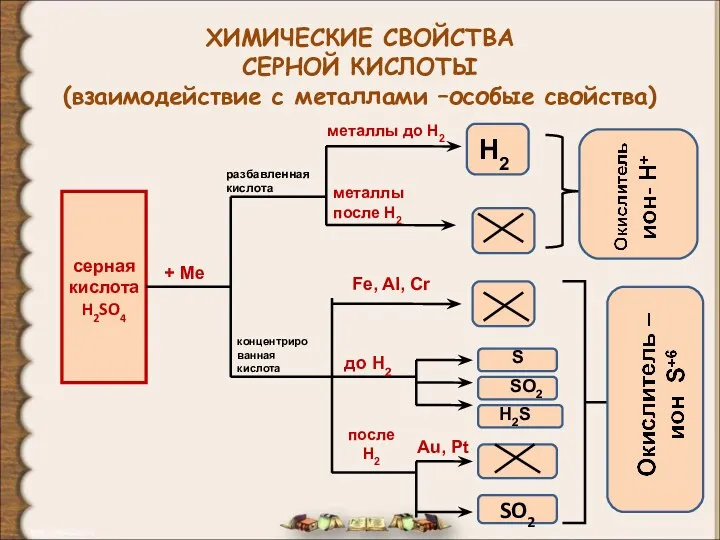
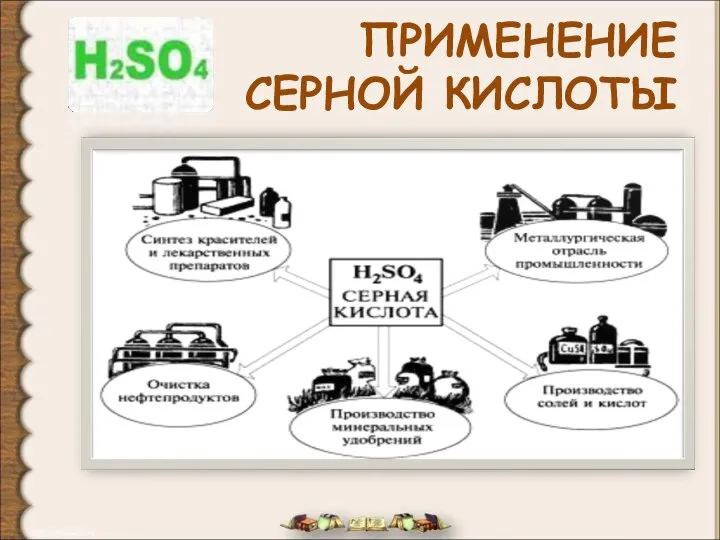
ФОСФОР и его соединения Химические свойства серной кислоты
Химические свойства серной кислоты Цепные химические реакции
Цепные химические реакции