Содержание
- 2. Ошибка Убери лишнее. (Найдите неэлектролиты) О2 NaOH Ошибка NaCl Ошибка K2SO4 CO2 Ошибка H2SO4 CaCO3 Ошибка
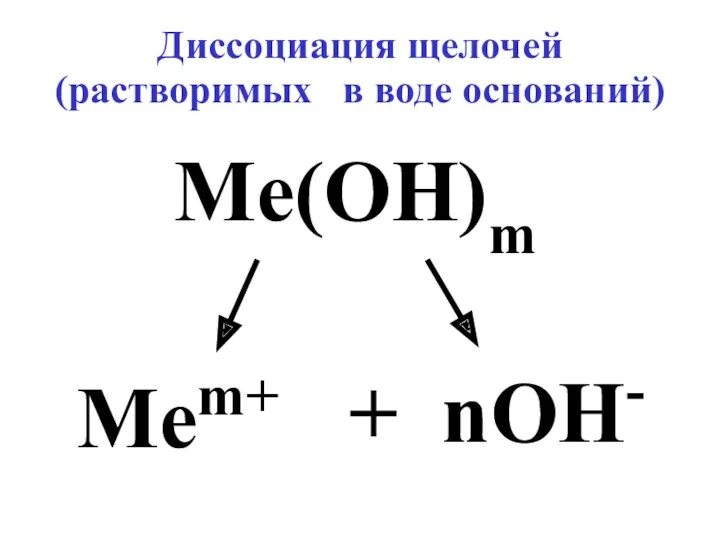
- 3. Диссоциация щелочей (растворимых в воде оснований) Me(OH)m Mem+ + nOH-
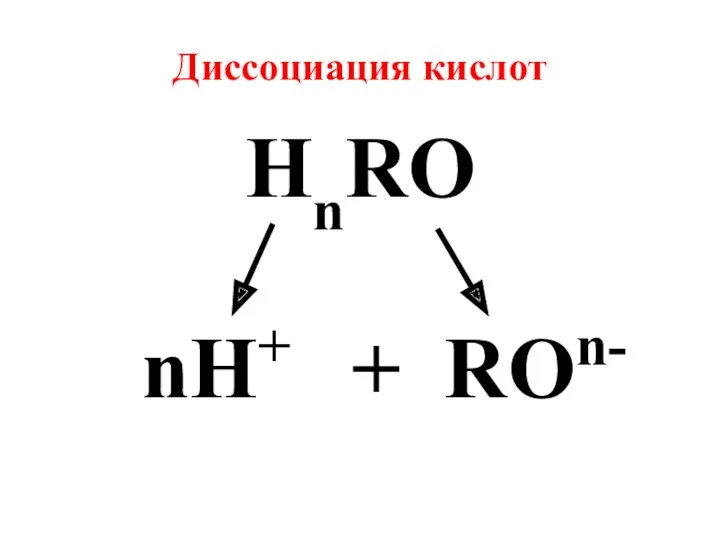
- 4. Диссоциация кислот HnRO nH+ + ROn-
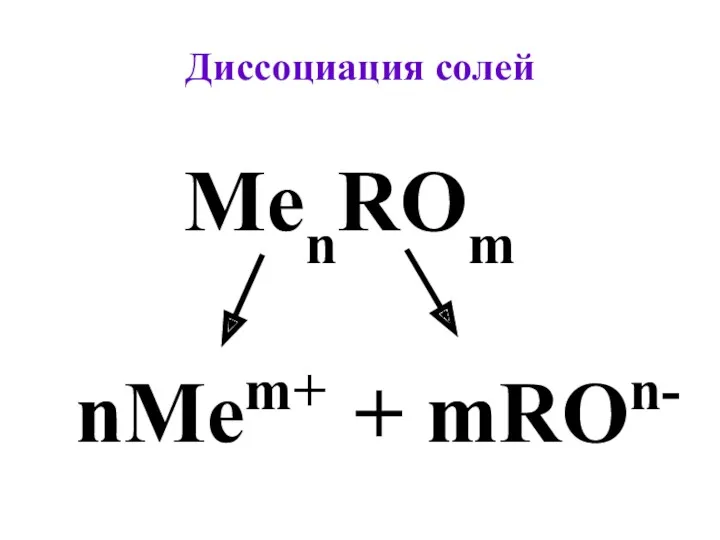
- 5. Диссоциация cолей MenROm nMem+ + mROn-
- 6. Реакции обмена AB + CD = AD + CB
- 8. Тема урока: Реакции ионного обмена.
- 9. Реакция ионного обмена РИО (реакции ионного обмена) – это реакции протекающие между электролитами. Пример: Взаимодействие сульфата
- 10. Реакция ионного обмена РИО (реакции ионого обмена) – это реакции протекающие между электролитами. Пример: Взаимодействие хлорида
- 11. Реакция ионного обмена РИО (реакции ионного обмена) – это реакции протекающие между электролитами. Пример: Взаимодействие хлорида
- 12. Реакция ионного обмена РИО (реакции ионного обмена) – это реакции протекающие между электролитами. Пример: Взаимодействие хлорида
- 13. Реакция ионного обмена РИО (реакции ионного обмена) – это реакции протекающие между электролитами. Пример: Взаимодействие хлорида
- 14. Реакция ионного обмена РИО (реакции ионного обмена) – это реакции протекающие между электролитами. Пример: Взаимодействие хлорида
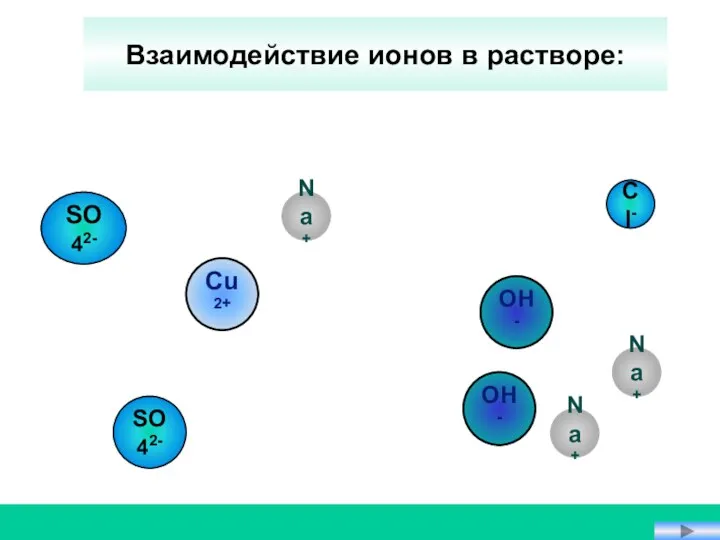
- 15. OH- Na+ Na+ Cu2+ Cl- SO42- SO42- Взаимодействие ионов в растворе: Na+ OH-
- 16. Условия протекания реакций ионного обмена 1. Если образуется осадок. 2. Если образуется газ. CO2 Na2CO3 +
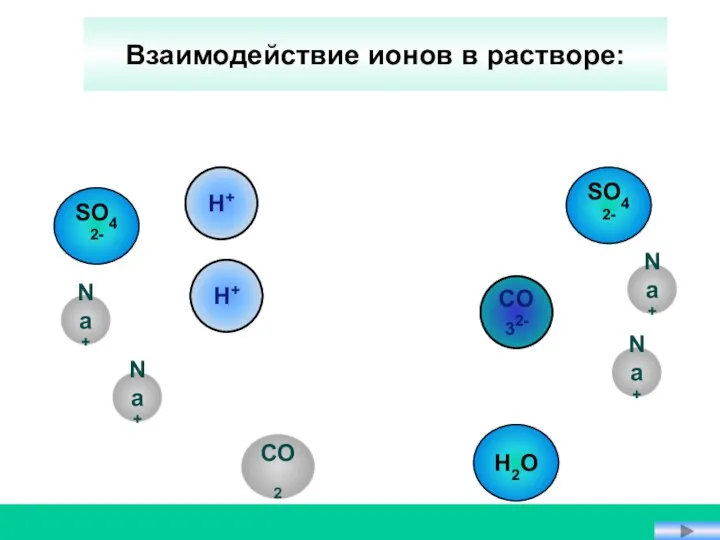
- 17. CO32- Na+ CO2 H+ SO42- Взаимодействие ионов в растворе: SO42- H2O Na+ H+ Na+ Na+
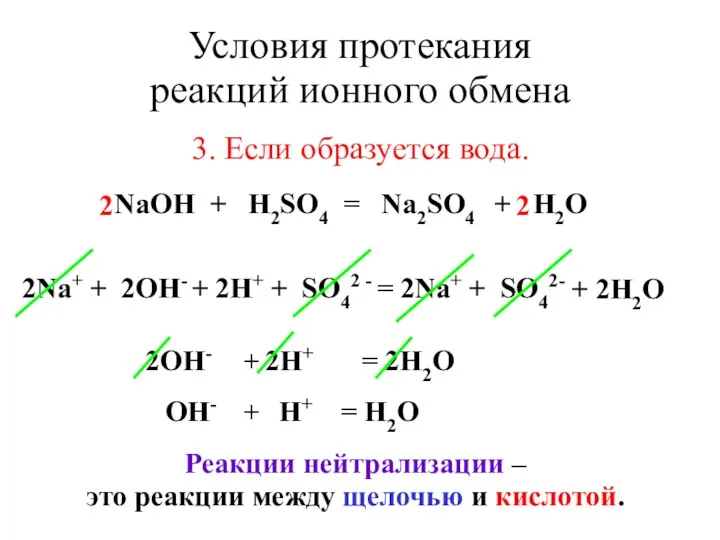
- 18. Условия протекания реакций ионного обмена 3. Если образуется вода. NaOH + H2SO4 = Na2SO4 + H2O
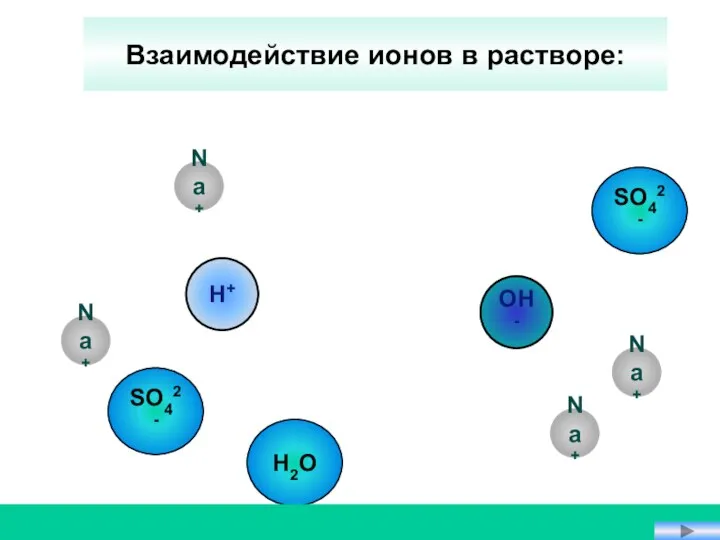
- 19. OH- Na+ Na+ H+ Н2О Взаимодействие ионов в растворе: Na+ SO42- Na+ SO42-
- 20. Образование осадочных пород Гипс Известняк, мел Ca 2+ + SO4 2- = CaSO4 Ca 2+ +
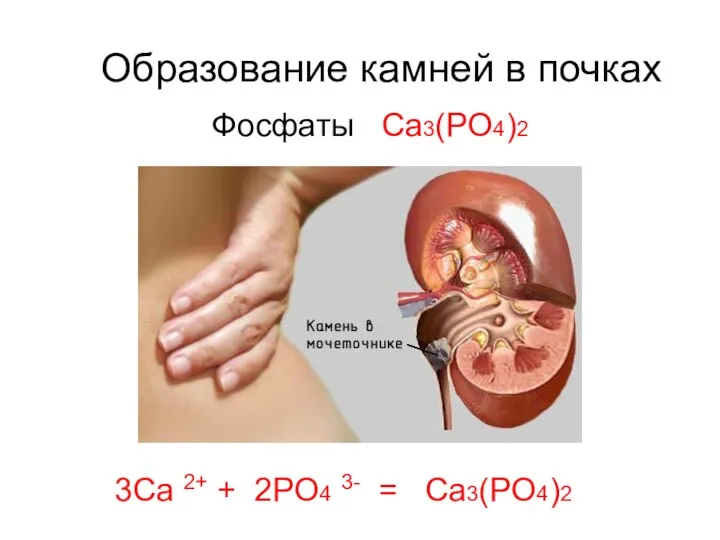
- 21. Образование камней в почках Фосфаты Ca3(PO4)2 3Ca 2+ + 2PO4 3- = Ca3(PO4)2
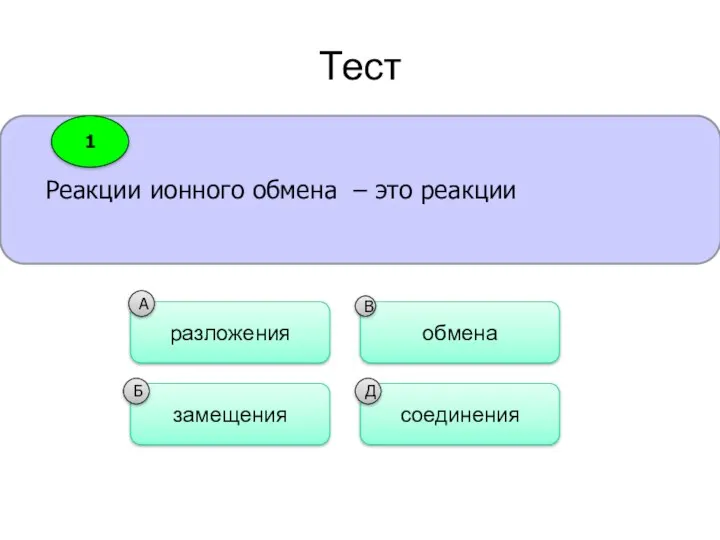
- 22. Тест Реакции ионного обмена – это реакции разложения замещения обмена соединения В А Б Д 1
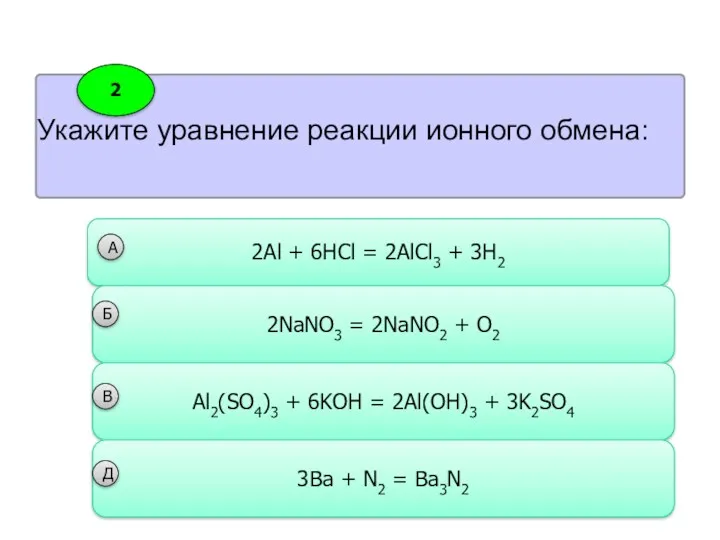
- 23. Укажите уравнение реакции ионного обмена: 2 2Al + 6HCl = 2AlCl3 + 3H2 А 2NaNO3 =
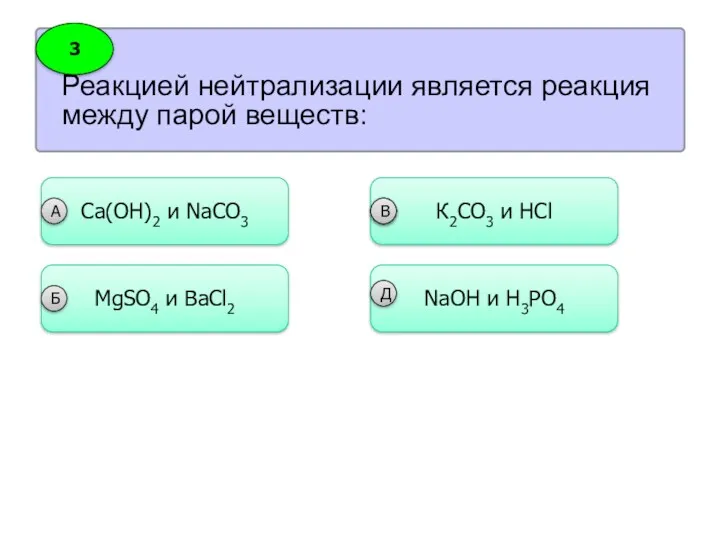
- 24. Реакцией нейтрализации является реакция между парой веществ: 3 Сa(OH)2 и NaCO3 А MgSO4 и BaCl2 Б
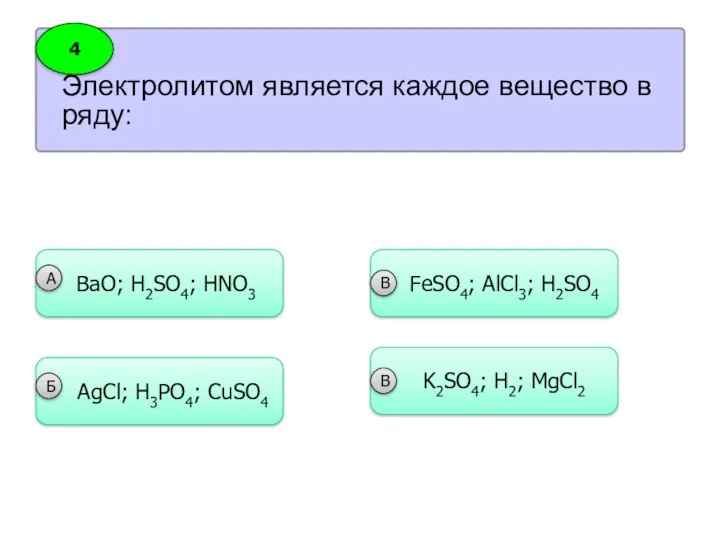
- 25. Электролитом является каждое вещество в ряду: 4 ВaO; H2SO4; HNO3 А AgCl; H3PO4; CuSO4 Б FeSO4;
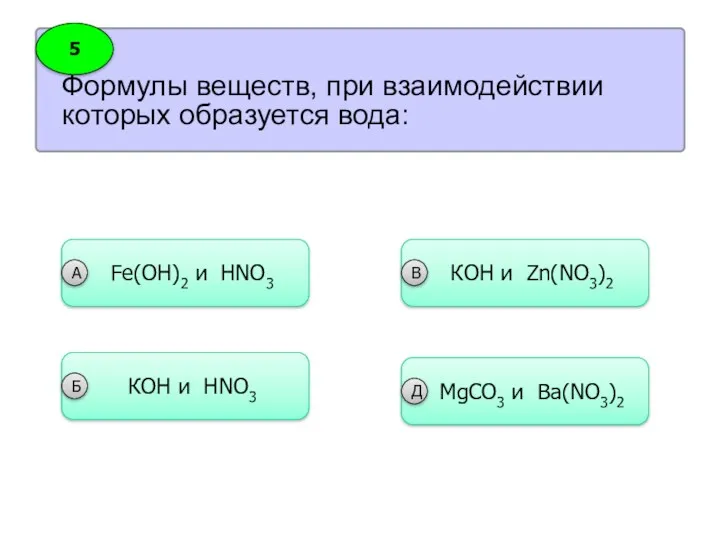
- 26. Формулы веществ, при взаимодействии которых образуется вода: 5 Fe(OH)2 и HNO3 А КOH и HNO3 Б
- 27. Ответы 1. В 2. В 3. Д 4. Б 5. Б
- 28. Оценка три задания правильно – «3» четыре задания правильно – «4» пять заданий правильно – «5»
- 29. Домашнее задание Составьте полные и сокращенные ионные уравнения реакций между растворами веществ: CuSO4 и KOH FeCl3
- 31. Скачать презентацию














 Atomic structure
Atomic structure Растворимость. Равновесие системы осадок-раствор
Растворимость. Равновесие системы осадок-раствор 20231004_agregatnye_sostoyaniya_-_kopiya
20231004_agregatnye_sostoyaniya_-_kopiya Утворення асимілятів та їхнє перетворення
Утворення асимілятів та їхнє перетворення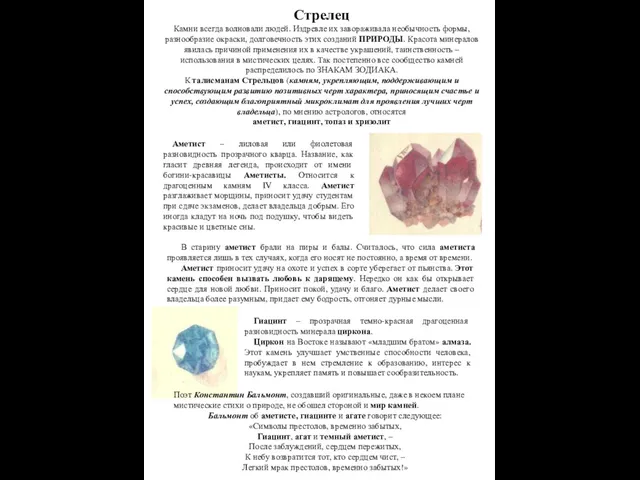 Камни и Стрелец
Камни и Стрелец Виды топлива
Виды топлива Природный и попутный нефтяной газ
Природный и попутный нефтяной газ Аммиак. Состав вещества
Аммиак. Состав вещества Анионы. Группы анионов
Анионы. Группы анионов Химическая промышленность Донецкой области
Химическая промышленность Донецкой области Химический эквивалент. Формульные единицы
Химический эквивалент. Формульные единицы Оксиды, свойства и способы получения
Оксиды, свойства и способы получения Первичная переработка нефти
Первичная переработка нефти Реакции элиминирование галогеналканов
Реакции элиминирование галогеналканов Полимеры. Классификация полимеров
Полимеры. Классификация полимеров Синтетичні високомолекулярні речовини і полімерні матеріали на їх основі
Синтетичні високомолекулярні речовини і полімерні матеріали на їх основі Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов
Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері
Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері Высокомолекулярные соединения. Общий курс
Высокомолекулярные соединения. Общий курс Окислительно-восстановительные реакции. Урок в 11 классе
Окислительно-восстановительные реакции. Урок в 11 классе Валентные возможности атомов. Степень окисления
Валентные возможности атомов. Степень окисления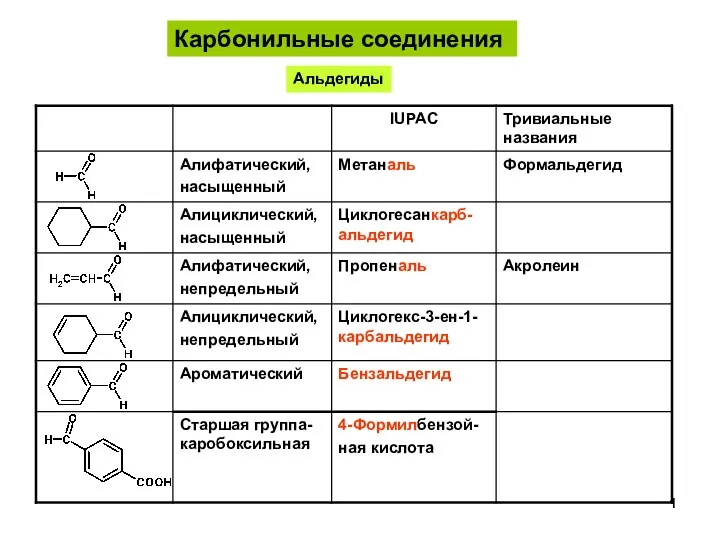 АльдегидыКетоны-1
АльдегидыКетоны-1 Интересные свойства редких металлов
Интересные свойства редких металлов Соединения железа
Соединения железа Способы выражения концентрации растворов
Способы выражения концентрации растворов Инертные газы
Инертные газы Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева
Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева Угольная кислота и ее соли. 9 класс
Угольная кислота и ее соли. 9 класс