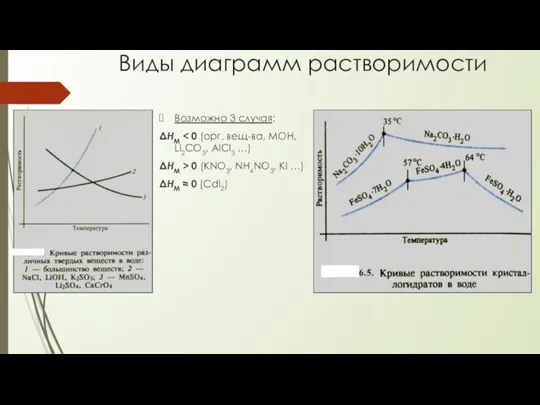
Растворимость
К нерастворимым относят вещества, растворимость которых меньше 0,001 моль/л:
сульфиды, гидроксиды, сульфиты,
хроматы, средние карбонаты и фосфаты металлов, кроме производных щелочных металлов и аммония.
к малорастворимым − вещества с растворимостью 0,001-0,1 моль/л:
Карбонат, фторид и фосфат лития
к растворимым − вещества с растворимостью более 0,1 моль/л.
почти все ацетаты, нитраты и тиоцианаты металлов и аммония, хлориды, бромиды и иодиды металлов и аммония, кроме галогенидов свинца(II), меди(I), ртути(I) и серебра(I); сульфаты металлов, за исключением сульфатов щелочноземельных металлов, свинца и серебра.
Количественно растворимость измеряется как концентрация насыщенного раствора
Растворимость – это способность вещества растворяться в данном растворителе при заданной температуре.

![Равновесие системы «осадок-раствор» AgCl(тв)=Ag+(водн.) + Cl—(водн.) K = [Ag+][ Cl—]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169962/slide-2.jpg)







 Химическая посуда и ее назначения (6)
Химическая посуда и ее назначения (6) Теория электролитической диссоциации
Теория электролитической диссоциации Искусственные полимеры
Искусственные полимеры Арены. Бензол и его гомологи
Арены. Бензол и его гомологи Свойства и способы получения алкадиенов
Свойства и способы получения алкадиенов Электрокинетические свойства дисперсных систем
Электрокинетические свойства дисперсных систем Значення води і водних розчинів у природі та житті людини. Кислотні дощі
Значення води і водних розчинів у природі та житті людини. Кислотні дощі Циклоалкандар
Циклоалкандар Неоднородные системы, их классификация, методы разделения. Лекция 4
Неоднородные системы, их классификация, методы разделения. Лекция 4 Циклические углеводороды
Циклические углеводороды Неметаллы
Неметаллы Электролиз расплавов и растворов электролитов
Электролиз расплавов и растворов электролитов Оксиды, свойства и способы получения
Оксиды, свойства и способы получения Неорганические наноматериалы (свойства, технология, применение)
Неорганические наноматериалы (свойства, технология, применение) Язык химии
Язык химии Неизотермический процесс в химическом реакторе. Лекция 8
Неизотермический процесс в химическом реакторе. Лекция 8 Сильные и слабые электролиты. Степень диссоциации
Сильные и слабые электролиты. Степень диссоциации Естери. Класифікація та номенклатура естерів
Естери. Класифікація та номенклатура естерів Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования
Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования Галогены. Положение в периодической системе. Химические свойства
Галогены. Положение в периодической системе. Химические свойства Органическая химия. Этапы развития органической химии
Органическая химия. Этапы развития органической химии Борьба с биологической коррозией
Борьба с биологической коррозией Энергоресурсы и их использование
Энергоресурсы и их использование Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Углеводороды из Башкортостана
Углеводороды из Башкортостана Основные положения теории резонанса
Основные положения теории резонанса Методы получения органических галогенидов
Методы получения органических галогенидов Энергетика химических процессов
Энергетика химических процессов