Содержание
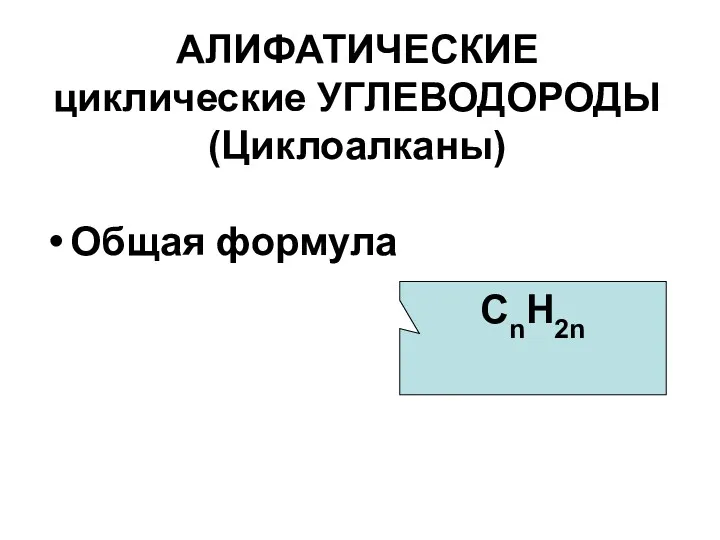
- 2. АЛИФАТИЧЕСКИЕ циклические УГЛЕВОДОРОДЫ (Циклоалканы) Общая формула СnH2n
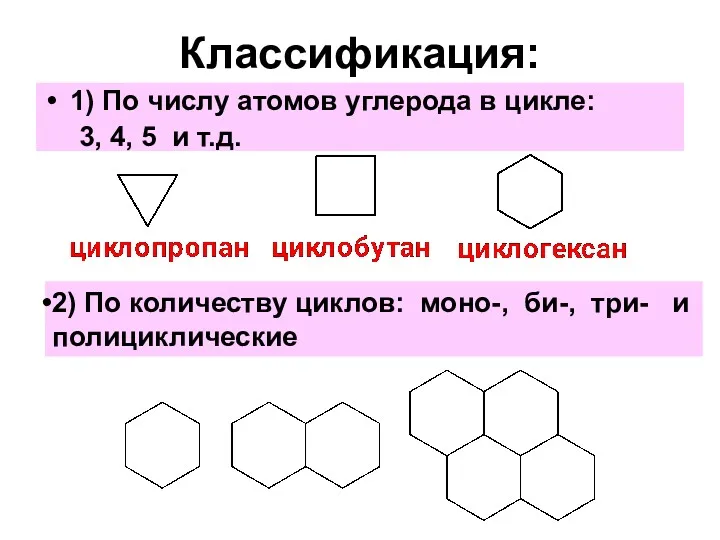
- 3. Классификация: 1) По числу атомов углерода в цикле: 3, 4, 5 и т.д. 2) По количеству
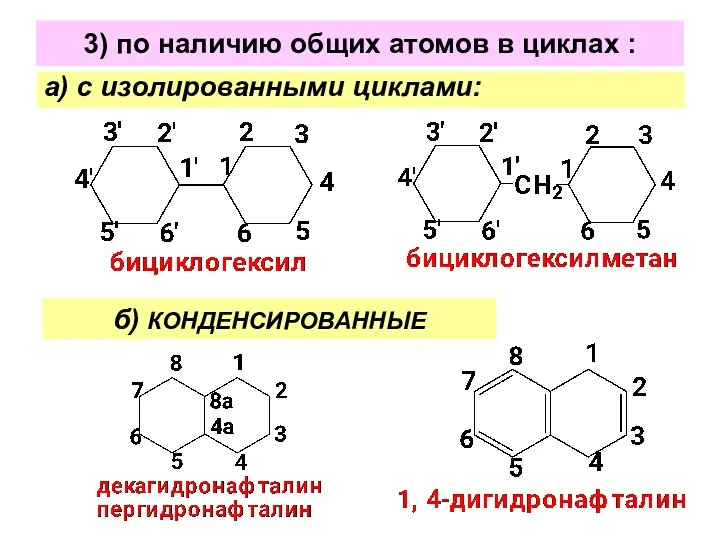
- 4. 3) по наличию общих атомов в циклах : а) с изолированными циклами: б) КОНДЕНСИРОВАННЫЕ
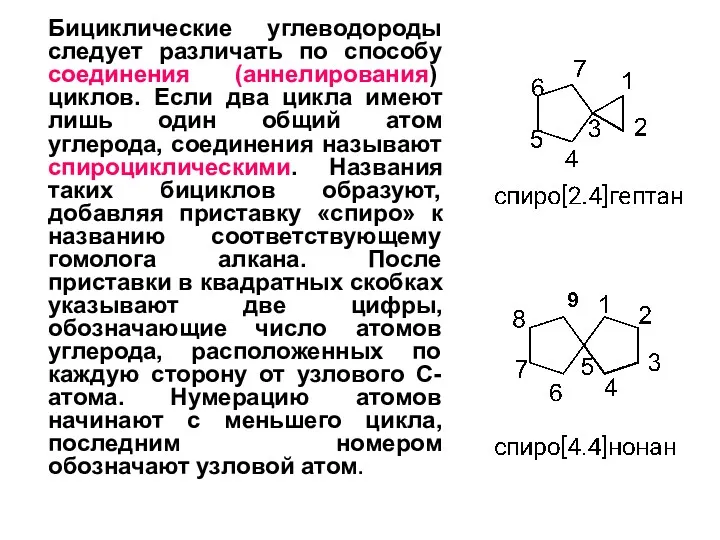
- 5. Бициклические углеводороды следует различать по способу соединения (аннелирования) циклов. Если два цикла имеют лишь один общий
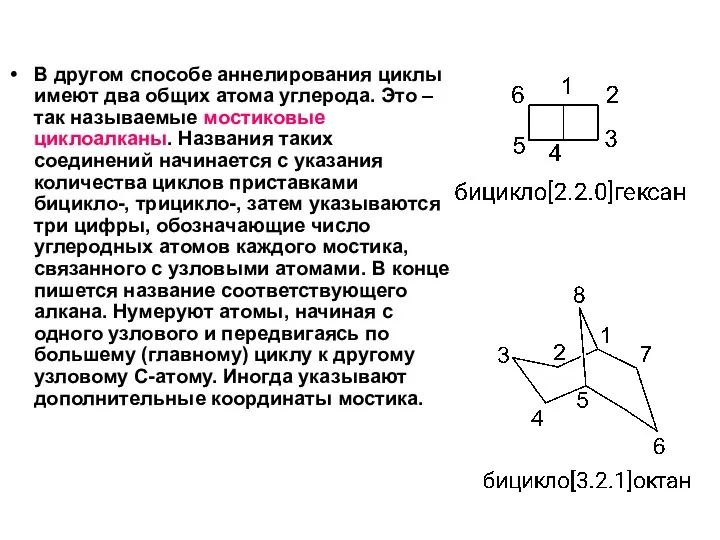
- 6. В другом способе аннелирования циклы имеют два общих атома углерода. Это – так называемые мостиковые циклоалканы.
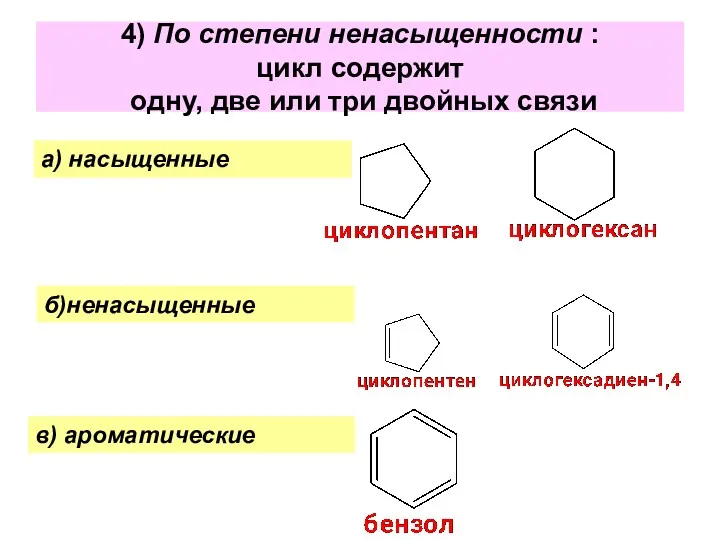
- 7. 4) По степени ненасыщенности : цикл содержит одну, две или три двойных связи а) насыщенные б)ненасыщенные
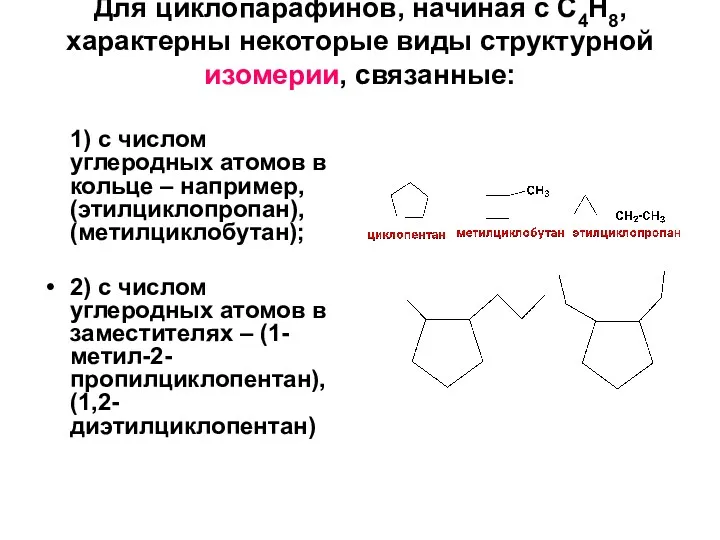
- 8. Для циклопарафинов, начиная с C4H8, характерны некоторые виды структурной изомерии, связанные: 1) с числом углеродных атомов
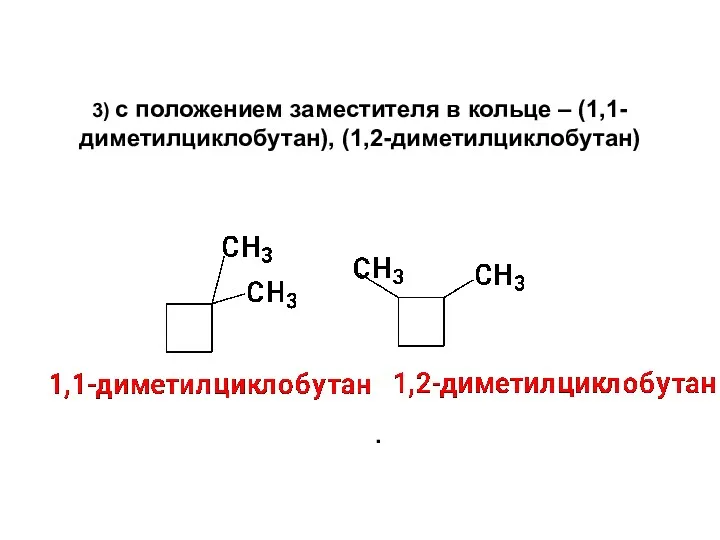
- 9. 3) с положением заместителя в кольце – (1,1-диметилциклобутан), (1,2-диметилциклобутан) .
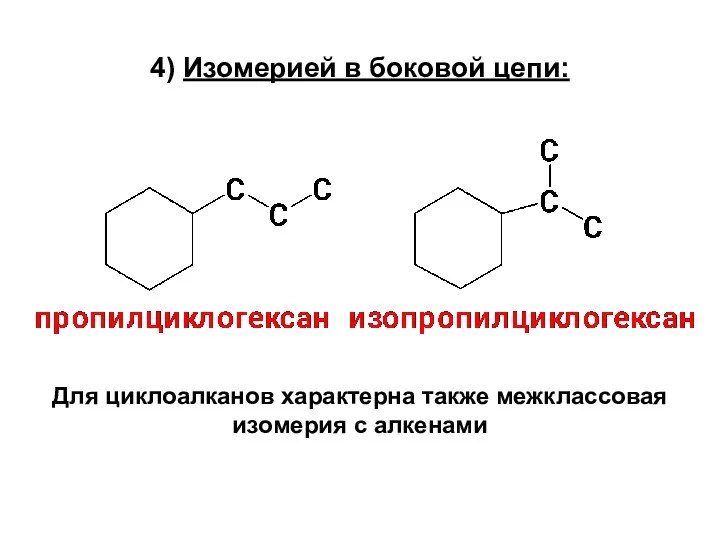
- 10. 4) Изомерией в боковой цепи: Для циклоалканов характерна также межклассовая изомерия с алкенами
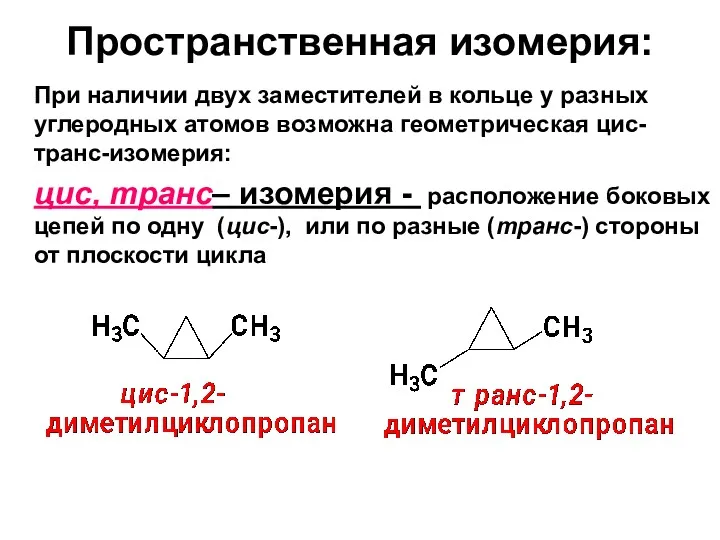
- 11. Пространственная изомерия: При наличии двух заместителей в кольце у разных углеродных атомов возможна геометрическая цис-транс-изомерия: цис,
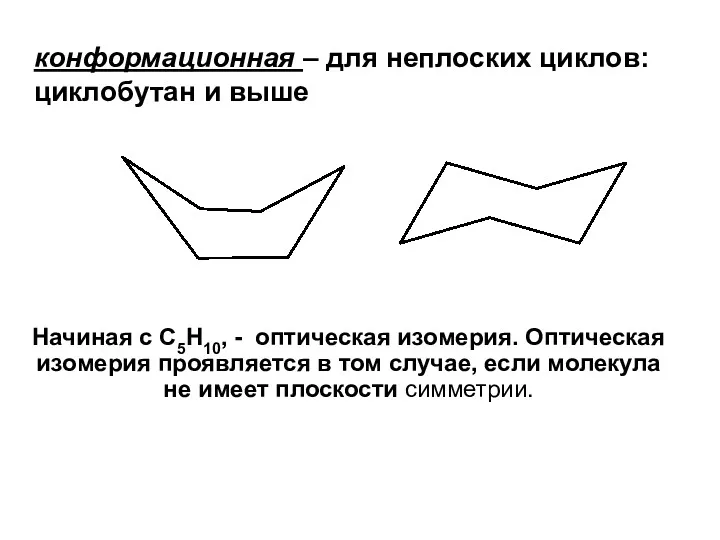
- 12. конформационная – для неплоских циклов: циклобутан и выше Начиная с C5H10, - оптическая изомерия. Оптическая изомерия
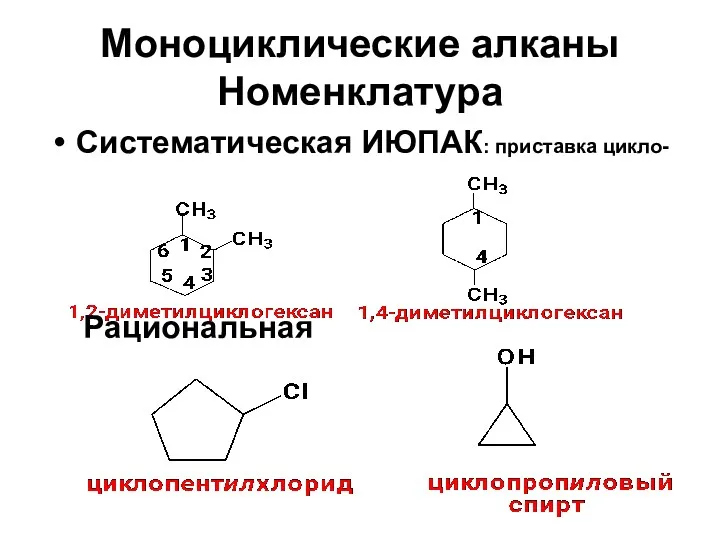
- 13. Моноциклические алканы Номенклатура Систематическая ИЮПАК: приставка цикло- Рациональная
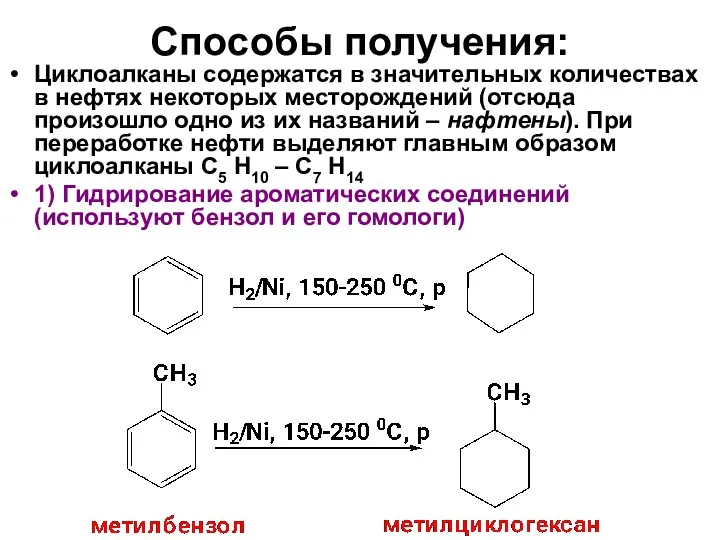
- 14. Способы получения: Циклоалканы содержатся в значительных количествах в нефтях некоторых месторождений (отсюда произошло одно из их
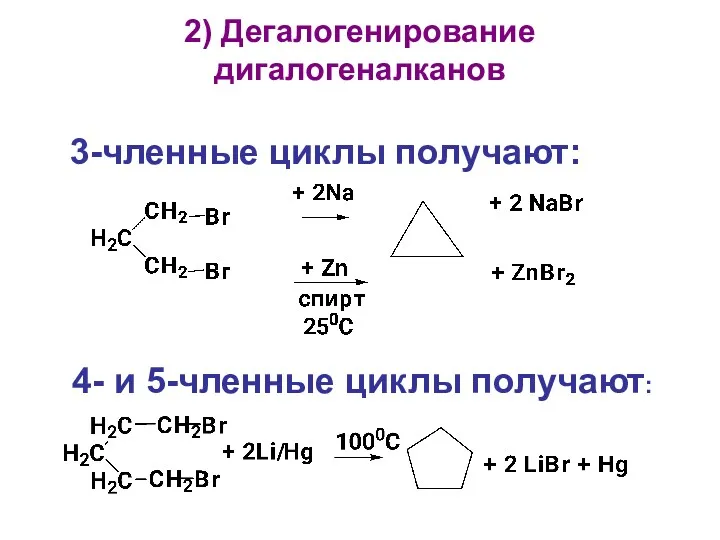
- 15. 2) Дегалогенирование дигалогеналканов 3-членные циклы получают: 4- и 5-членные циклы получают:
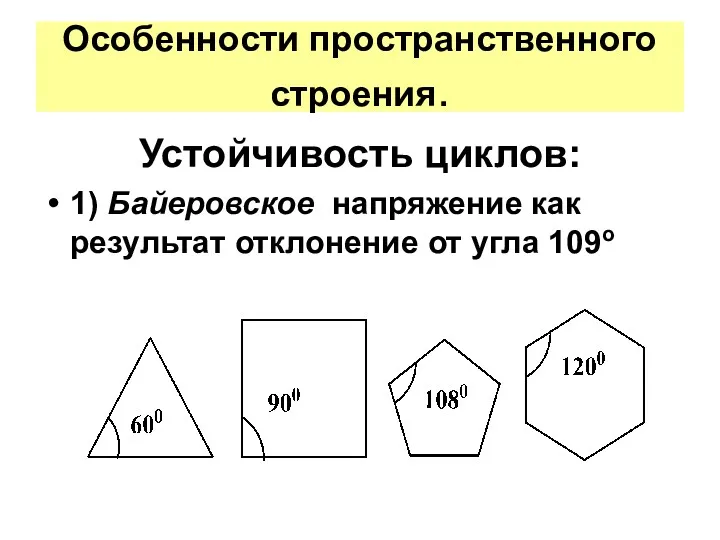
- 16. Особенности пространственного строения. Устойчивость циклов: 1) Байеровское напряжение как результат отклонение от угла 109o
- 17. Для циклопропана межъядерные углы составляют 60º,, для циклобутана – 90º, а в циклопентане – 108º. Нормальный
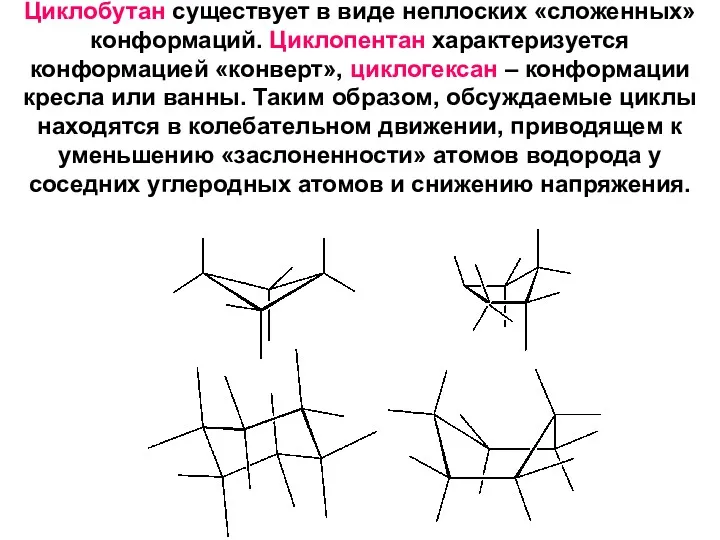
- 18. Циклобутан существует в виде неплоских «сложенных» конформаций. Циклопентан характеризуется конформацией «конверт», циклогексан – конформации кресла или
- 19. Физические свойства Физические свойства циклоалканов закономерно изменяются с ростом их молекулярной массы. Пpи ноpмальных условиях циклопpопан
- 20. Химические свойства циклоалканов Химические свойства циклоалканов сильно зависят от размера цикла, определяющего его устойчивость. Трех- и
- 21. В других циклах (начиная с С5) угловое напряжение снимается благодаря неплоскому строению молекул. Наиболее устойчивыми являются
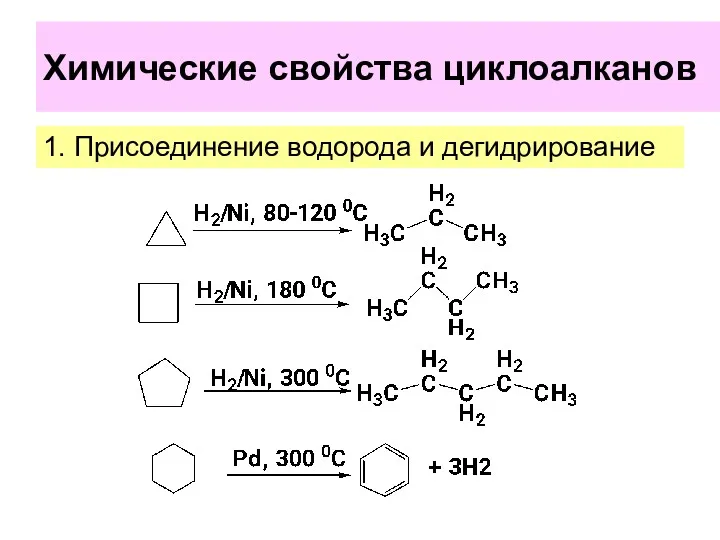
- 22. Химические свойства циклоалканов 1. Присоединение водорода и дегидрирование
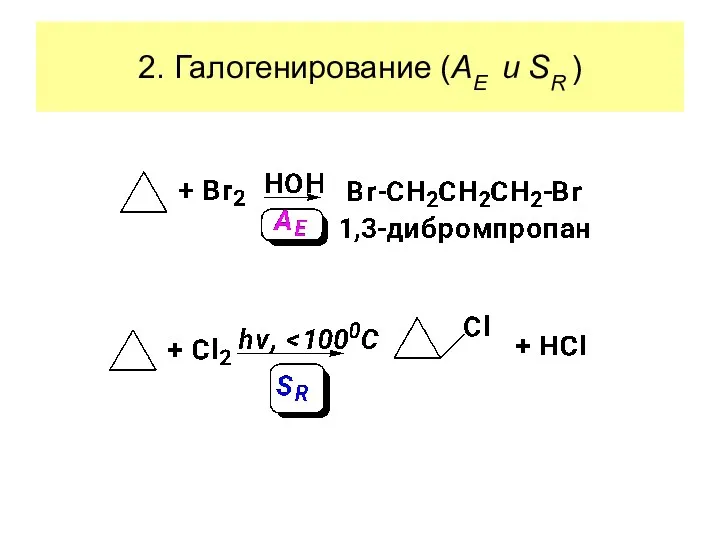
- 23. 2. Галогенирование (AE и SR )
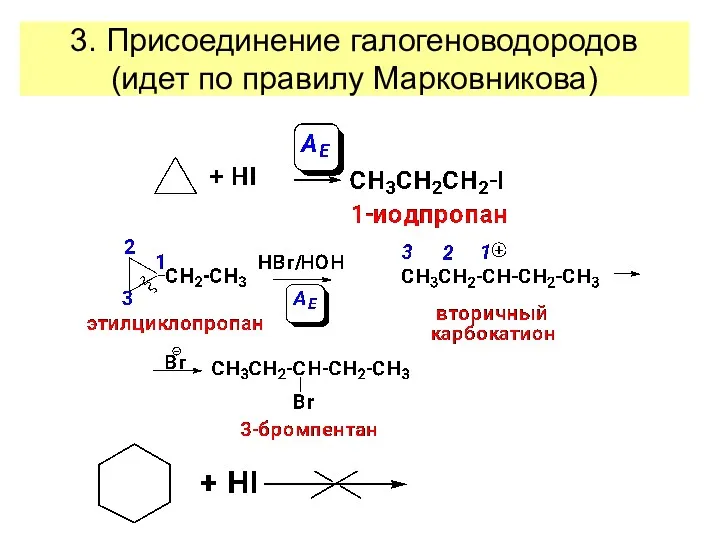
- 24. 3. Присоединение галогеноводородов (идет по правилу Марковникова)
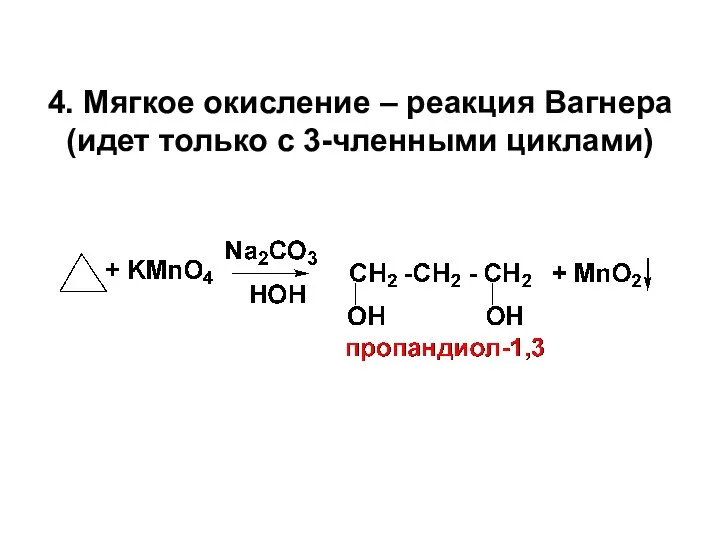
- 25. 4. Мягкое окисление – реакция Вагнера (идет только с 3-членными циклами)
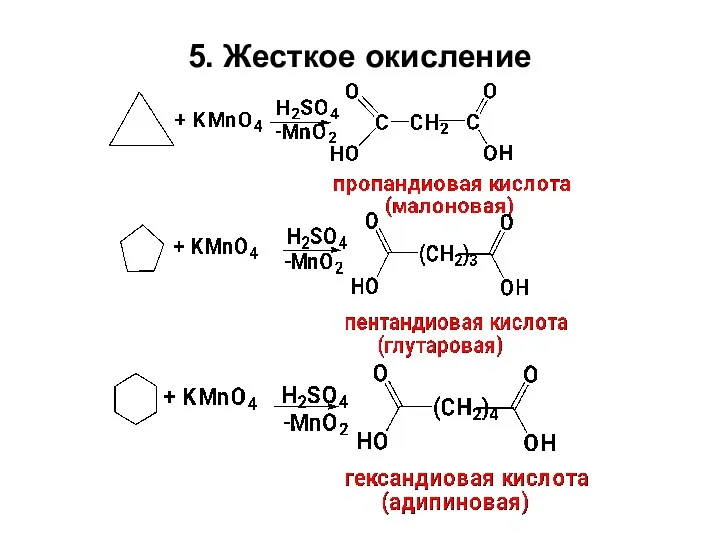
- 26. 5. Жесткое окисление
- 28. Скачать презентацию




 Высокомолекулярные соединения и супрамолекулярные структуры. (Лекция 3)
Высокомолекулярные соединения и супрамолекулярные структуры. (Лекция 3) Химические элементы в организме человека
Химические элементы в организме человека Олимпиадные задачи муниципального этапа по химии
Олимпиадные задачи муниципального этапа по химии Энергетика химических процессов
Энергетика химических процессов Углеводы. Олигосахариды. Полисахариды. Биоорганическая химия
Углеводы. Олигосахариды. Полисахариды. Биоорганическая химия Химическая промышленность
Химическая промышленность Alkaline earth metals
Alkaline earth metals Тепло- и массообменные процессы при синтезе Фишера-Тропша
Тепло- и массообменные процессы при синтезе Фишера-Тропша Новые интеллектуальные материалы на основе полимеров
Новые интеллектуальные материалы на основе полимеров Atmospheric chemistry
Atmospheric chemistry Обмен липидов-2
Обмен липидов-2 Розчин та його компоненти
Розчин та його компоненти Основные понятия и законы химии
Основные понятия и законы химии Коллоидно-дисперсные системы
Коллоидно-дисперсные системы Строение атома в соответствии с положением в периодической системе химических элементов Д.И. Менделеева
Строение атома в соответствии с положением в периодической системе химических элементов Д.И. Менделеева Химическая связь
Химическая связь Коррозия металлов
Коррозия металлов Кислородсодержащие органические соединения- спирты. 10 класс
Кислородсодержащие органические соединения- спирты. 10 класс Elements 17 (7A) group. Study of the properties of halogens and the determination of halide ions in aqueous solution
Elements 17 (7A) group. Study of the properties of halogens and the determination of halide ions in aqueous solution Карбоновые кислоты
Карбоновые кислоты Аморфные сплавы
Аморфные сплавы Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы
Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы Total Synthesis of (−)-Chromodorolide B By a Computationally-Guided Radical
Total Synthesis of (−)-Chromodorolide B By a Computationally-Guided Radical Кристаллические и аморфные тела
Кристаллические и аморфные тела Классификация и генетическая связь углеводородов
Классификация и генетическая связь углеводородов Галогены. Элементы VII группы
Галогены. Элементы VII группы Химический состав и пищевая ценность продовольственных товаров
Химический состав и пищевая ценность продовольственных товаров Растворение как физико-химический процесс
Растворение как физико-химический процесс