Строение атома в соответствии с положением в периодической системе химических элементов Д.И. Менделеева презентация
Содержание
- 2. Почему ПСХЭ названа - ПЕРИОДИЧЕСКОЙ? ПСХЭ – это графическая запись ПЕРИОДИЧЕСКОГО ЗАКОНА!
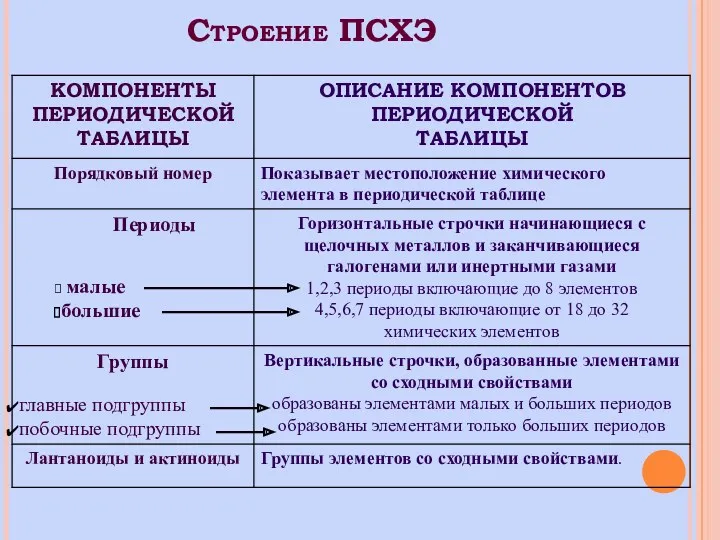
- 3. Строение ПСХЭ
- 4. Строение атома
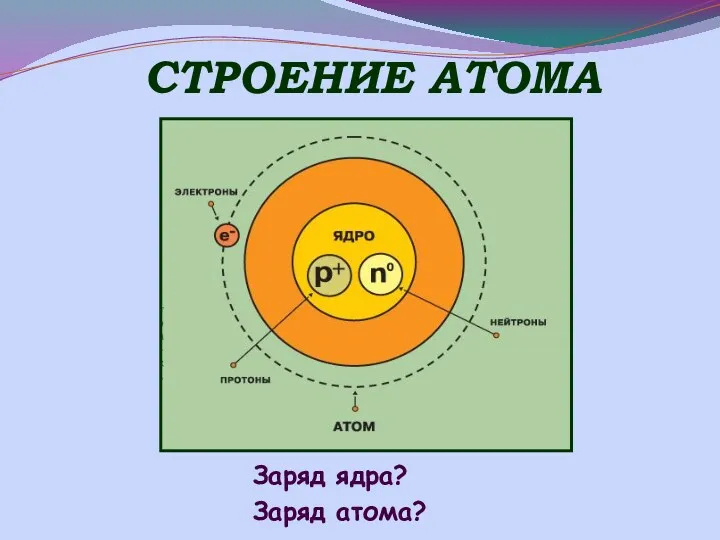
- 5. СТРОЕНИЕ АТОМА Заряд ядра? Заряд атома?
- 6. АТОМ p и n - нуклоны, из их массы слагается масса атома. Ядро атома ± p
- 7. Взаимосвязь положения элемента в ПСХЭ и строением его атома Порядковый номер элемента соответствует заряду ядра атома
- 8. Характеристика серы S Порядковый номер равен ?, следовательно заряд ядра + ?, общее количество электронов ?,
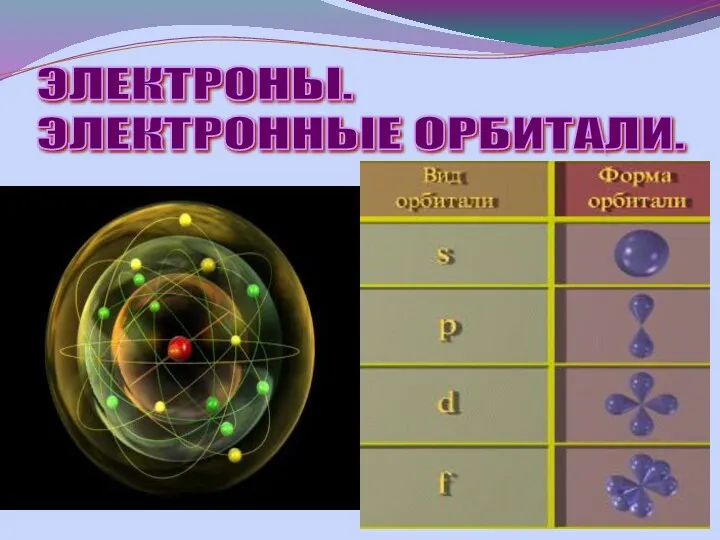
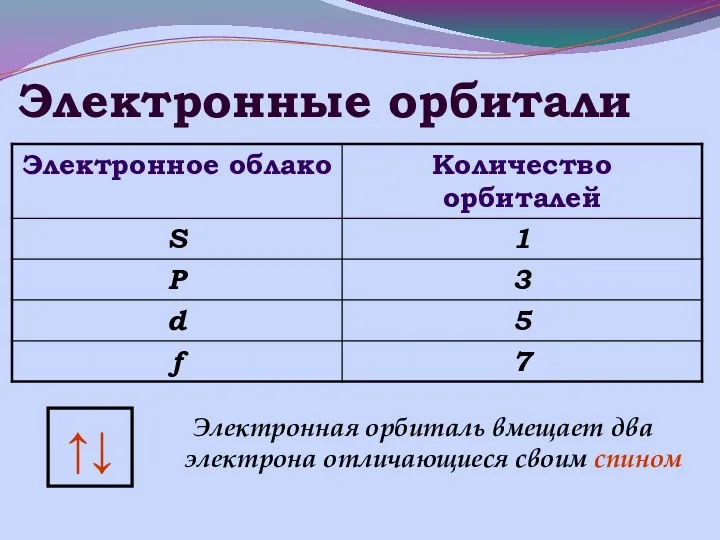
- 9. ЭЛЕКТРОНЫ. ЭЛЕКТРОННЫЕ ОРБИТАЛИ.
- 10. Электронные орбитали ↑↓ Электронная орбиталь вмещает два электрона отличающиеся своим спином
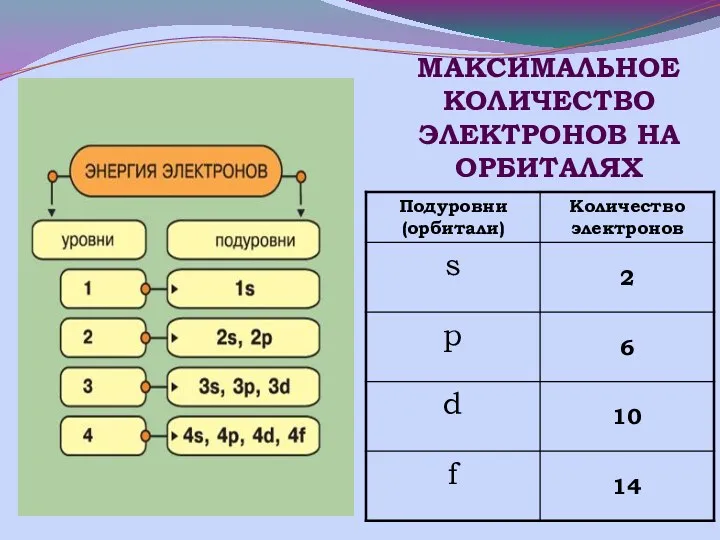
- 11. МАКСИМАЛЬНОЕ КОЛИЧЕСТВО ЭЛЕКТРОНОВ НА ОРБИТАЛЯХ
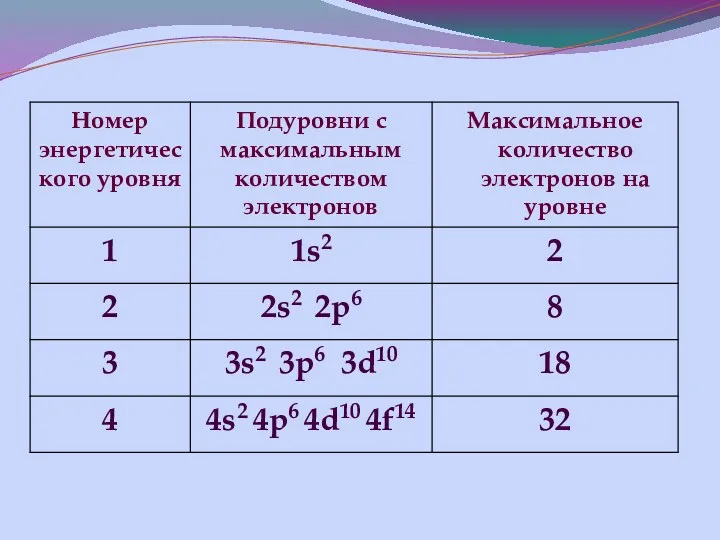
- 13. Строение энергетических уровней
- 14. ШКАЛА ЭНЕРГИИ 1s
- 15. Взаимосвязь положения элемента в ПСХЭ с электронным строением его атома 1. Порядковый номер элемента соответствует заряду
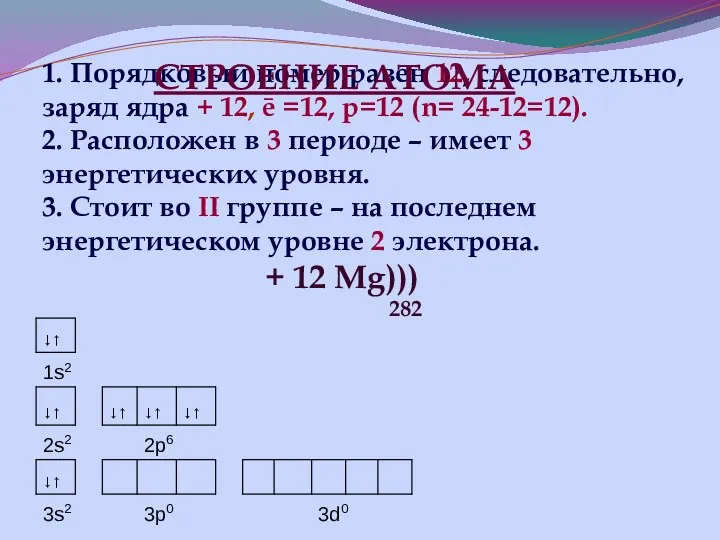
- 16. 1. Порядковый номер равен 12, следовательно, заряд ядра + 12, ē =12, р=12 (n= 24-12=12). 2.
- 17. Строение электронных оболочек атомов
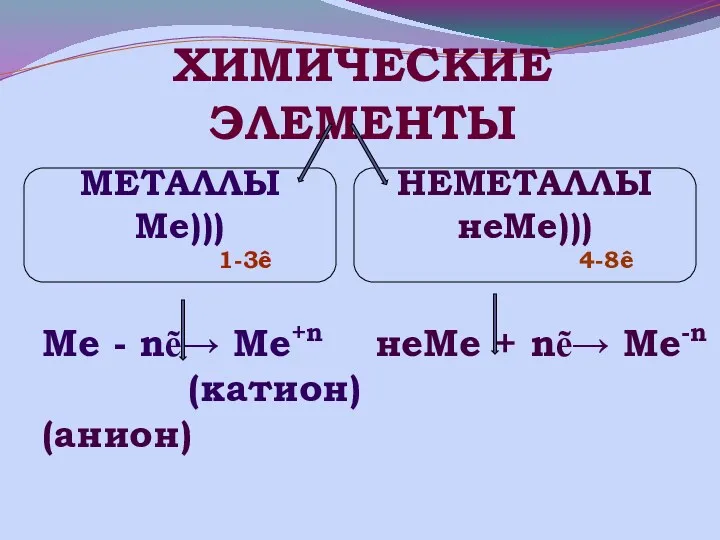
- 18. Ме - nẽ→ Ме+n неМе + nẽ→ Ме-n (катион) (анион) ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ МЕТАЛЛЫ Ме))) 1-3ê НЕМЕТАЛЛЫ
- 20. Скачать презентацию








 Синтетический каучук и его применение
Синтетический каучук и его применение Трансмиссионные масла
Трансмиссионные масла 20230816_belki_2
20230816_belki_2 Геохимия урана и тория в магматическом процессе
Геохимия урана и тория в магматическом процессе Вуглеводи
Вуглеводи Ртуть
Ртуть Единый государственный экзамен Химия 2021. Задание 3
Единый государственный экзамен Химия 2021. Задание 3 Химия нефти и газа
Химия нефти и газа Indicatori di pH
Indicatori di pH Пластмаси. Класифікація пластмас
Пластмаси. Класифікація пластмас Серная кислота
Серная кислота Александр Евгеньевич Ферсман
Александр Евгеньевич Ферсман Метал конструкциялық материалдар
Метал конструкциялық материалдар Місце хімії серед наук про природу
Місце хімії серед наук про природу Оксид углерода II. Угарный газ
Оксид углерода II. Угарный газ Углерод, как химический элемент и простое вещество
Углерод, как химический элемент и простое вещество Получение Н2, О2, щелочей
Получение Н2, О2, щелочей Беттік активті заттардың беттік қасиеттері
Беттік активті заттардың беттік қасиеттері Химия элементов VIIA группы
Химия элементов VIIA группы Химия и проблемы охраны окружающей среды
Химия и проблемы охраны окружающей среды Классы органических соединений
Классы органических соединений Взаимодействие атомов элементов-металлов и элементов-неметаллов между собой. Ионная связь. (Тема 10)
Взаимодействие атомов элементов-металлов и элементов-неметаллов между собой. Ионная связь. (Тема 10) Формы парфюмерно-косметической продукции
Формы парфюмерно-косметической продукции Химические процессы зоны гипергенеза
Химические процессы зоны гипергенеза Состав и классификация магматических горных пород
Состав и классификация магматических горных пород Активные формы кислорода. Антиоксиданты их физиологическая роль
Активные формы кислорода. Антиоксиданты их физиологическая роль Химия нефти и газа. Лекция № 1
Химия нефти и газа. Лекция № 1 Зависят ли свойства предельных одноатомных спиртов от их химического строения?
Зависят ли свойства предельных одноатомных спиртов от их химического строения?