Содержание
- 2. План 1) Определение коррозии металлов 2) Виды 3) Способы защиты от коррозии
- 3. Коррозия – самопроизвольное разрушение металлов под действием окружающей среды. Коррозия – окислительно-восстановительный процесс. Коррозия может происходить
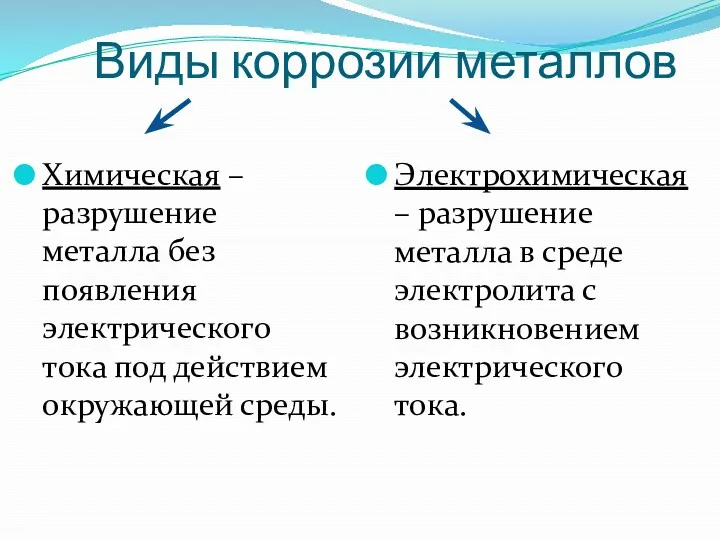
- 4. Виды коррозии металлов Химическая – разрушение металла без появления электрического тока под действием окружающей среды. Электрохимическая
- 5. Химическая коррозия Металл разрушается, взаимодействуя с окружающей средой. Такой тип коррозии присущ средам, которые не способны
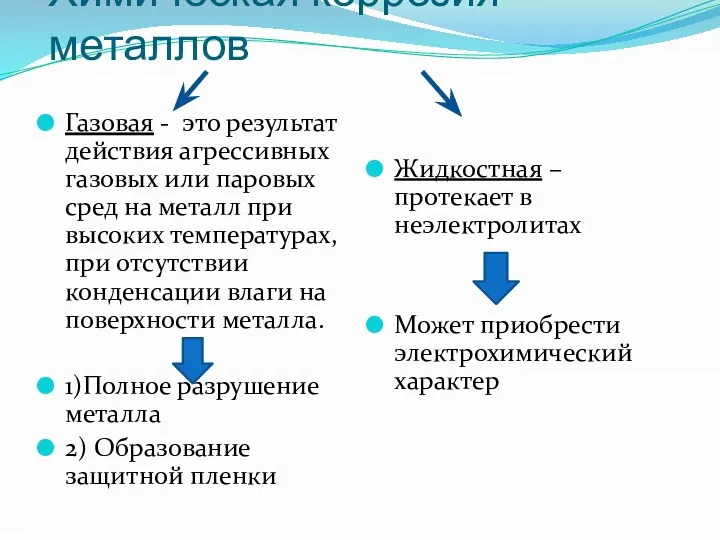
- 6. Химическая коррозия металлов Газовая - это результат действия агрессивных газовых или паровых сред на металл при
- 7. Электрохимическая коррозия Если металлическое изделие находится в среде электролита. Деполяризация – процесс отвода электронов с катодных
- 8. Электрохимическая коррозия металлов Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде.
- 9. Способы защиты от коррозии Покрытие поверхности металлов. Для защиты металлических поверхностей от коррозии ее покрывают лаком,
- 11. Скачать презентацию






 Уксусная кислота. Продуценты. Практическое использование
Уксусная кислота. Продуценты. Практическое использование Состав краски
Состав краски Вещества молекулярного и немолекулярного строения
Вещества молекулярного и немолекулярного строения Чистые вещества и смеси
Чистые вещества и смеси Металлы применяемые в строительстве
Металлы применяемые в строительстве Железо, его характеристики, свойства и соединения
Железо, его характеристики, свойства и соединения Бензол. Физические и химические свойства
Бензол. Физические и химические свойства Растворы. Электролитическая диссоциация
Растворы. Электролитическая диссоциация Химический элемент. Неон
Химический элемент. Неон Окислительно - восстановительные реакции
Окислительно - восстановительные реакции Окислительно-восстановительные реакции. Лекция 8
Окислительно-восстановительные реакции. Лекция 8 Қанықпаған көмірсутектердің реакцияға түсу қабілеттілігі
Қанықпаған көмірсутектердің реакцияға түсу қабілеттілігі Гірські породи
Гірські породи Елементи VІ групи головної підгрупи
Елементи VІ групи головної підгрупи Хімічний зв'язок і будова речовини
Хімічний зв'язок і будова речовини Основания и кислоты. Химические и физические свойства
Основания и кислоты. Химические и физические свойства Химическая связь в кластерах
Химическая связь в кластерах Важнейшие классы бинарных соединений – оксиды и летучие соединения
Важнейшие классы бинарных соединений – оксиды и летучие соединения Атом құрылысы
Атом құрылысы Материаловедение. Железо и железоуглеродистые сплавы. (Тема 7)
Материаловедение. Железо и железоуглеродистые сплавы. (Тема 7) Бескислородные керамические материалы
Бескислородные керамические материалы Материаловедение. Физические и химические структуры материалов
Материаловедение. Физические и химические структуры материалов Carbohydrates. Starch
Carbohydrates. Starch Химическое кафе Кислоты
Химическое кафе Кислоты Хімічні властивості кисню
Хімічні властивості кисню Вода. Химические свойства воды. Состав, нахождение в природе
Вода. Химические свойства воды. Состав, нахождение в природе Медь. Химические свойства. Получение меди. Применение
Медь. Химические свойства. Получение меди. Применение Степень окисления ОВР
Степень окисления ОВР