Содержание
- 2. Понятие окислительно-восстановительных реакций Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ,
- 3. Окисление - процесс отдачи электронов атомом, молекулой или ионом. Атом превращается в положительно заряженный ион: Zn0
- 4. Восстановление - процесс присоединения электронов атомом, молекулой или ионом. Атом превращается в отрицательно заряженный ион S0
- 5. Восстановители - атомы, молекулы или ионы, отдающие электроны. Они в процессе ОВР окисляются Типичные восстановители: ●
- 6. Окислители - атомы, молекулы или ионы, присоединяющие электроны. Они в процессе ОВР восстанавливаются Типичные окислители: ●
- 8. На проявление окислительно-восстановительных свойств влияет такой фактор, как устойчивость молекулы или иона. Чем прочнее частица, тем
- 9. Например, азот имеет высокую электроотрицательность и мог бы быть сильным окислителем в виде простого вещества, но
- 10. Определение степеней окисления атомов химических элементов K+1 Mn+7 O4-2 1+х+4(-2)=0
- 11. Если химический элемент находится в промежуточной степени окисления, то он проявляет свойства и окислителя, и восстановителя.
- 12. Задание 2. Определите степень окисления атомов химических элементов по формулам их соединений H2S, O2, NH3, HNO3,
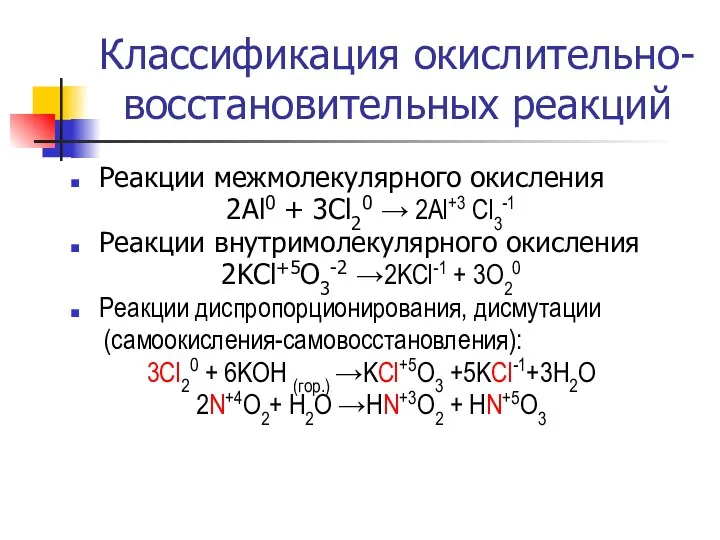
- 14. Классификация окислительно-восстановительных реакций Реакции межмолекулярного окисления 2Al0 + 3Cl20 → 2Al+3 Cl3-1 Реакции внутримолекулярного окисления 2KCl+5O3-2
- 15. Это полезно знать Степени окисления элементов в составе аниона соли такие же, как и в кислоте,
- 16. Окислительные свойства концентрированной серной кислоты Продукты восстановления серы: H2SO4 + оч.акт. металл (Mg, Li, Na…) →
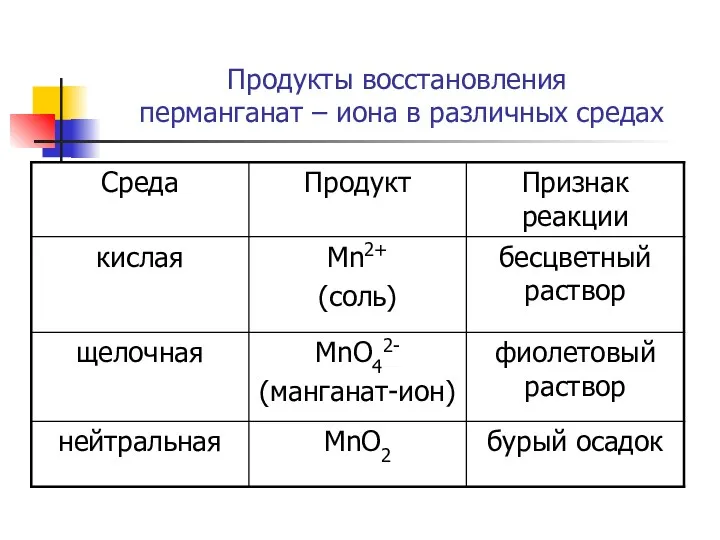
- 17. Продукты восстановления перманганат – иона в различных средах
- 18. Пероксид водорода в окислительно-восстановительных реакциях
- 19. Азотная кислота в окислительно-восстановительных реакциях Продукты восстановления азота: Концентрированная HNO3: N+5 +1e → N+4 (NO2) (Ni,
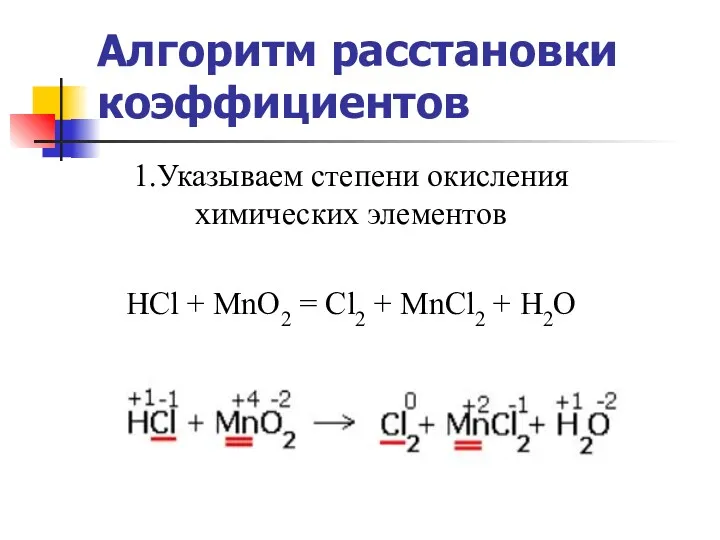
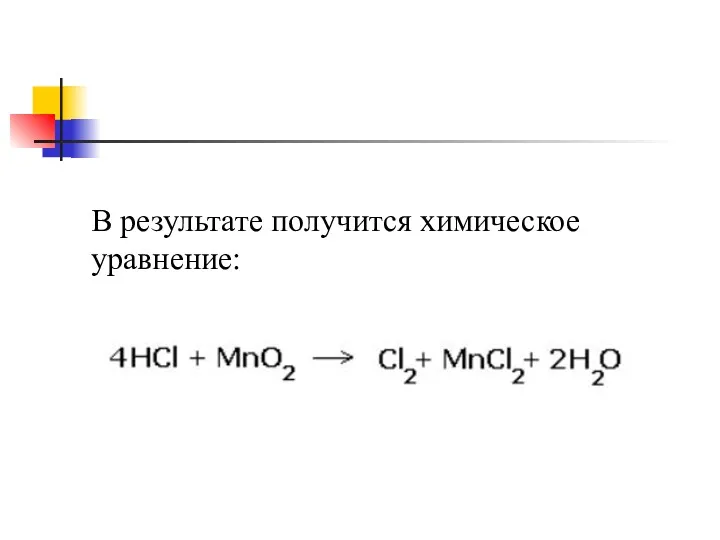
- 20. Алгоритм расстановки коэффициентов 1.Указываем степени окисления химических элементов HCl + MnO2 = Cl2 + MnCl2 +
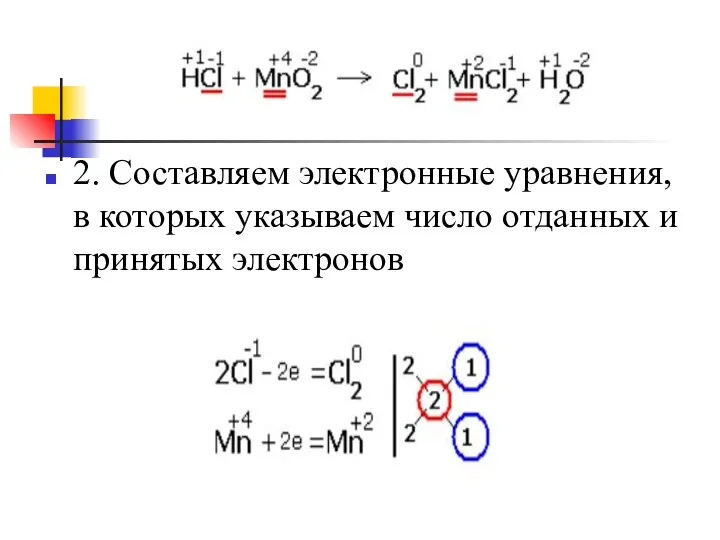
- 21. 2. Составляем электронные уравнения, в которых указываем число отданных и принятых электронов
- 22. В результате получится химическое уравнение:
- 24. Скачать презентацию
















 Соединения водорода
Соединения водорода Химическая промышленность
Химическая промышленность Химические свойства неорганических соединений
Химические свойства неорганических соединений Алкины — углеводороды, содержащие тройную связь между атомами углерода
Алкины — углеводороды, содержащие тройную связь между атомами углерода Арены. Бензол
Арены. Бензол Практическая работа №2. Наблюдение за горящей свечой
Практическая работа №2. Наблюдение за горящей свечой Флотационные реагенты. Активаторы
Флотационные реагенты. Активаторы Основания. Химические свойства оснований. Сильные и слабые основания
Основания. Химические свойства оснований. Сильные и слабые основания Получение, собирание и распознавание газов. Практическая работа
Получение, собирание и распознавание газов. Практическая работа Сапалық талдау. Сапалық аналитикалық реакциялар
Сапалық талдау. Сапалық аналитикалық реакциялар Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Химическая посуда
Химическая посуда Количество вещества. Молярная масса. Молярный объем
Количество вещества. Молярная масса. Молярный объем Производство серной кислоты
Производство серной кислоты Химические свойста воды
Химические свойста воды Масса и формулы. Химия 8 класс
Масса и формулы. Химия 8 класс Гидросульфит натрия (пищевая добавка Е222)
Гидросульфит натрия (пищевая добавка Е222) Гетерофункциональные производные бензольного ряда как лекарственные средства. Гетероциклические соединения. Алкалоиды
Гетерофункциональные производные бензольного ряда как лекарственные средства. Гетероциклические соединения. Алкалоиды Бром. Общие сведения
Бром. Общие сведения Эко-упаковка
Эко-упаковка Проект Получение пресной и чистой воды
Проект Получение пресной и чистой воды Строение атома
Строение атома Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Изомерия. (11 класс)
Изомерия. (11 класс) Оксиды. Номенклатура, классификация, физические свойства
Оксиды. Номенклатура, классификация, физические свойства Алмазы. Бриллианты
Алмазы. Бриллианты Использование горюче-смазочных материалов в автотранспорте
Использование горюче-смазочных материалов в автотранспорте Химический потенциал. Фазовые равновесия
Химический потенциал. Фазовые равновесия