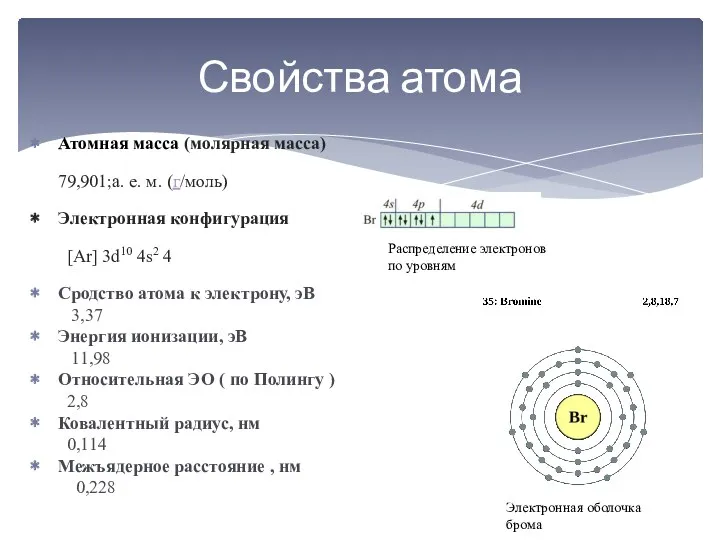
По химическим свойствам бром напоминает хлор. На внешнем электронном уровне его
атома находится 7 электронов (s2p5), поэтому он легко присоединяет электрон, образуя ион Br-. Благодаря наличию незаполненного d-уровня бром может иметь 1, 3, 5 и 7 неспаренных электронов и в кислородсодержащих соединениях проявляет степень окисления +1, +3, +5 и +7.
Подобно хлору бром взаимодействует с металлами и неметаллами:
2 Al + 3 Вr2 = 2 AlBr3 (бромид алюминия);
Н2 + Вr2 = 2 НВr (бромоводород);
2 Р + 3 Br2 = 2 РВr3 (бромид фосфора (III)).
Все реакции брома протекают менее энергично, чем хлора. Менее энергично реагирует бром и с водой. При растворении в воде реагирует только часть брома, образуя бромоводородную и бромноватистую кислоты:
Вr2 + Н2О = НВr + НBrО.













 Пестициды. Лекция
Пестициды. Лекция Хинолин. Строение хинолина
Хинолин. Строение хинолина Бор и его соединения
Бор и его соединения Адсорбция. Механизм адсорбции
Адсорбция. Механизм адсорбции Интеллектуальная игра Знатоки по химии
Интеллектуальная игра Знатоки по химии Твердые смазки
Твердые смазки Сплавы на основе железа. Диаграмма состояния сплавов системы железо–углерод. Лекция 2. Тема 4
Сплавы на основе железа. Диаграмма состояния сплавов системы железо–углерод. Лекция 2. Тема 4 Реконструкция установки получения элементарной серы
Реконструкция установки получения элементарной серы Нуклеофильное замещение галогена и других функциональных групп
Нуклеофильное замещение галогена и других функциональных групп Значення хімічних процесів у природі
Значення хімічних процесів у природі Извлечение из растворов экстракцией органическими растворителями
Извлечение из растворов экстракцией органическими растворителями Химия - Кормилица. 10 класс
Химия - Кормилица. 10 класс Гидролиз солей
Гидролиз солей Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Периодический закон и Периодическая система химических элементов Д.И. Менделеева Kарбонові кислоти. Гетерофункціональні похідні карбонових кислот
Kарбонові кислоти. Гетерофункціональні похідні карбонових кислот Основные классы неорганических соединений. Тема 2
Основные классы неорганических соединений. Тема 2 Основания. Классификация оснований
Основания. Классификация оснований Основные классы неорганических соединений
Основные классы неорганических соединений Lesson 2 and 3. The chemistry of life
Lesson 2 and 3. The chemistry of life Каучук. Немного из истории
Каучук. Немного из истории Металлы побочных подгрупп
Металлы побочных подгрупп Ионная связь
Ионная связь Фазовые равновесия в системе ограниченно смешивающихся жидкостей
Фазовые равновесия в системе ограниченно смешивающихся жидкостей Тотығу-тотықсыздану реакциялары. Тотығу және тотықсыздану
Тотығу-тотықсыздану реакциялары. Тотығу және тотықсыздану Основные отличия химии органических производных элементов IV-Б группы от химии переходных элементов
Основные отличия химии органических производных элементов IV-Б группы от химии переходных элементов Химические свойства металлов
Химические свойства металлов Химические свойства солей
Химические свойства солей Лекция 1. Введение в биоорганическую химию
Лекция 1. Введение в биоорганическую химию