Содержание
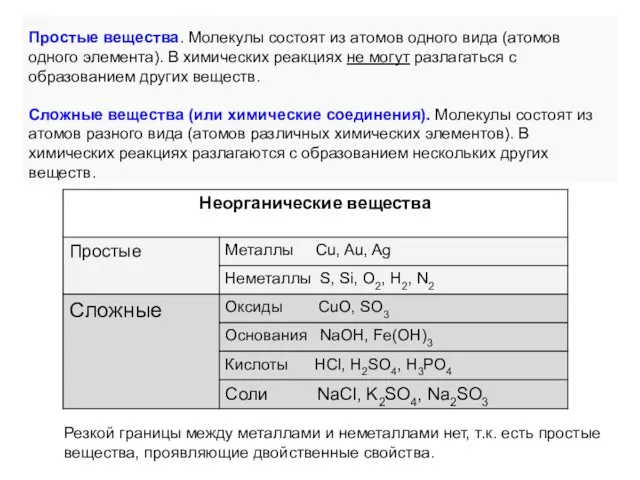
- 2. Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут
- 3. это бинарные соединения, состоящие из атомов химического элемента и кислорода ( в степени окисления -2). Общая
- 4. Номенклатура оксидов В настоящее время общепринятой является международная номенклатура оксидов. ОКСИД + Э(русское название, род. падеж)
- 5. Получение оксидов 1. Взаимодействие простых и сложных веществ с кислородом: CH4 + 2O2 = CO2 +
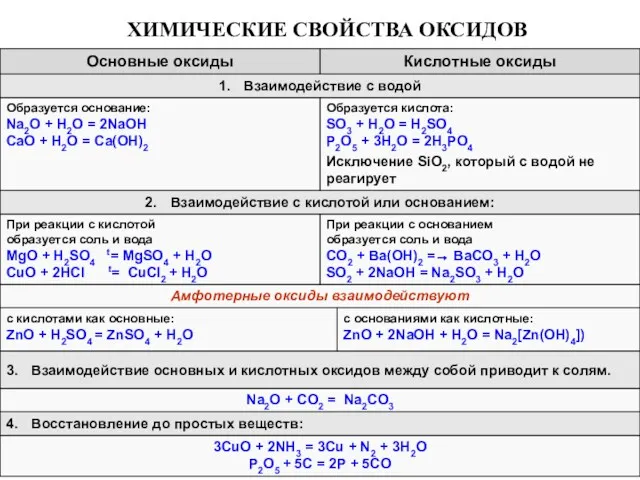
- 6. ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
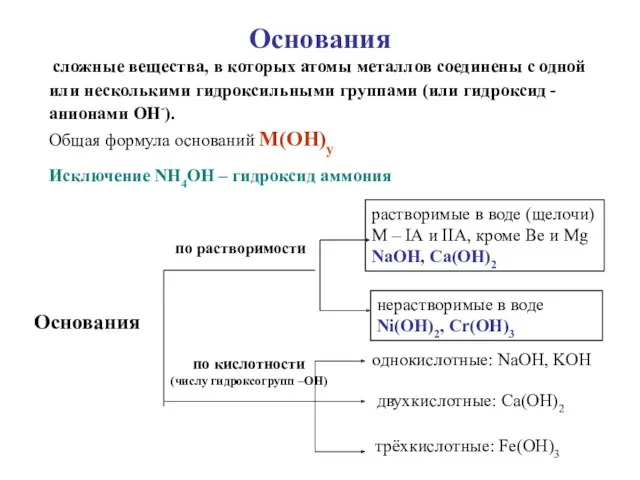
- 7. Основания сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами (или гидроксид
- 8. НОМЕНКЛАТУРА ОСНОВАНИЙ ГИДРОКСИД + Э(русское название, род. падеж) + (валентность Э) NaOH – гидроксид натрия Cr(OH)3
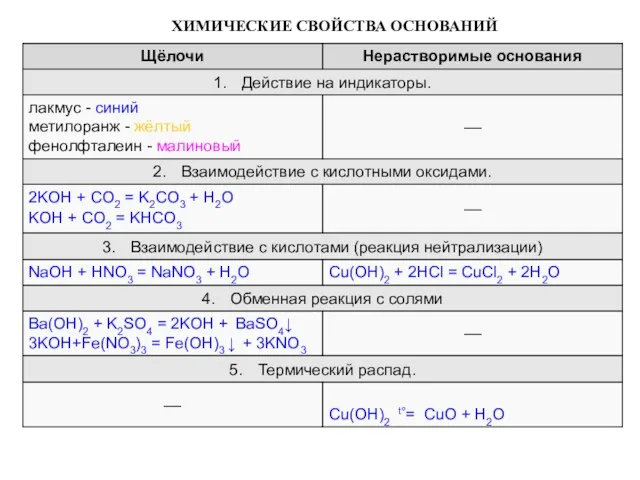
- 9. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
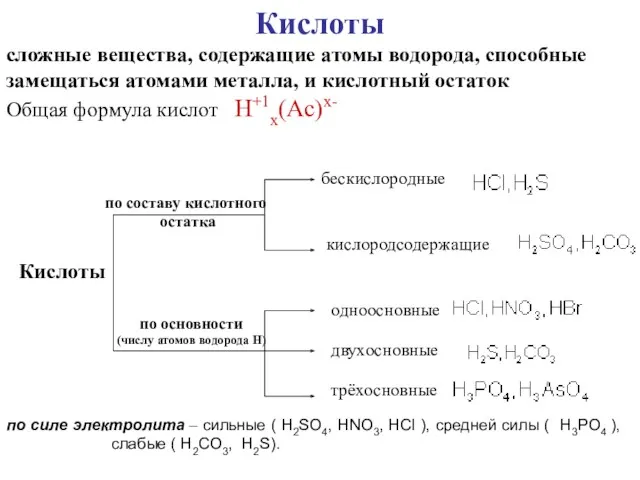
- 10. Кислоты сложные вещества, содержащие атомы водорода, способные замещаться атомами металла, и кислотный остаток Общая формула кислот
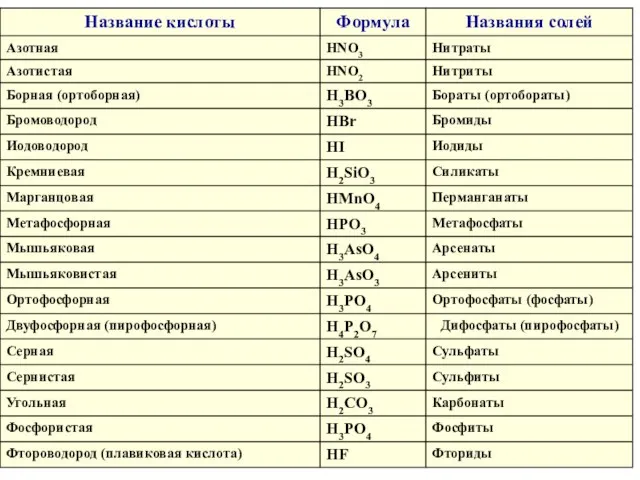
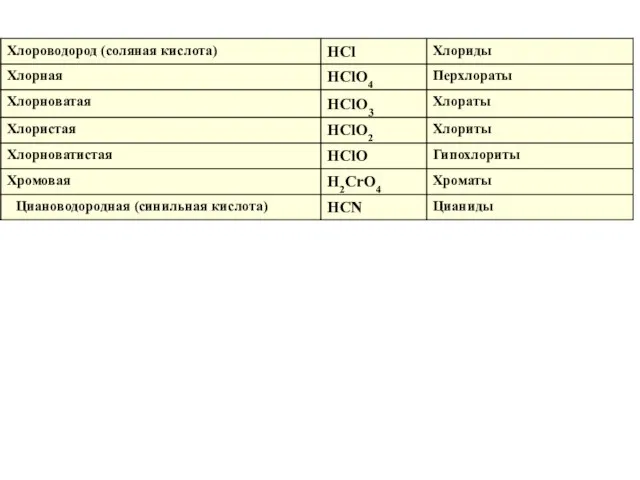
- 11. НОМЕНКАТУРА КИСЛОТ БЕСКИСЛОРОДНЫЕ КИСЛОТЫ (Н+1nЭ-n) Э + [o] + водородная кислота HCl – хлороводородная кислота HF
- 12. Получение кислот 1. Взаимодействие кислотного оксида с водой (для кислородсодержащих кислот): SO3 + H2O = H2SO4
- 13. Химические свойства кислот
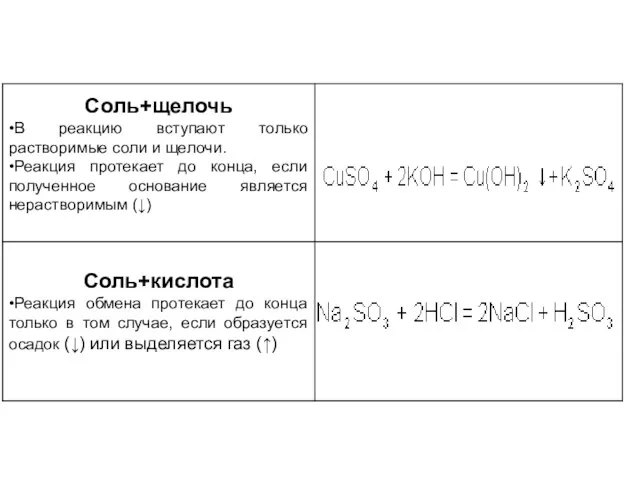
- 14. СОЛИ сложные вещества, которые являются продуктами замещения атомов водорода в молекулах кислот атомами металла Общая формула
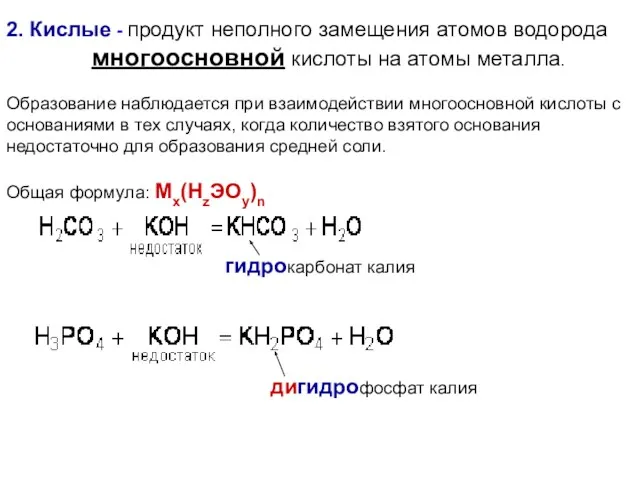
- 17. 2. Кислые - продукт неполного замещения атомов водорода многоосновной кислоты на атомы металла. Образование наблюдается при
- 18. 3. Основые – продукт частичного замещения гидроксид-ионов в молекуле основания кислотным остатком. Основные соли могут быть
- 19. 4. Двойные соли состоят из ионов двух разных металлов и кислотного остатка. KNaCO3 – калий натрий
- 20. ПОЛУЧЕНИЕ СРЕДНИХ СОЛЕЙ
- 21. Химические свойства средних солей Ряд активности металлов (электрохимический ряд напряжения металлов Li K Ba Sr Ca
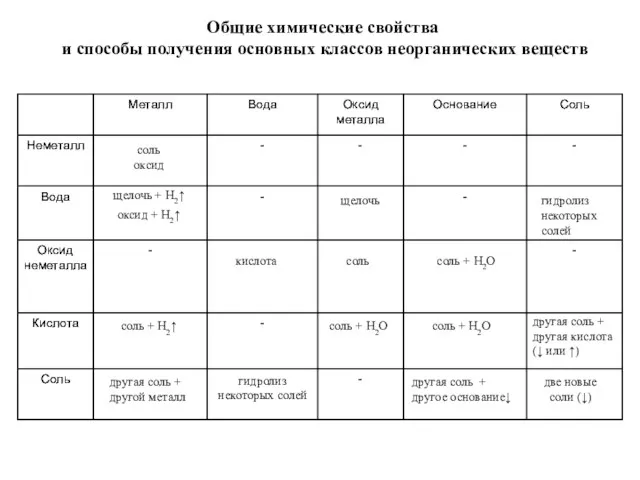
- 23. Общие химические свойства и способы получения основных классов неорганических веществ
- 25. Скачать презентацию




![НОМЕНКАТУРА КИСЛОТ БЕСКИСЛОРОДНЫЕ КИСЛОТЫ (Н+1nЭ-n) Э + [o] + водородная](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/430245/slide-10.jpg)







 Гидролиз. Необратимый гидролиз
Гидролиз. Необратимый гидролиз Растворимость. Равновесие системы осадок-раствор
Растворимость. Равновесие системы осадок-раствор Побочная подгруппа. 8 группы
Побочная подгруппа. 8 группы Галогены. Строение атома
Галогены. Строение атома Химическое кафе Кислоты
Химическое кафе Кислоты Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Классификация кристаллов по типу химической связи
Классификация кристаллов по типу химической связи Обмен липидов
Обмен липидов Определите положение в ПСХЭ элементов
Определите положение в ПСХЭ элементов La notion de catabolisme et d’anabolisme. La bioenergetique. La chaine mitochondriale de transfert d’electrons
La notion de catabolisme et d’anabolisme. La bioenergetique. La chaine mitochondriale de transfert d’electrons Подготовка к ВПР по химии. 8 класс
Подготовка к ВПР по химии. 8 класс Свойства кислорода. Получение кислорода методом вытеснения воздуха
Свойства кислорода. Получение кислорода методом вытеснения воздуха Типы химических реакций
Типы химических реакций Понятия про синтетические лекарственные средства
Понятия про синтетические лекарственные средства Побочная подгруппа VIII группы периодической системы
Побочная подгруппа VIII группы периодической системы Введение. Предмет и содержание фармацевтической химии, её связи с другими науками
Введение. Предмет и содержание фармацевтической химии, её связи с другими науками Физические и химические свойства воды
Физические и химические свойства воды Physiology lab
Physiology lab Фосфорлы тыңайытқыштар
Фосфорлы тыңайытқыштар становление органической химии
становление органической химии Обмен нуклеопротеинов
Обмен нуклеопротеинов Химические свойства алканов
Химические свойства алканов ВОДОРОД
ВОДОРОД Хінони
Хінони Физические свойства минералов
Физические свойства минералов Основные понятия и законы химии
Основные понятия и законы химии Кислоты, основания, соли в свете ТЭД
Кислоты, основания, соли в свете ТЭД Роль хімії у суспільстві
Роль хімії у суспільстві