Содержание
- 2. План 1. Открытие Периодического закона 2. Периодическая таблица химических элементов Д.И.Менделеева 3. Зависимость свойств химических элементов
- 3. Открытию периодического закона предшествовало накопление знаний о веществах и свойствах. По мере открытия новых химических элементов,
- 4. В основу своей работы по классификации химических элементов Д.И. Менделеев положил два их основных и постоянных
- 5. При переходе от лития к фтору происходит закономерное ослабление металлических свойств и усиление неметаллических. При переходе
- 6. Если написать ряды один под другим так, чтобы под литием находился натрий, а под неоном –
- 7. На основании своих наблюдений 1 марта 1869 г. Д.И. Менделеев сформулировал периодический закон, который в начальной
- 8. Уязвимым моментом периодического закона сразу после его открытия было объяснение причины периодического повторения свойств элементов с
- 9. Только с открытием строения атомного ядра и установлением физического смысла порядкового номера элемента стало понятно, что
- 10. Открытый Д. И. Менделеевым закон и построенная на основе закона периодическая система элементов - это важнейшее
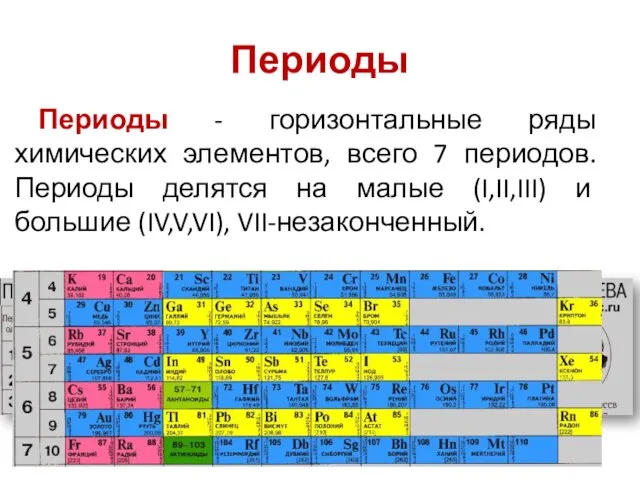
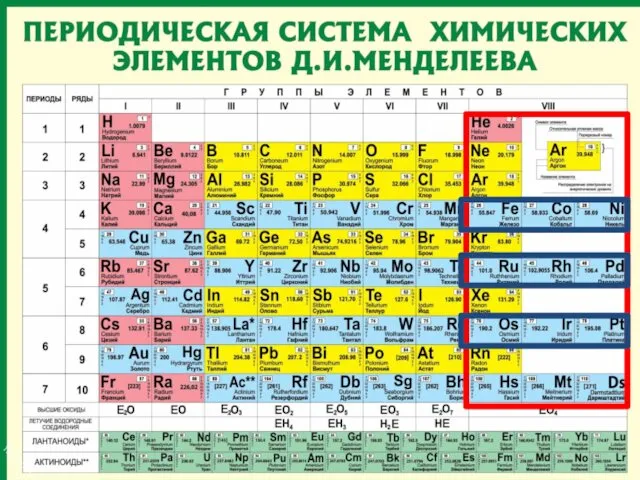
- 13. Периоды Периоды - горизонтальные ряды химических элементов, всего 7 периодов. Периоды делятся на малые (I,II,III) и
- 14. Каждый период (за исключением первого) начинается типичным металлом (Li, Nа, К, Rb, Cs, Fr) и заканчивается
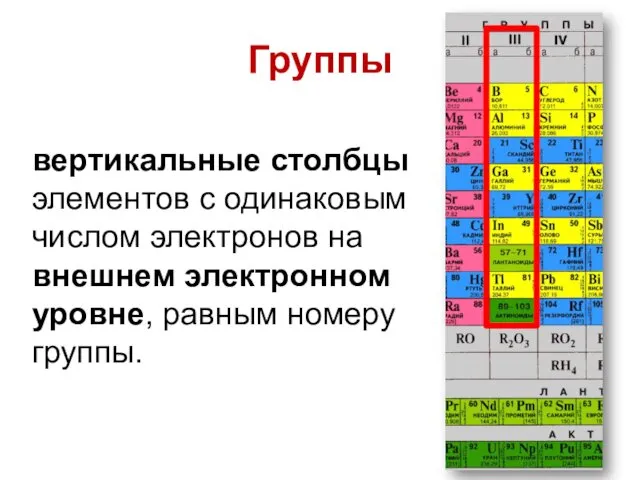
- 15. Группы вертикальные столбцы элементов с одинаковым числом электронов на внешнем электронном уровне, равным номеру группы.
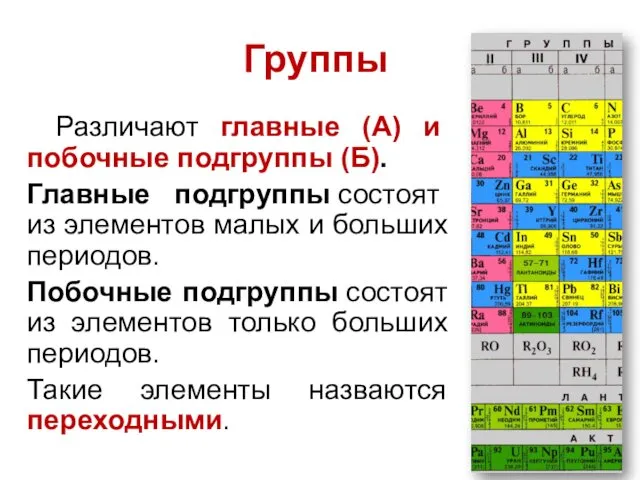
- 16. Различают главные (А) и побочные подгруппы (Б). Главные подгруппы состоят из элементов малых и больших периодов.
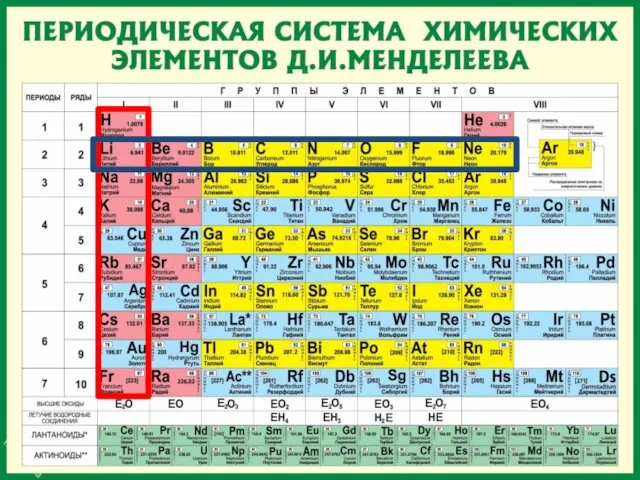
- 18. Периодическая таблица химических элементов Запомнить!!! Номер периода = число энергетических уровней атома. Номер группы = число
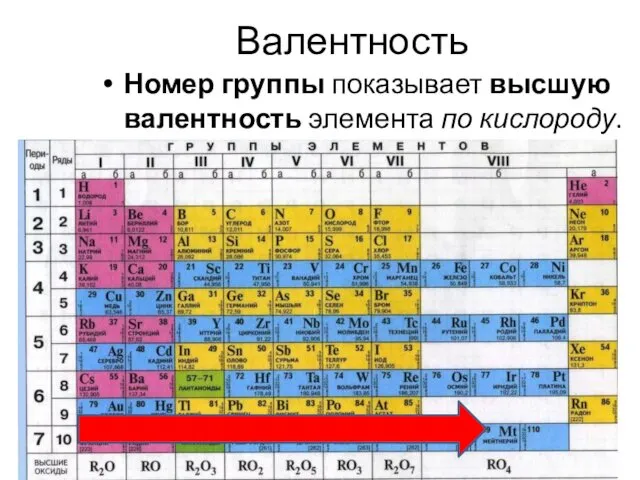
- 19. Валентность Номер группы показывает высшую валентность элемента по кислороду.
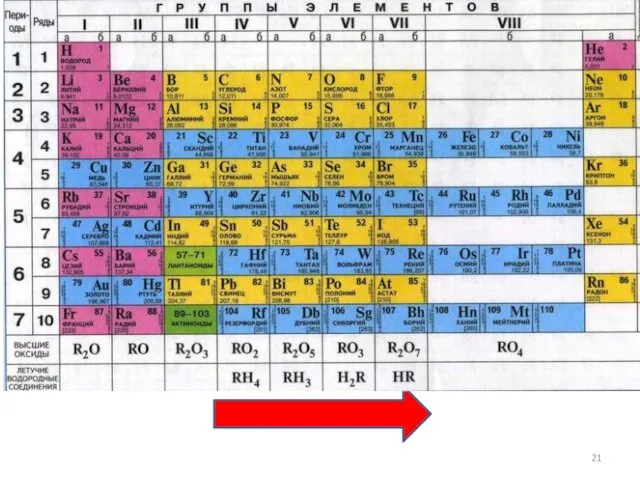
- 20. Валентность Элементы IV, V, VI и VII групп образуют летучие водородные соединения. Номер группы показывает валентность
- 22. Задание: Назовите в каком периоде и в какой группе, подгруппе находятся следующие химические элементы: Натрий, Медь,
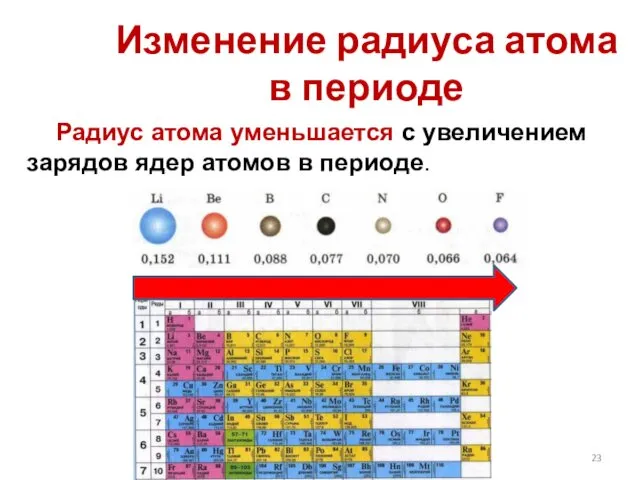
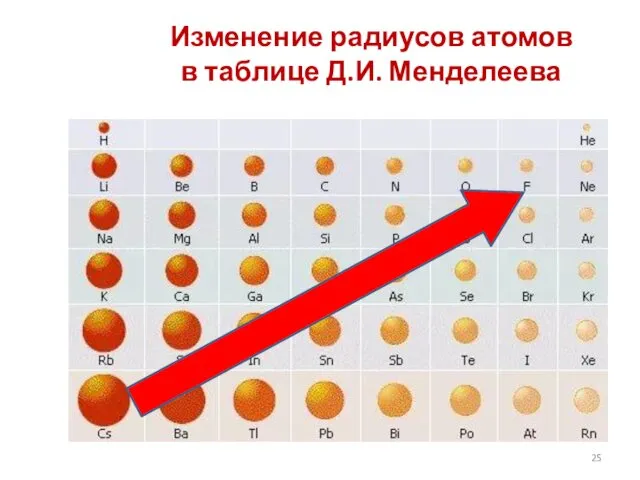
- 23. Радиус атома уменьшается с увеличением зарядов ядер атомов в периоде. Изменение радиуса атома в периоде
- 24. В одной группе с увеличением номера периода атомные радиусы возрастают. Изменение радиуса атома в периоде
- 25. Изменение радиусов атомов в таблице Д.И. Менделеева
- 26. Задание: Сравните радиусы следующих химических элементов: Литий, натрий, калий Кислород, Сера, селен Йод, Хлор, фтор
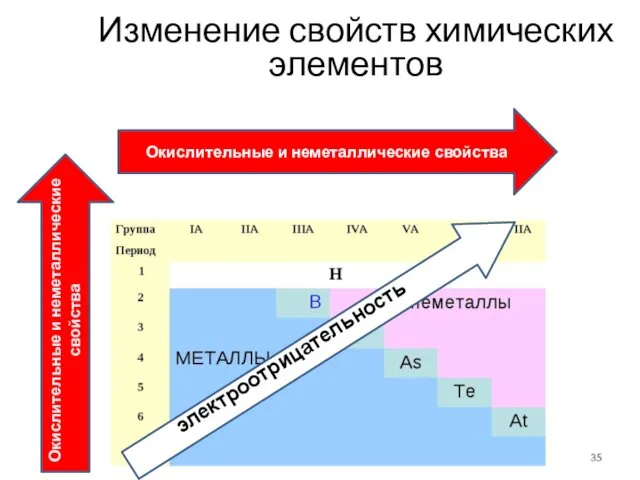
- 28. Электроотрицательность - это способность атома притягивать электронную плотность. Электроотрицательность в периоде увеличивается с возрастанием заряда ядра
- 29. Электроотрицательность в группе увеличивается с уменьшением числа электронных слоев атома (снизу вверх). Самым электроотрицательным элементом является
- 30. Li 0,98 Na 0,93 К 0,91 Rb 0,89 Be 1,5 Mg 1,2 Ca 1,04 Sr 0,99
- 31. Задание: Сравните ЭО следующих химических элементов: Натрий и кислород Углерод и водород Кислород и фтор
- 33. Восстановительные свойства атомов - способность терять электроны при образовании химической связи. Окислительные свойства атомов -способность принимать
- 34. В главных подгруппах снизу вверх, в периодах – слева направо окислительные свойства простых веществ элементов возрастают,
- 35. Изменение свойств химических элементов электроотрицательность Окислительные и неметаллические свойства Окислительные и неметаллические свойства
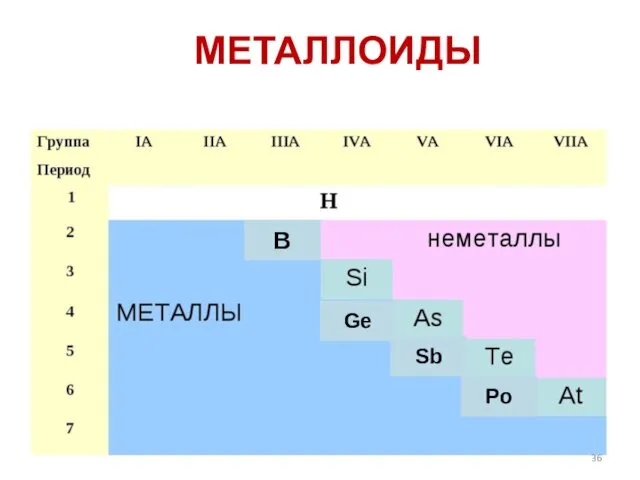
- 36. МЕТАЛЛОИДЫ Ge Sb Po B
- 37. МЕТАЛЛОИДЫ По своим химическим свойствам полуметаллы являются неметаллами, но по типу проводимости относятся к проводникам.
- 38. Значение Периодического закона и Периодической системы Д. И. Менделеева Периодический закон : - Основа современной химии;
- 40. Скачать презентацию


























 Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Типы химических реакций. Тепловой эффект (11 класс)
Типы химических реакций. Тепловой эффект (11 класс) Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Crystal defects
Crystal defects Классификация минералов по химическому принципу. Кварц, магнетит
Классификация минералов по химическому принципу. Кварц, магнетит Інгібіювання та регуляція ензимів
Інгібіювання та регуляція ензимів Аммиак. Состав вещества
Аммиак. Состав вещества Le trasformazioni fisiche della materia. Tema 3
Le trasformazioni fisiche della materia. Tema 3 Введение в химию
Введение в химию Обмен нуклеотидов
Обмен нуклеотидов Основні технологічні процеси очистки води. Знезараження води. Знезараження води хлором
Основні технологічні процеси очистки води. Знезараження води. Знезараження води хлором Возраст в геологии
Возраст в геологии Соединения щелочных металлов
Соединения щелочных металлов Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання
Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання Аммиак. Образование молекулы аммиака
Аммиак. Образование молекулы аммиака Химическая связь. (Лекция 4, 5)
Химическая связь. (Лекция 4, 5) Гетерофункциональные производные бензольного ряда как лекарственные средства
Гетерофункциональные производные бензольного ряда как лекарственные средства Кислородные соединения азота
Кислородные соединения азота Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Метаболизм кетоновых тел. Метаболизм холестерина
Метаболизм кетоновых тел. Метаболизм холестерина Предельные углеводороды
Предельные углеводороды Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) Массообменные процессы
Массообменные процессы Снежинки. Рождение снежинки
Снежинки. Рождение снежинки Аномальные свойства воды
Аномальные свойства воды Алмастырылмайтын аминқышқылды алу биотехнологиясы
Алмастырылмайтын аминқышқылды алу биотехнологиясы Промежуточные фазы в металлических сплавах
Промежуточные фазы в металлических сплавах Моющие и чистящие средства
Моющие и чистящие средства