Содержание
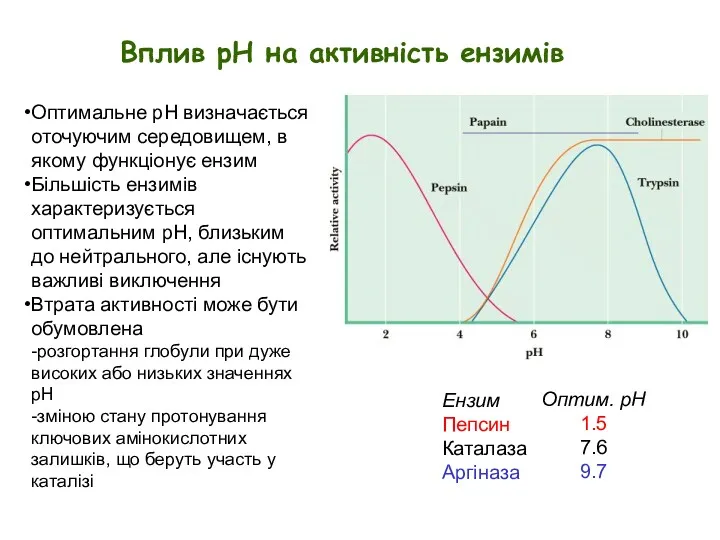
- 2. Вплив рН на активність ензимів Ензим Пепсин Каталаза Аргіназа Оптим. pH 1.5 7.6 9.7 Оптимальне pH
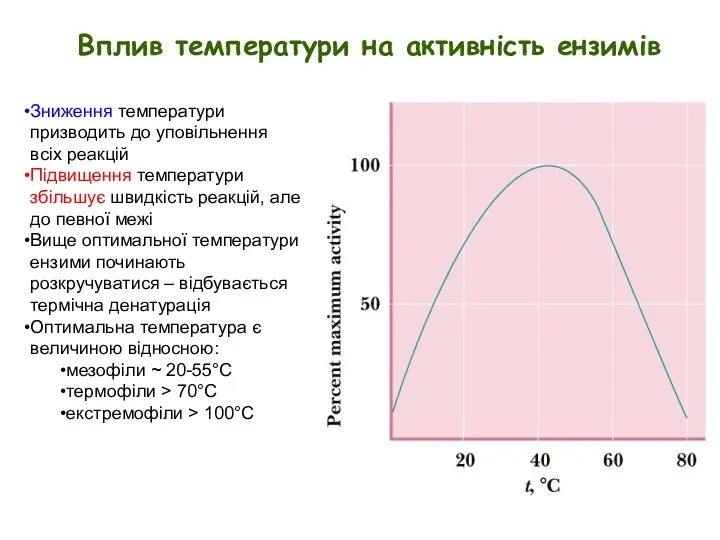
- 3. Вплив температури на активність ензимів Зниження температури призводить до уповільнення всіх реакцій Підвищення температури збільшує швидкість
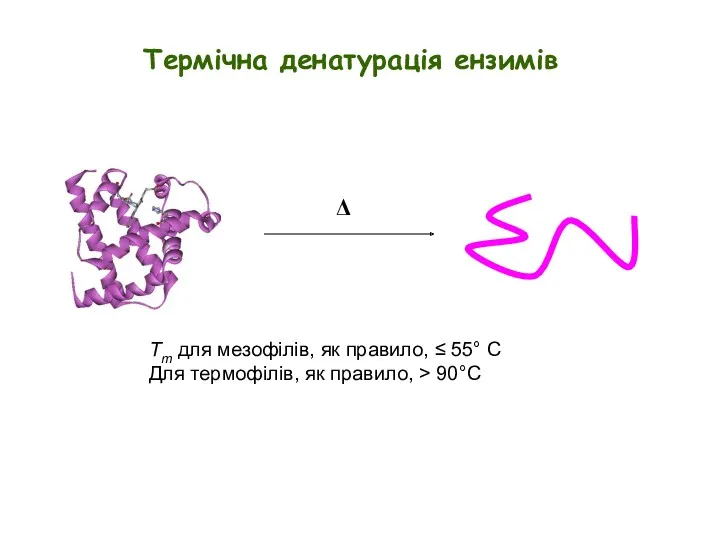
- 4. Δ Tm для мезофілів, як правило, ≤ 55° C Для термофілів, як правило, > 90°C Термічна
- 5. Інгібіювання ензимів Оборотні інгібітори: взаємодіють з ензимами шляхом утворення нековалентних зв’язків інгібіювання можна подолати розведенням або
- 6. Типи оборотних інгібіторів Конкурентні інгібітори – зв’язуються з E, але не з ES Неконкурентні інгібітори -
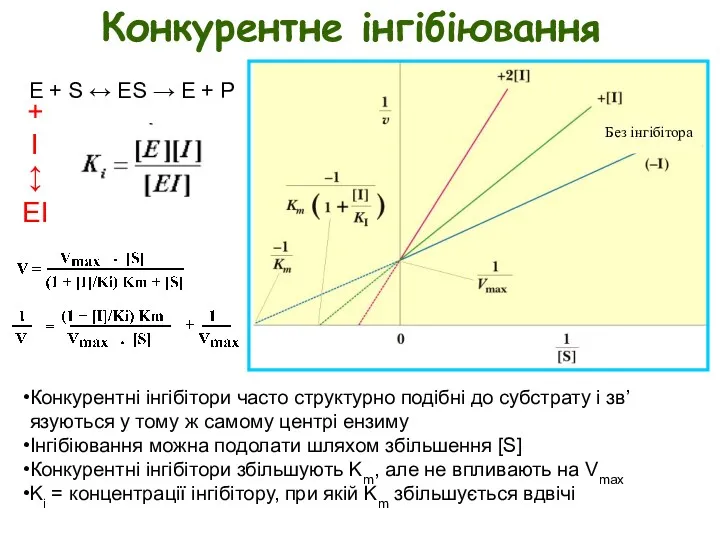
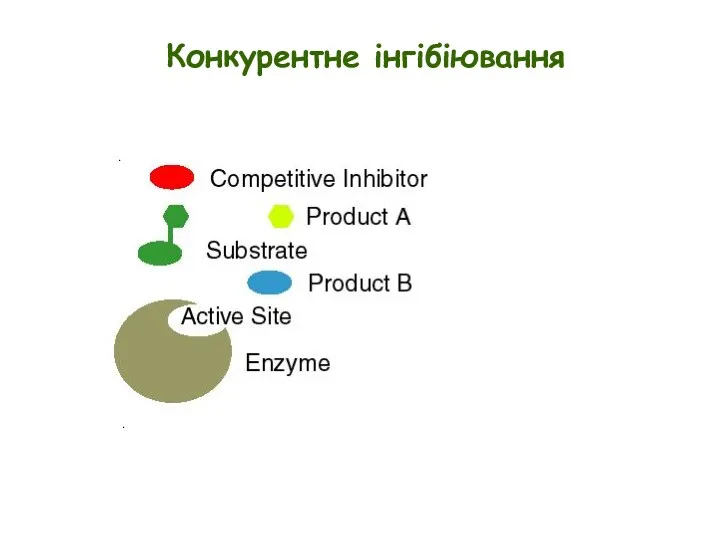
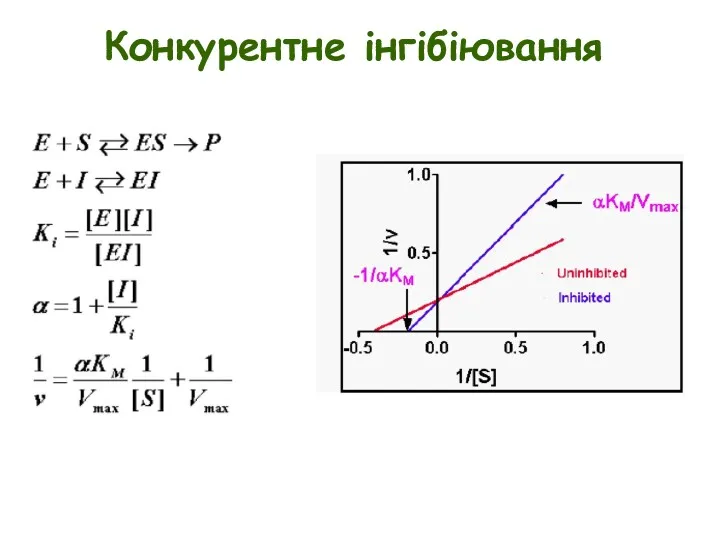
- 7. Конкурентне інгібіювання E + S ↔ ES → E + P Конкурентні інгібітори часто структурно подібні
- 8. Конкурентне інгібіювання
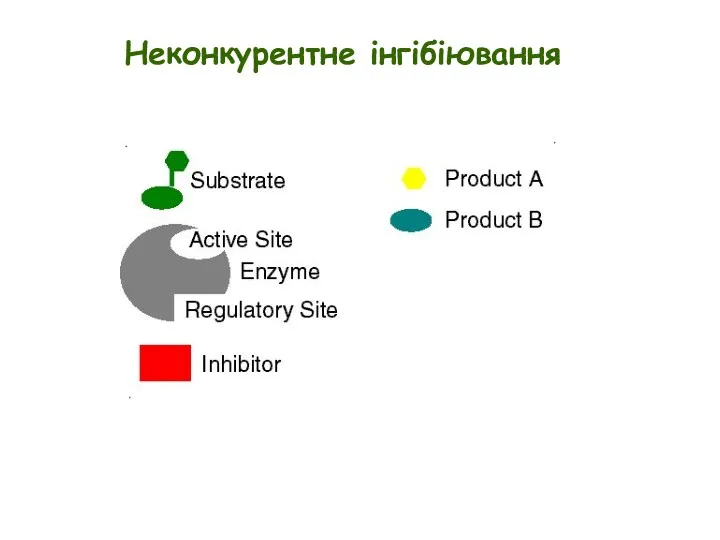
- 9. Просте неконкурентне інгібіювання E + S ↔ ES → E + P Неконкурентні інгібітори зв’язуються у
- 10. Неконкурентне інгібіювання
- 11. Змішане неконкурентне інгібіювання E + S ↔ ES → E + P Ki ≠ K’i Центри
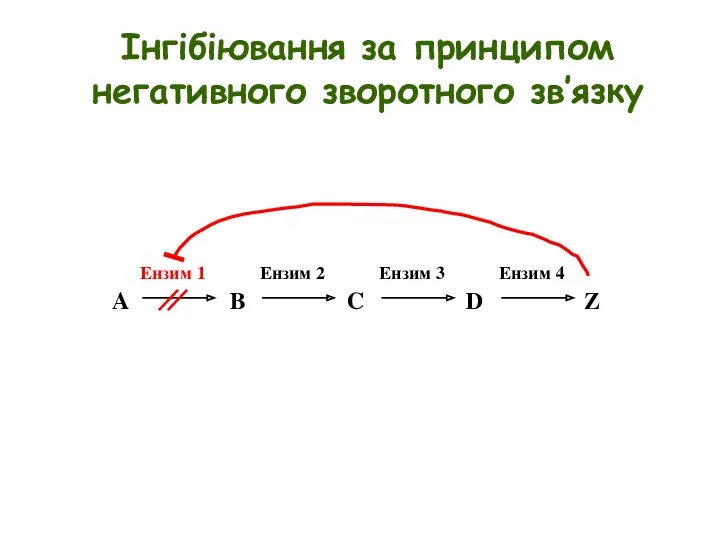
- 12. Інгібіювання за принципом негативного зворотного зв’язку
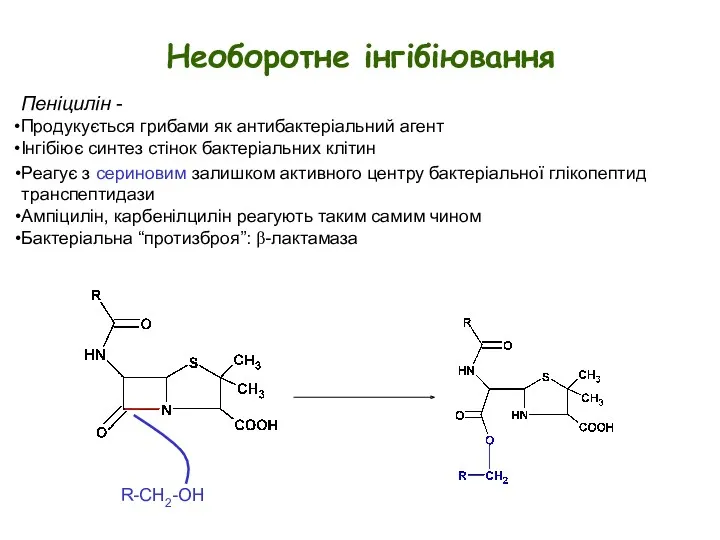
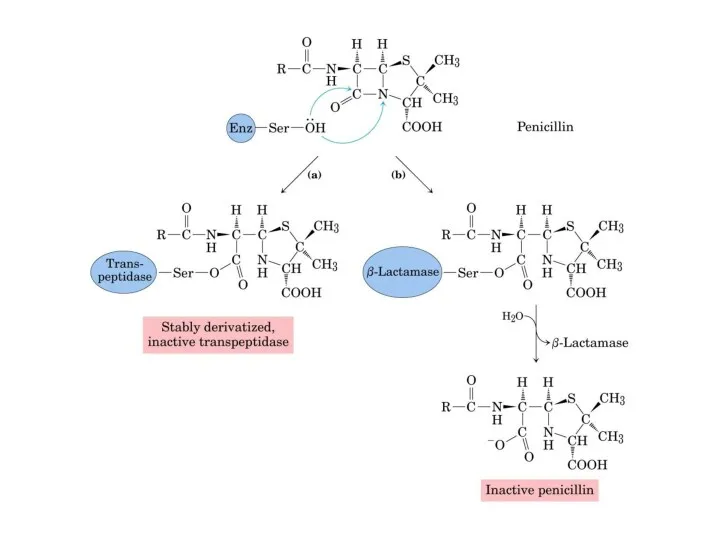
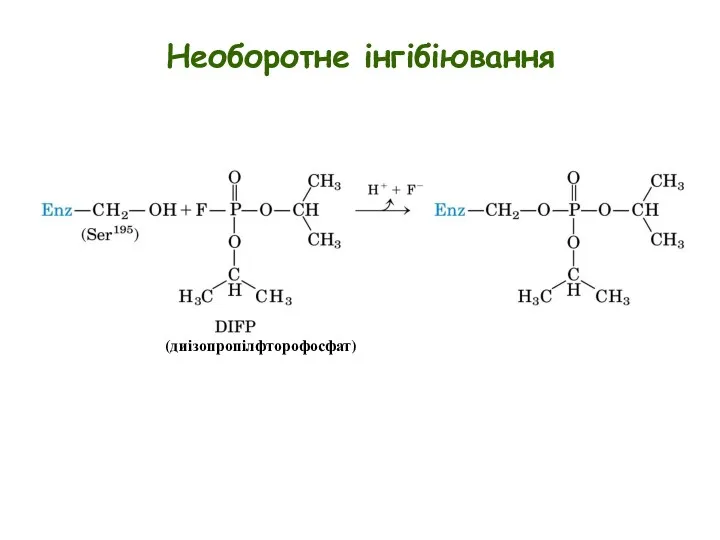
- 13. Необоротне інгібіювання Пеніцилін - Продукується грибами як антибактеріальний агент Інгібіює синтез стінок бактеріальних клітин R-CH2-OH Реагує
- 15. Необоротне інгібіювання
- 16. Контроль ензиматичної активності Швидкість реакції зменшується при акумулюванні продуктів Швидкість реакції залежить від наявності субстрату Генетичний
- 17. Контроль ензиматичної активності за допомогою ізозимів Ізозими: різні модифікації того ж самого ензиму Продукуються різними генами
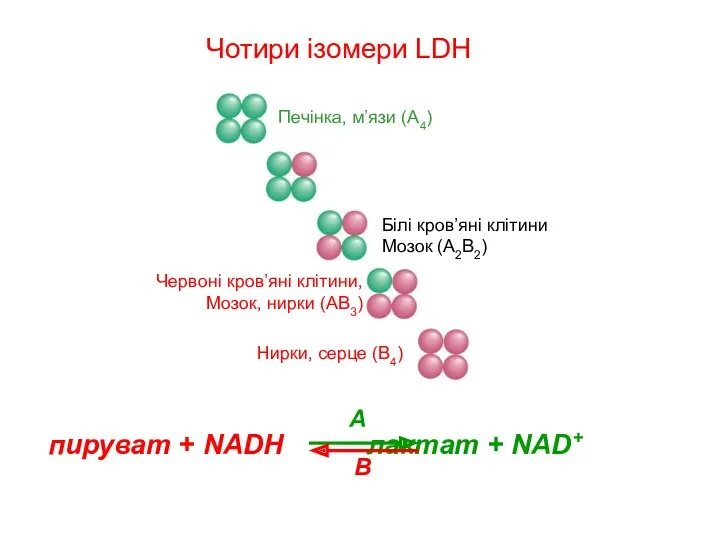
- 18. Другий приклад ізозимів: лактат дегідрогеназа (LDH) пируват + NADH лактат + NAD+ LDH: два ізотипи A
- 19. пируват + NADH лактат + NAD+ A B
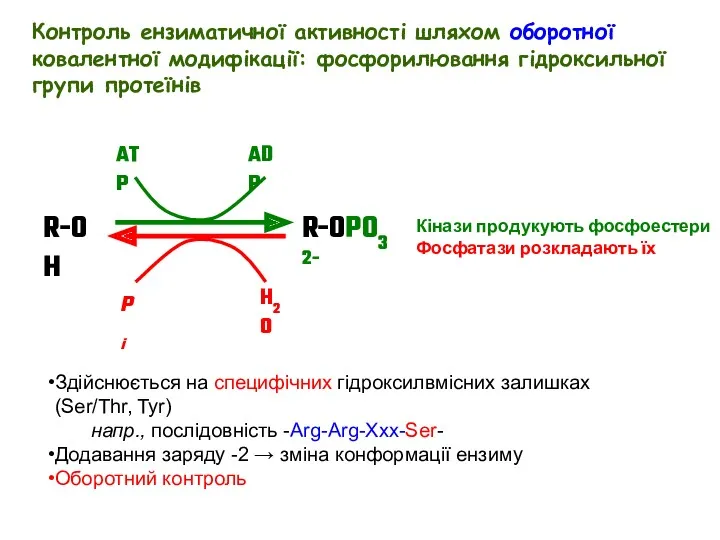
- 20. Здійснюється на специфічних гідроксилвмісних залишках (Ser/Thr, Tyr) напр., послідовність -Arg-Arg-Xxx-Ser- Додавання заряду -2 → зміна конформації
- 21. Спосіб утримання протеїну у неактивному стані: - До тих пір, поки він не потрапить до “місця
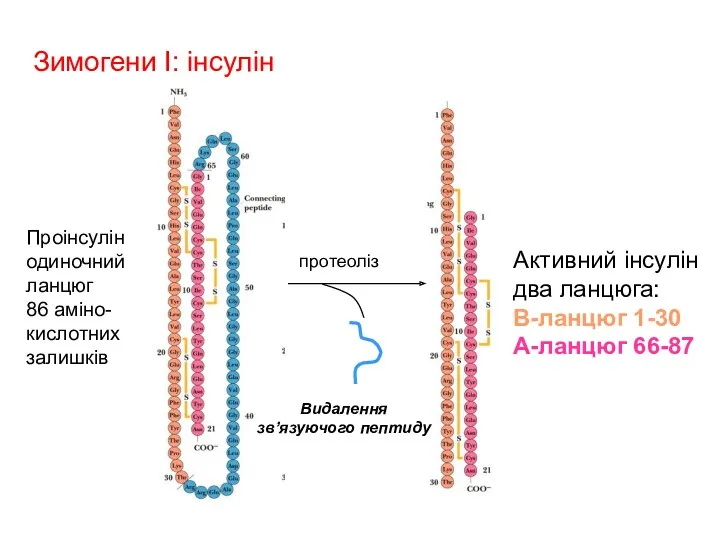
- 22. протеоліз Зимогени I: інсулін Проінсулін одиночний ланцюг 86 aміно- кислотних залишків Активний інсулін два ланцюга: B-ланцюг
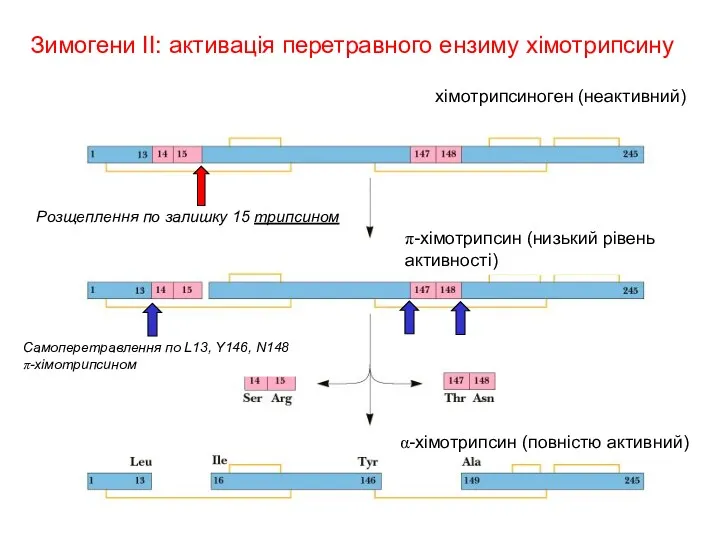
- 23. Зимогени II: активація перетравного ензиму хімотрипсину хімотрипсиноген (неактивний) α-хімотрипсин (повністю активний) Самоперетравлення по L13, Y146, N148
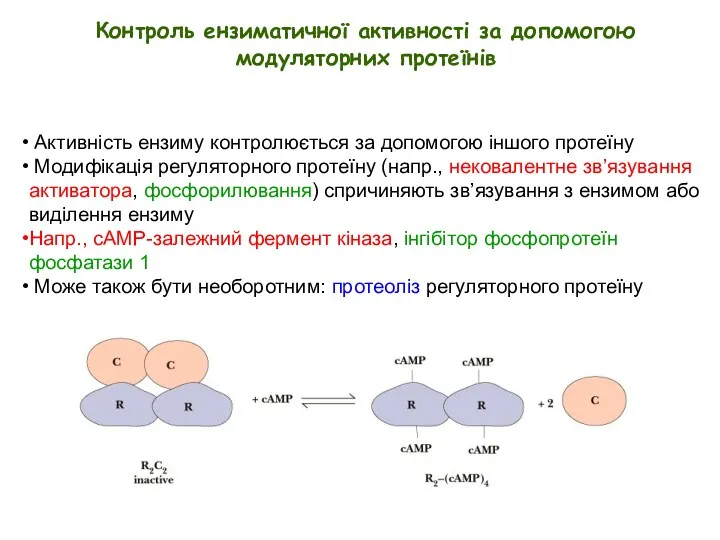
- 24. Активність ензиму контролюється за допомогою іншого протеїну Модифікація регуляторного протеїну (напр., нековалентне зв’язування активатора, фосфорилювання) спричиняють
- 25. Алостерична регуляція Активність ензимів може регулюватися за допомогою алостеричних ефекторів (як правило, невеликих молекул або йонів
- 26. Алостерична регуляція
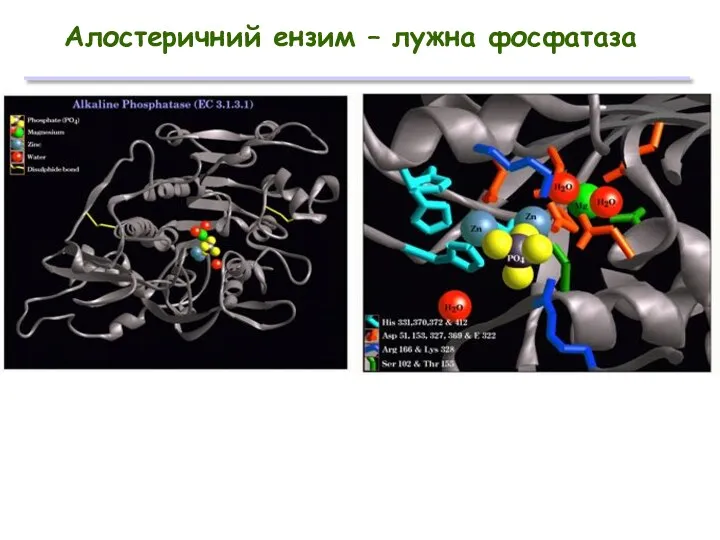
- 27. Алостеричний ензим – лужна фосфатаза
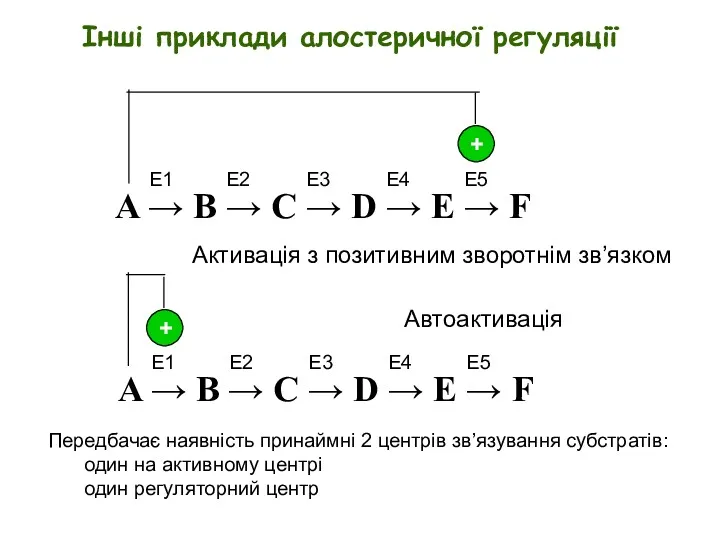
- 28. Передбачає наявність принаймні 2 центрів зв’язування субстратів: один на активному центрі один регуляторний центр Інші приклади
- 30. Модель алостеричної регуляції Моно-Ваймана-Шанго (MWC) Алостеричні протеїни можуть існувати в двох станах: R (relaxed, релаксований) та
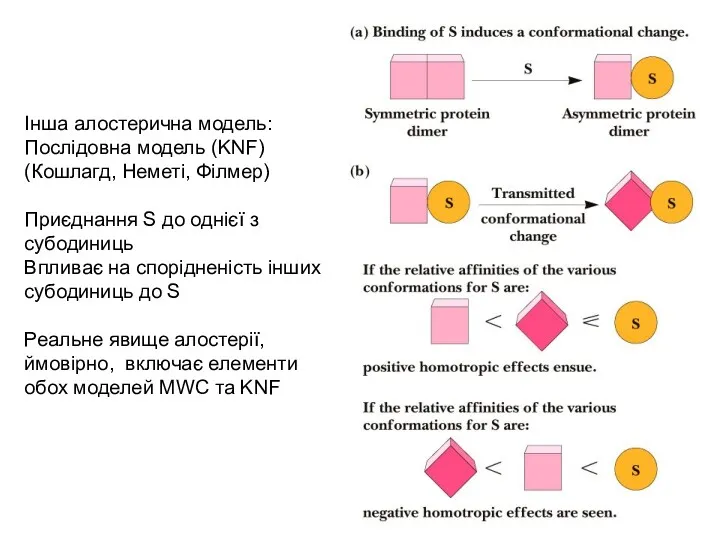
- 31. Інша алостерична модель: Послідовна модель (KNF) (Кошлагд, Неметі, Філмер) Приєднання S до однієї з субодиниць Впливає
- 32. Конкурентне інгібіювання
- 34. Скачать презентацию












 Технология получения многослойного и малослойного графена
Технология получения многослойного и малослойного графена Жири як представники естерів. Класифікація жирів, їхні хімічні властивості
Жири як представники естерів. Класифікація жирів, їхні хімічні властивості 20230816_belki_2
20230816_belki_2 Халькогены
Халькогены Растворы. (Лекция 7)
Растворы. (Лекция 7) Химические элементы азот и фосфор
Химические элементы азот и фосфор Альдегиды и кетоны
Альдегиды и кетоны Буферное кислотно - основное взаимодействие
Буферное кислотно - основное взаимодействие Наглядное пособие Динамические модели. Кристаллы. Немолекулярные вещества. Простые вещества
Наглядное пособие Динамические модели. Кристаллы. Немолекулярные вещества. Простые вещества Химическая связь
Химическая связь Биологически активные вещества и их содержание в лекарственных растениях
Биологически активные вещества и их содержание в лекарственных растениях Основания. Степени окисления элементов в соединениях
Основания. Степени окисления элементов в соединениях Общая характеристика элементов V группы главной подгруппы
Общая характеристика элементов V группы главной подгруппы Диффузия вокруг нас
Диффузия вокруг нас Франций (Francium)
Франций (Francium) Термодинамика химических процессов
Термодинамика химических процессов Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Качественные реакции
Качественные реакции Минералы горных пород
Минералы горных пород Химический элемент радон
Химический элемент радон Осадочные и метаморфические горные породы
Осадочные и метаморфические горные породы Мило та миловаріння
Мило та миловаріння Кислотність та основність органічних сполук
Кислотність та основність органічних сполук Проведение лабораторных анализов образцов почвы
Проведение лабораторных анализов образцов почвы Подгруппа углерода
Подгруппа углерода Химический элемент алюминий
Химический элемент алюминий Пластические массы и изделия на их основе
Пластические массы и изделия на их основе Зависимость биохимических изменений в мясе от условий хранения
Зависимость биохимических изменений в мясе от условий хранения