Содержание
- 2. Na+ Реакция окрашивания пламени Вносим проволочку с кристаллами соли в пламя Ярко-желтый цвет пламени
- 3. K+ Реакция окрашивания пламени Бледно-фиолетовый цвет пламени
- 4. Реакция окрашивания пламени Са2+ Sr2+ Ba2+
- 5. Реакция с реактивом Несслера K2[HgJ4] К капле раствора соли аммония прибавить 3–4 капли Н2О (дист.) и
- 6. Ag+ + KI = K+ +AgI↓ Реакция с йодидом калия КI К двум каплям раствора соли
- 7. Реакция с сульфидом калия (натрия) К двум каплям раствора соли серебра прибавить 2 капли реактива. Черный
- 8. Реакция с бромидом калия (натрия) К двум каплям раствора соли серебра прибавить 2 капли реактива. Светло
- 9. Реакция с гидроксидом натрия NaOH К двум каплям раствора соли серебра прибавить 2 капли реактива. Испытать
- 10. Реакция с хроматом калия K2CrO4 К двум каплям раствора соли серебра прибавить 2 капли реактива. Ag+
- 11. Реакция с йодидом калия КI К 2 каплям соли свинца прибавить 2 капли реактива. К осадку
- 12. Реакция с гидроксидом натрия NaOH К 2–3 каплям раствора соли свинца прибавить 1-2 капли реактива. К
- 13. Реакция с хроматом калия K2CrO4 К 2–3 каплям раствора соли свинца прибавить 1-2 капли реактива. Pb2+
- 14. Hg22+ Реакция с йодидом калия КI К 2 каплям раствора соли ртути (I) прибавить 2 капли
- 15. Реакция с гидроксидом натрия NaOH К 1–2 каплям раствора соли ртути (I) прибавить 2 капли реактива
- 16. Реакция с хроматом калия K2CrO4 К 2 каплям раствора соли ртути (I) прибавить 2 капли реактива
- 17. Ba2+ К 2–3 каплям раствора соли бария прибавить 4 – 5 капель реактива и 2–3 капли
- 18. Са2+ К 2–3 каплям раствора соли кальция прибавить 1–2 капли реактива. Проводить реакцию в нейтральной или
- 19. Al3+ + 3NaOH = 3Na+ + Al(OH)3↓ Белый студенистый осадок, при добавлении избытка реактива - растворение
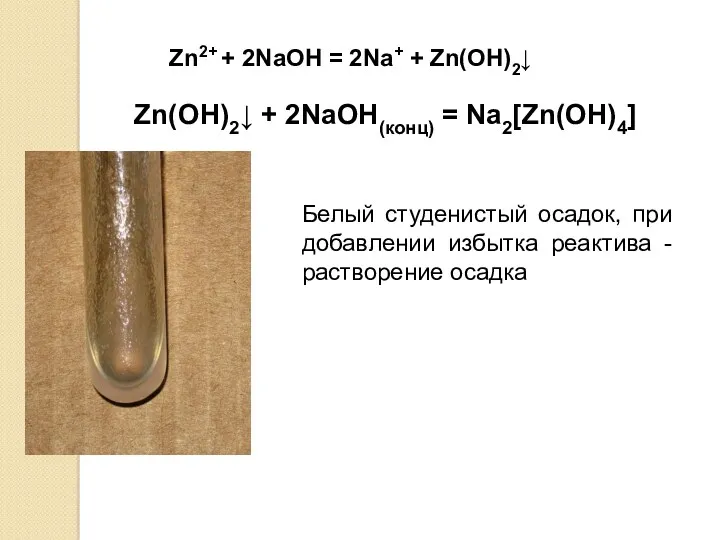
- 20. Zn2+ + 2NaOH = 2Na+ + Zn(OH)2↓ Белый студенистый осадок, при добавлении избытка реактива - растворение
- 21. Cr3+ + 3NaOH = 3Na+ + Cr(OH)3↓ Серо-зеленый студенистый осадок, при добавлении избытка реактива - растворение
- 22. Fe2+ Fe2+ + 2NaOH = 2Na+ + Fe (OH)2↓ Серо-зелёный осадок, постепенно изменяет цвет на грязно-коричневый.
- 23. Реакция с красной кровяной солью K3[Fe(CN)6] 3Fe2+ + 2K3[Fe(CN)6] = 6K+ + Fe3[Fe(CN)6]2↓ Синий осадок «турнбулева
- 24. Fe3+ Fe3+ + 3NaOH = 3Na+ + Fe (OH)3↓ Красно – бурый студенистый осадок, осадок не
- 25. Реакция с желтой кровяной солью K4[Fe(CN)6] 4Fe3+ + 3K4 [Fe(CN)6] = 12K+ + Fe4[Fe(CN)6]3↓ Тёмно-синий осадок
- 26. Реакция с родонитом калия KSCN Fe3+ + 3KSCN = 3K+ + Fe(SCN)3 Раствор кроваво-красного цвета. При
- 27. Bi 3+ + 3NaOH = 3Na+ + Bi (OH)3↓ Белый осадок, не растворился в избытке NaOH
- 28. Bi3+ Реакция с йодидом калия KI Bi3+ + 3KI = 3K+ + BiI3↓ BiI3 + KI
- 29. Cu2+ 2Cu2+ + SO42- + 2NH4OH = 2NH4+ + (CuОН)2SO4↓ Голубовато- зеленоватый осадок растворился в избытке
- 30. Cu 2+ + 2NaOH = 2Na+ + Cu(OH)2↓ Голубой осадок, при добавлении избытка реактива, осадок не
- 31. Реакция с тиосульфатом натрия Na2S2O3 К 2–3 каплям раствора соли меди (II) прибавить 4–5 капель воды,
- 32. К 2–3 каплям раствора соли меди (II) прибавить 1–2 капли реактива Реакция с желтой кровяной солью
- 33. Ni2+ 2Ni2+ + SO42- + 2NH4OH = 2NH4+ + (NiОН)2SO4↓ Светло-зеленый осадок, осадок растворился в избытке
- 34. Ni 2+ + 2NaOH = 2Na+ + Ni(OH)2↓ Светло -зеленый осадок, осадок не растворился
- 35. 2Co2+ + SO42- + 2NH4OH = 2NH4+ + (CoОН)2SO4↓ Синий осадок, при нагревании розовый Осадок растворился,
- 36. 2Cd2+ + SO42- + 2NH4OH = 2NH4+ + (CdОН)2SO4↓ Белый осадок Осадок растворился, цвет раствора бесцветный
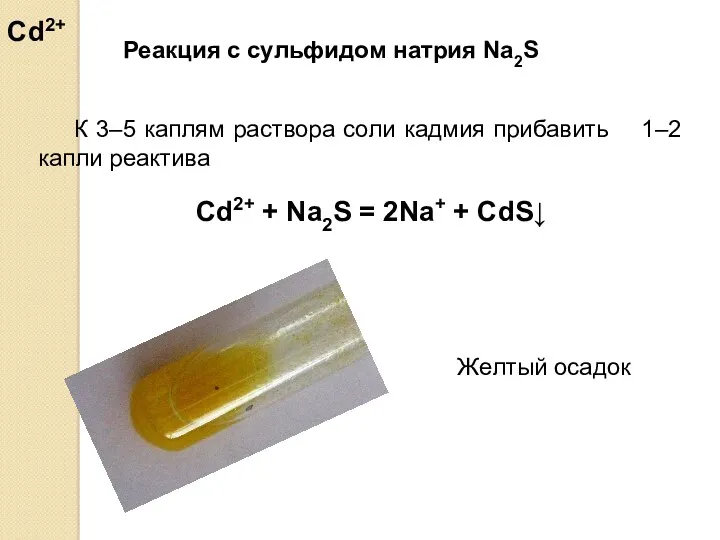
- 37. Реакция с сульфидом натрия Na2S К 3–5 каплям раствора соли кадмия прибавить 1–2 капли реактива Желтый
- 38. На фильтровальную бумагу нанести каплю соли бария и каплю реактива, добавить каплю раствора HCl Ba2+ +
- 39. Реакция с диметил-глиоксимом (реактив Чугаева) К 3 – 5 каплям раствора соли никеля прибавить 3–5 капель
- 41. Скачать презентацию



![Реакция с реактивом Несслера K2[HgJ4] К капле раствора соли аммония](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/410551/slide-4.jpg)
















![Реакция с красной кровяной солью K3[Fe(CN)6] 3Fe2+ + 2K3[Fe(CN)6] =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/410551/slide-22.jpg)

![Реакция с желтой кровяной солью K4[Fe(CN)6] 4Fe3+ + 3K4 [Fe(CN)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/410551/slide-24.jpg)













 Титриметрический метод анализа
Титриметрический метод анализа Спирти. Загальні відомості про спирти
Спирти. Загальні відомості про спирти Периодическая система Д. И. Менделеева
Периодическая система Д. И. Менделеева Мектепте химия пәнінен олипиядалық есептерді шешуде иондар қасиеттерінің маңызы
Мектепте химия пәнінен олипиядалық есептерді шешуде иондар қасиеттерінің маңызы Общая схема радиолиза алифатических углеводородов. Радиолиз органических кислот. Радиолиз кетонов эфиров
Общая схема радиолиза алифатических углеводородов. Радиолиз органических кислот. Радиолиз кетонов эфиров Как и где используется соляная кислота
Как и где используется соляная кислота Теория строения органических соединений. Лекция 17
Теория строения органических соединений. Лекция 17 Силикаты (класс). Подкласс филлосиликаты (слоистые/листовые силикаты). Семейство слюды
Силикаты (класс). Подкласс филлосиликаты (слоистые/листовые силикаты). Семейство слюды Nuclear Energy, Controlled Fission and Fusion 2016
Nuclear Energy, Controlled Fission and Fusion 2016 Галогены. История открытия галогенов
Галогены. История открытия галогенов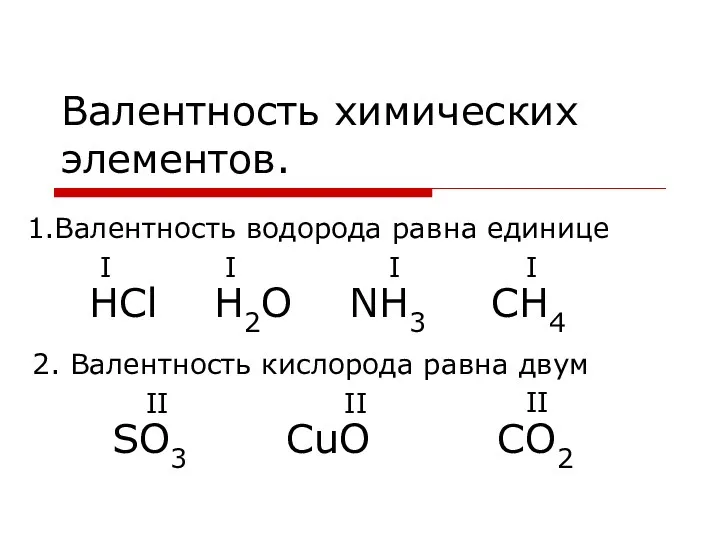 Валентность химических элементов
Валентность химических элементов Золото
Золото Перманганат калия
Перманганат калия Азот. Характеристика азота, фосфора (9класс)
Азот. Характеристика азота, фосфора (9класс) Катализ и катализаторы
Катализ и катализаторы Сполуки основних класів у будівництві і побуті
Сполуки основних класів у будівництві і побуті Метанол. Фізичні властивості
Метанол. Фізичні властивості Тепловой эффект химических реакций
Тепловой эффект химических реакций Получение и применение альдегидов
Получение и применение альдегидов Процесс электролиза
Процесс электролиза Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии
Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии Фуллерен С60 и его аналоги
Фуллерен С60 и его аналоги Формы залегания метаморфических пород
Формы залегания метаморфических пород Цікаві факти про хімію
Цікаві факти про хімію Задачи на избыток-недостаток
Задачи на избыток-недостаток Розчин та його компоненти
Розчин та його компоненти Кристалічний і аморфний стани твердих речовин
Кристалічний і аморфний стани твердих речовин Межлабораторные сравнительные испытания качественных параметров нефтепродуктов
Межлабораторные сравнительные испытания качественных параметров нефтепродуктов