Содержание
- 2. Калия перманганат (распространённое название в быту — марганцовка) — калиевая соль марганцевой кислоты (KMnO4). ФИЗИЧЕСКИЕ СВОЙСТВА
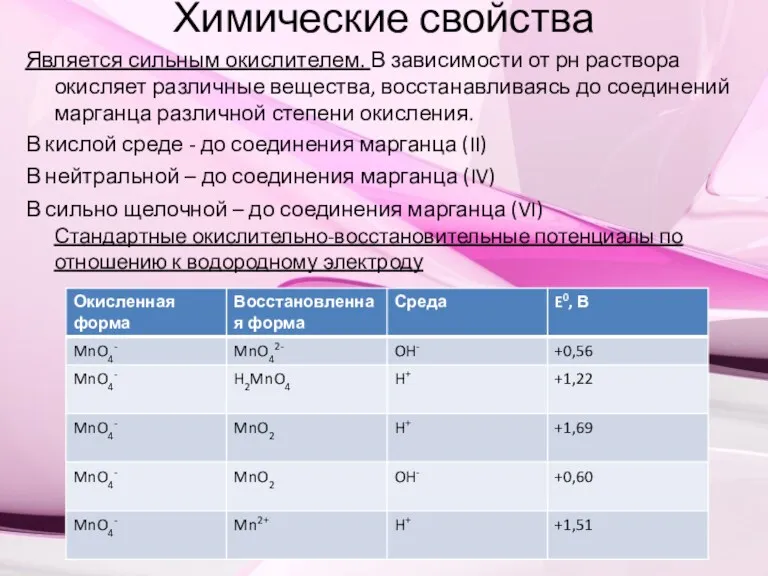
- 3. Химические свойства Является сильным окислителем. В зависимости от рн раствора окисляет различные вещества, восстанавливаясь до соединений
- 4. Примеры реакций приведены ниже (на примере взаимодействия с сульфитом калия: в кислой среде: 2KMnO4 + 5K2SO3
- 5. При нагревании разлагается с выделением кислорода (этим способом пользуются в лаборатории для получения чистого кислорода). Схему
- 6. Известные способы получения KMnO4 Исторически первый способ получения перманганата калия – синтез манганата (VI) калия из
- 7. Вследствие образования МnО2 процесс невыгоден и необходимо регенерировать KОН из образующегося поташа по реакции K2CO3 +
- 8. На второй стадии плав выщелачивают и полученный раствор подвергают электролизу. При этом на аноде окисляется ион
- 9. Применение Применение этой соли основано на высокой окисляющей способности перманганат-иона. - Щелочной раствор перманганата калия хорошо
- 10. Фармакологическое действие Антисептическое средство. При соприкосновении с органическими веществами выделяет атомарный кислород. Образующийся при восстановлении препарата
- 11. Показания Смазывание язвенных и ожоговых поверхностей — инфицированные раны, язвы и ожоги кожи. Полоскание полости рта
- 12. Калия перманганат (порошок для приготовления раствора) входит в Таблицу III прекурсоров, оборот которых в Российской Федерации
- 13. Срок хранения марганцовки Законодательством РФ установлено, что все химические соединения, применяемые в медицинских целях, имеют определенный
- 14. Правила хранения Марганцовая пыль оказывает на человеческий организм токсическое воздействие. Потому важно соблюдать определенные привала хранения
- 15. ПЕРМАНГАНАТОМЕТРИЯ Рабочим раствором метода является перманганат калия KMnO4. Его окислительная способность зависит от условий реакции. Наибольшей
- 16. Прямым титрование перманганатом калия можно определить лишь Fе2+, выступающего в качестве восстановителя: 5Fе2+ + KМnO4 +
- 18. Скачать презентацию














 Горение топлива
Горение топлива Арены. Бензол
Арены. Бензол Будова атома. Ядро й електронні оболонки. Склад атомних ядер
Будова атома. Ядро й електронні оболонки. Склад атомних ядер Спирты. Обобщающий урок
Спирты. Обобщающий урок Хлороводород..Соляная кислота
Хлороводород..Соляная кислота Применение серной кислоты
Применение серной кислоты Свойства металлов
Свойства металлов Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Алкадиены. Циклоалканы. Лекция № 5
Алкадиены. Циклоалканы. Лекция № 5 Газовые законы для идеальных и реальных газов. Лекция 1
Газовые законы для идеальных и реальных газов. Лекция 1 Каталитический риформинг бензинов
Каталитический риформинг бензинов Арени. Бензен: молекулярна і структурна формули, фізичні властивості
Арени. Бензен: молекулярна і структурна формули, фізичні властивості Получение и применение радиоактивных изотопов
Получение и применение радиоактивных изотопов Строение атома. Лекция 2
Строение атома. Лекция 2 Номенклатура углеводородов: алканов алкенов алкинов. Создание учебного пособия
Номенклатура углеводородов: алканов алкенов алкинов. Создание учебного пособия Кевлар. Структура кевлара
Кевлар. Структура кевлара Геолого-промышленные типы месторождений полезных ископаемых
Геолого-промышленные типы месторождений полезных ископаемых Медь
Медь Химическая связь
Химическая связь Белки. Изучение органических веществ в 9-10 классе
Белки. Изучение органических веществ в 9-10 классе Этил спирті және оның адам ағзасына әсері
Этил спирті және оның адам ағзасына әсері Коррозия каменных и бетонных строительных конструкций
Коррозия каменных и бетонных строительных конструкций Рідкі кристали
Рідкі кристали Алкины - непредельные углеводороды с общей формулой CnH2n+2
Алкины - непредельные углеводороды с общей формулой CnH2n+2 Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества
Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества Химиялық элементтер
Химиялық элементтер Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Химическая формула. Знаки химических элементов
Химическая формула. Знаки химических элементов