Содержание
- 2. Положение металлов в периодической системе Д.И.Менделеева
- 3. Тип кристаллической решетки
- 4. Физические свойства теплопроводность электропроводность металлический блеск пластичность ковкость
- 5. Вид химической связи
- 6. Химические свойства металлов Электрохимический ряд активности металлов Слева направо химическая активность атомов ослабевает
- 7. Примеры взаимодействия металлов: С простыми веществами (неметаллами) – кислородом O2 0 0 +2 -2 2Mg +O2
- 8. – с серой S 0 0 t +2 -2 Fe + S = FeS 0 +2
- 9. Со сложными веществами – Водой Me + H2O=MeOH + H2↑ t0 НЕ РЕАГИРУЮТ! Me + H2O
- 10. Натрий в воде 0 +1 +1 0 2Na + 2H2O(+ фенолфталеин)=2NaOH + H2 0 +1 0
- 11. Магний в воде 0 +1 -1 +2 -2 0 Mg + H2O = MgO + H2
- 12. С кислотами Me +кислота = соль + H2↑ НЕ РЕАГИРУЮТ! Кроме концентрированного раствора HNO3 H2SO4
- 13. Mg+H2SO4 = MgSO4 +H2↑ 2+ + 2- 2+ 2- + ПИФ Mg +2H+ SO4→Mg+ SO4+2H 2Al+3H2SO4=Al2(SO4)3
- 14. Zn+2HCl = ZnCl2 + H2↑ раствор 0 +2 0 2 1 Zn – 2ê → Zn,
- 15. 0 +1 +5 -2 +2 +4 -2 +1 -2 Cu +2HNO3(конц.) = Cu(NO3)2 + NO2 +
- 16. С солями «Предыдущий активнее, чем последующий»
- 17. 0 +2 -2 +2 -2 0 Fe +CuSO4 = FeSO4+Cu 0 +2 2 1 Fe -
- 18. Щелочные металлы Li Na K Rb Cs С электронным строением атомов щелочных металлов связана способность этих
- 19. Щелочноземельные металлы Летучие соединения щёлочноземельных металлов придают пламени характерный цвет: соединения кальция — кирпично-красный, стронция —
- 20. Алюминий как представитель III группы главной подгруппы периодической системы
- 21. +13 Al ) ) ) 1S22S22P63S23P1 +3
- 22. Al2O3 Al(OH)3 HAlO2 характерным свойством амфотерного соединения является взаимодействие не только с кислотой…. Al(OH)3 + 3HCl→
- 23. ….но и с основанием (щелочью): Al(OH)3 + NaOH → NaAlO2 + 2H2O Получение растворимого NaAlO2 (алюмината
- 24. Происхождение и физические свойства В природе алюминий встречается только в соединениях (минералах): Бокситы – Al2O3 •
- 25. Получение алюминия
- 26. Алюмотермия
- 27. Применение алюминия и его сплавов. Алюминиевые провода: Фольга: Различные лекарства,применяемые при болезнях желудка:
- 28. Металлы в природе и их получение Химически активные металлы. Натрий. s +11 Na ) ) )
- 29. Получение натрия с помощью электролиза.
- 30. Металлы средней активности. Железо. +26Fe ) ) ) ) 2 8 14 2 s
- 31. Дамасская сталь
- 32. Извлечение железа из руд. 2C + O2 → 2CO↑ 3CO + Fe2O3 → 2Fe + 3CO2↑
- 33. Как горит железо?
- 34. Благородные металлы. Серебро. +47Ag ) ) ) ) ) 2 8 18 18 1
- 36. Скачать презентацию

































 Месторождения берилла и топаза
Месторождения берилла и топаза Химический эквивалент. Формульные единицы
Химический эквивалент. Формульные единицы Metode electrochimice. Generalităţi
Metode electrochimice. Generalităţi Соединения железа
Соединения железа Соединения кальция. Жесткость воды и способы её устранения
Соединения кальция. Жесткость воды и способы её устранения Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Методика преподавания химии
Методика преподавания химии Высшие жирные кислоты. Липиды
Высшие жирные кислоты. Липиды Электронные конфигурации атомов
Электронные конфигурации атомов Метод молекулярных орбиталей
Метод молекулярных орбиталей Натуральные, искуственные и синтетические материалы
Натуральные, искуственные и синтетические материалы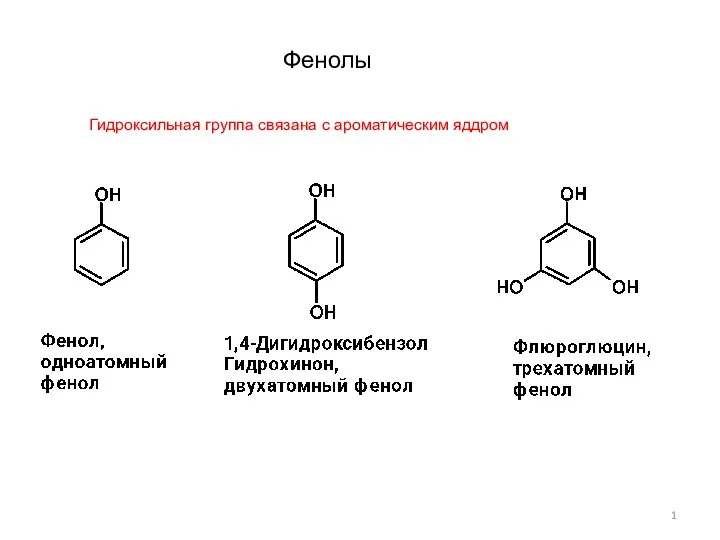 Фенолы-1
Фенолы-1 Группа веществ, изолируемых из биологического материала дистилляцией
Группа веществ, изолируемых из биологического материала дистилляцией Введение. Предмет и содержание фармацевтической химии, её связи с другими науками
Введение. Предмет и содержание фармацевтической химии, её связи с другими науками Естери. Класифікація та номенклатура естерів
Естери. Класифікація та номенклатура естерів Электронное строение элементов главной подгруппы III группы
Электронное строение элементов главной подгруппы III группы Сложные эфиры
Сложные эфиры Основні класи неорганічних сполук
Основні класи неорганічних сполук Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу
Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу Производство полимеров
Производство полимеров Элементтер-органогендер. өмір металдары. Көміртек – органикалық қосылыстардың негізін құраушы
Элементтер-органогендер. өмір металдары. Көміртек – органикалық қосылыстардың негізін құраушы Гетероциклические соединения
Гетероциклические соединения Свойства воды. Оценка качества
Свойства воды. Оценка качества Відносна молекулярна маса речовини, її обчислення за хімічною формулою
Відносна молекулярна маса речовини, її обчислення за хімічною формулою ОВР – окислительно-восстановительные реакции. Тема 4
ОВР – окислительно-восстановительные реакции. Тема 4 Solutions and solubilities
Solutions and solubilities Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Генетическая связь между основными классами неорганических веществ
Генетическая связь между основными классами неорганических веществ