Содержание
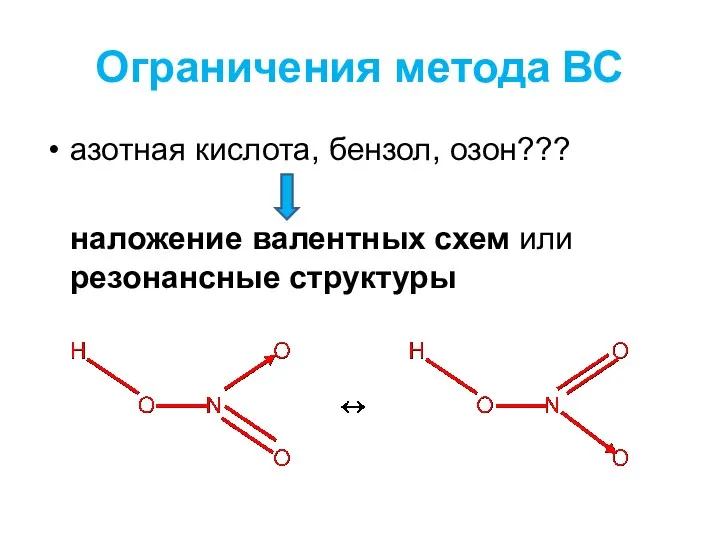
- 2. Ограничения метода ВС азотная кислота, бензол, озон??? наложение валентных схем или резонансные структуры
- 3. Метод МО (Малликен, Хунд): молекула – совокупность ядер и электронов, каждый электрон движется в поле остальных
- 4. ЛКАО ψ(МО)связ = С1ψ(АО1) + С2ψ(АО2) ψ(МО)разр = С3ψ(АО1) – С4ψ(АО2) Энергии АО близки ⇒ С1
- 5. Принципы метода МО 1. Как и в атоме, в молекуле е занимают соответствующие орбитали. При этом
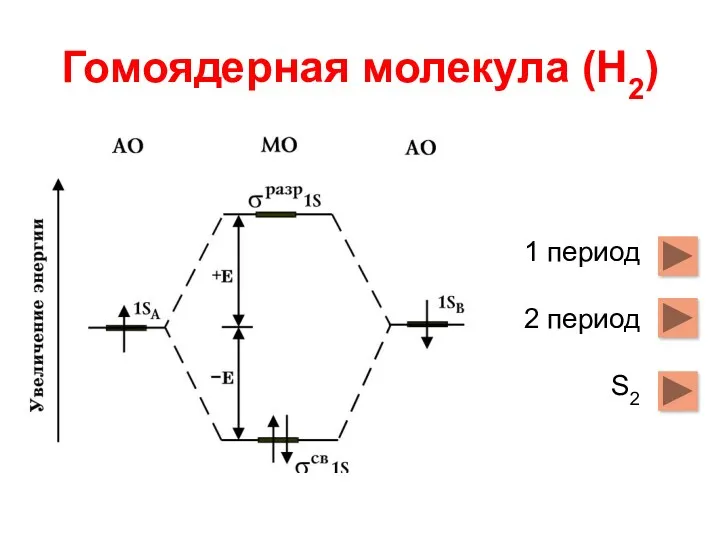
- 6. Гомоядерная молекула (Н2) 1 период 2 период S2
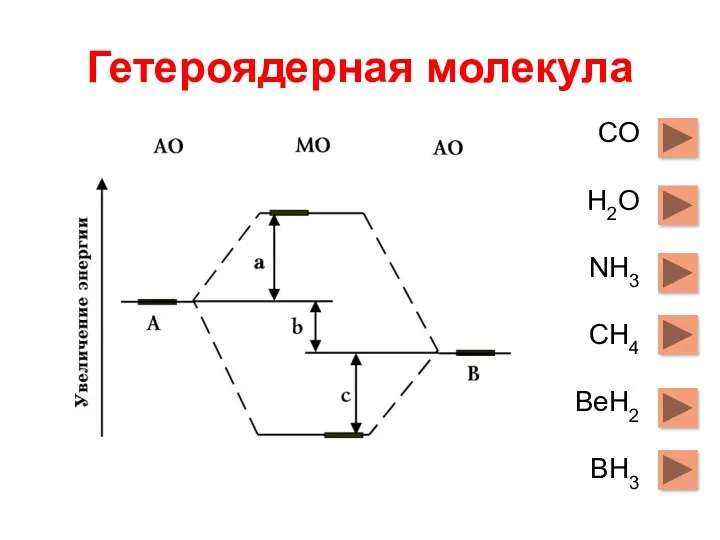
- 7. Гетероядерная молекула СО Н2О NH3 CH4 BeH2 BH3
- 8. Молекулы не с одним центральным атомом С2Н6 С2Н4 С2Н2 С6Н6 С4Н6
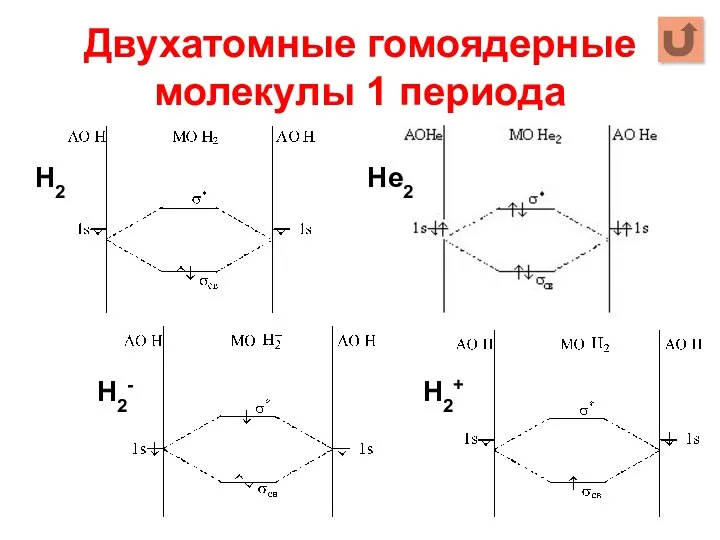
- 10. Двухатомные гомоядерные молекулы 1 периода Н2 Не2 Н2- Н2+
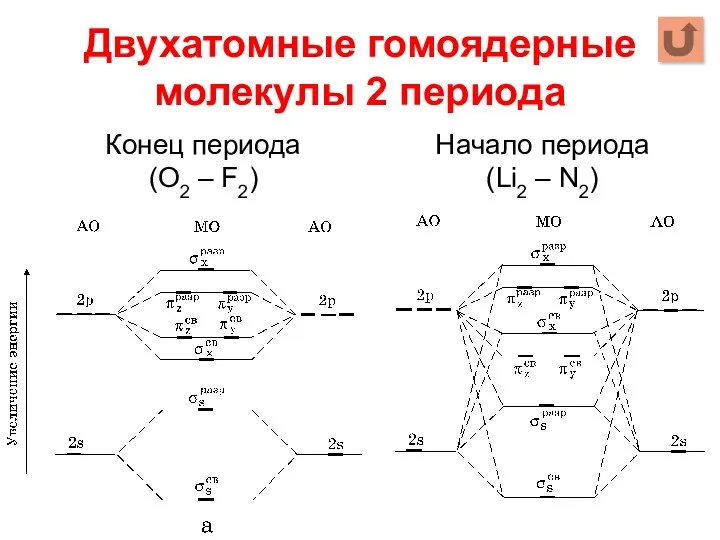
- 11. Двухатомные гомоядерные молекулы 2 периода Начало периода (Li2 – N2) Конец периода (О2 – F2)
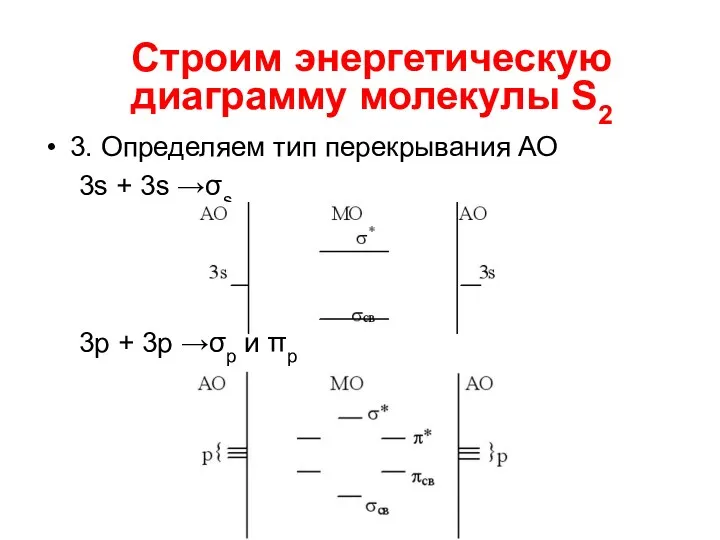
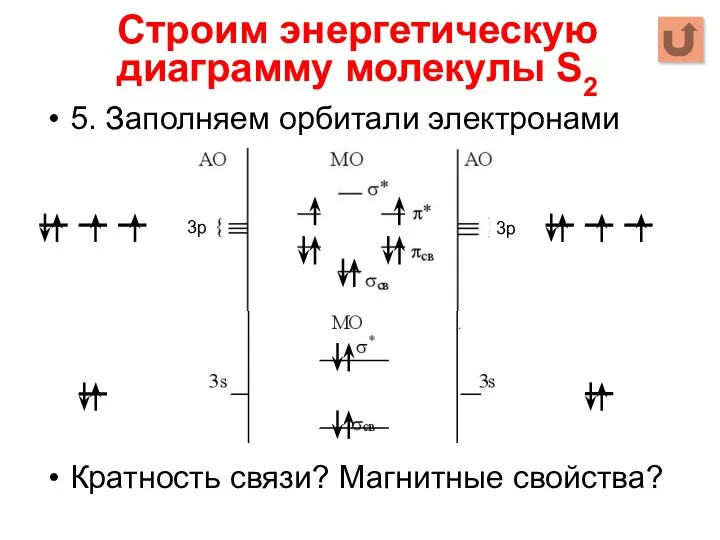
- 12. Строим энергетическую диаграмму молекулы S2 1. Строим АО внешнего уровня 2. Определяем число МО: Σ АО
- 13. 3. Определяем тип перекрывания АО 3s + 3s →σs 3p + 3p →σp и πp Строим
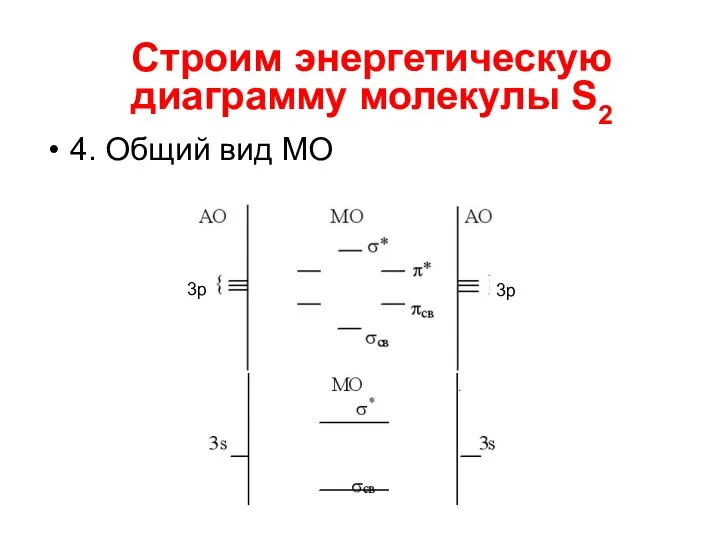
- 14. 4. Общий вид МО Строим энергетическую диаграмму молекулы S2 3р 3р
- 15. 5. Заполняем орбитали электронами Кратность связи? Магнитные свойства? Строим энергетическую диаграмму молекулы S2 3р 3р
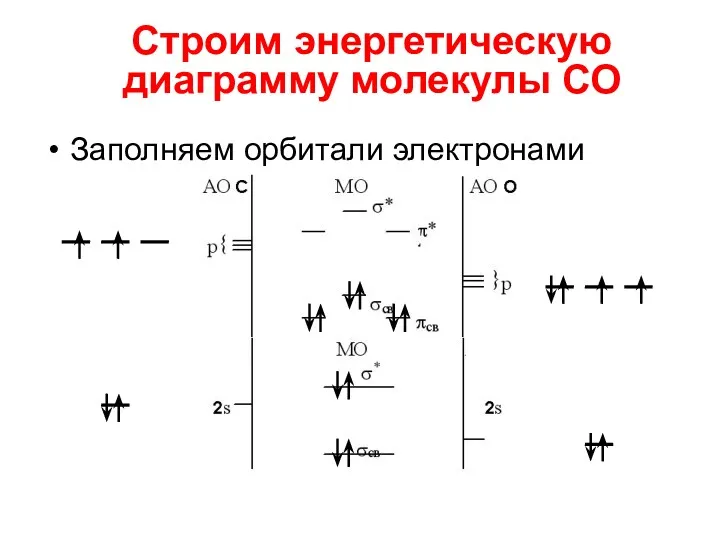
- 16. Cтроим энергетическую диаграмму молекулы СО 1. Строим АО внешнего уровня 2. Определяем число МО: Σ АО
- 17. 3. Определяем тип перекрывания АО 2s + 2s →σs 2p + 2p →σp и πp Строим
- 18. Заполняем орбитали электронами Строим энергетическую диаграмму молекулы СО
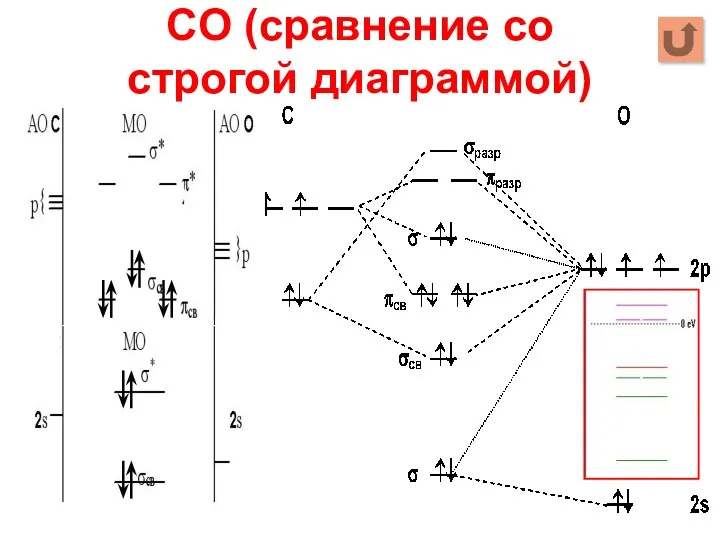
- 19. CO (сравнение со строгой диаграммой)
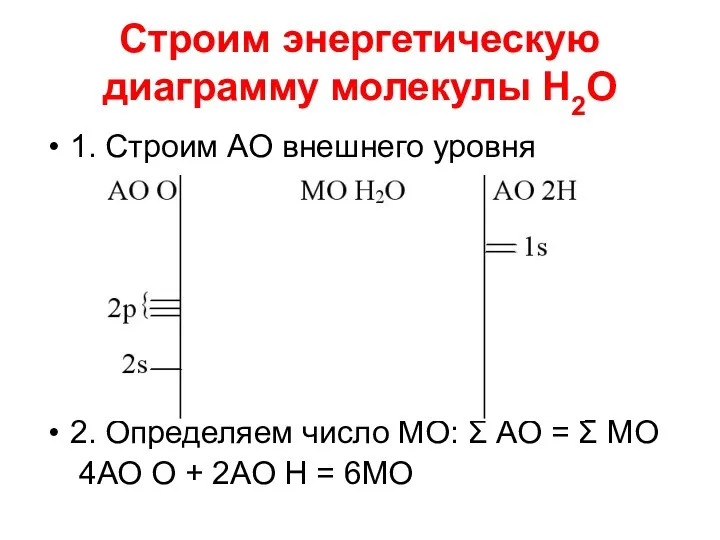
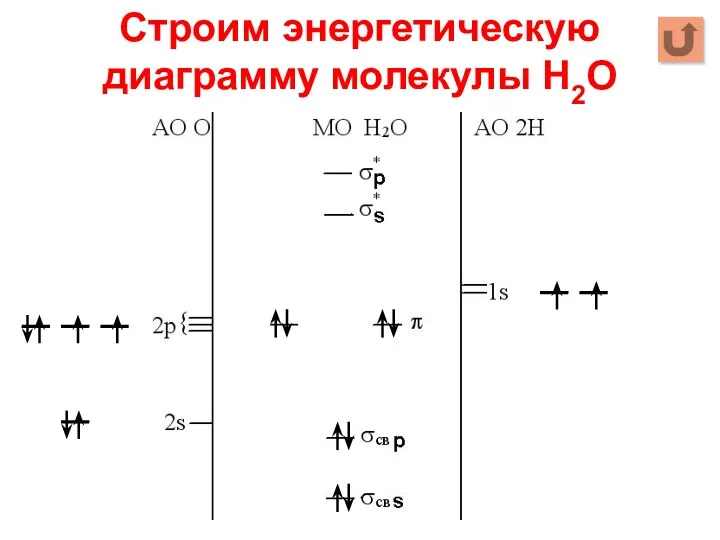
- 20. Строим энергетическую диаграмму молекулы Н2О 1. Строим АО внешнего уровня 2. Определяем число МО: Σ АО
- 21. Строим энергетическую диаграмму молекулы Н2О 3. Определяем тип перекрывания АО 2s + 1s →σs 2p +
- 22. Строим энергетическую диаграмму молекулы Н2О
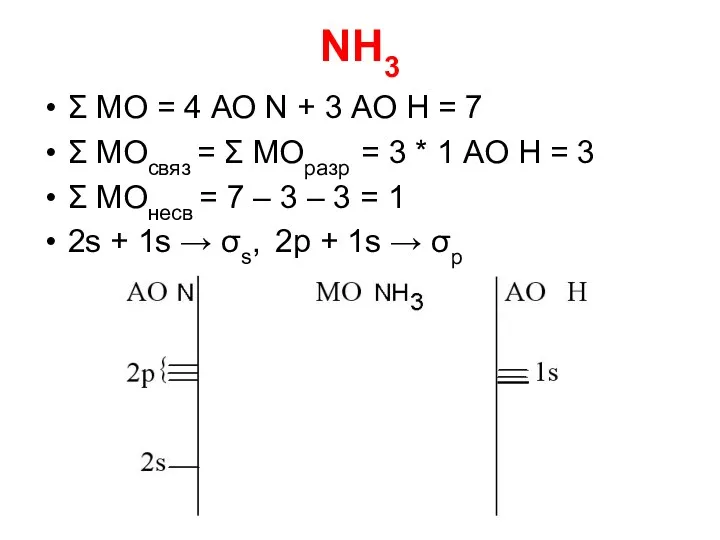
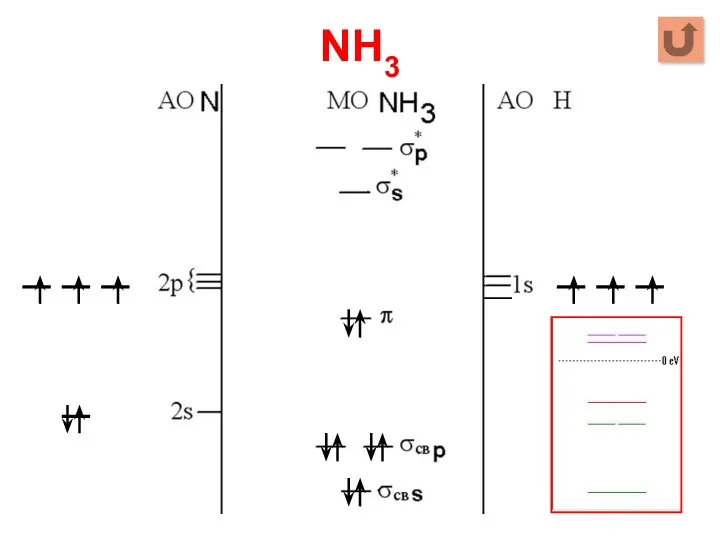
- 23. NH3 Σ МО = 4 АО N + 3 АО Н = 7 Σ МОсвяз =
- 24. NH3
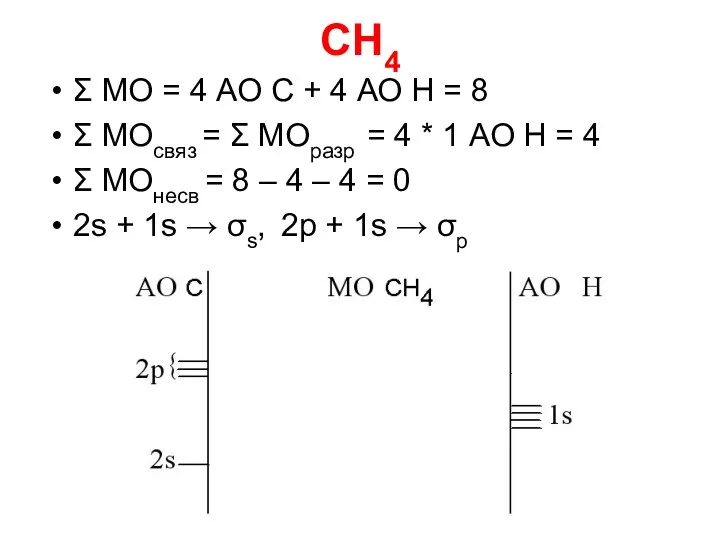
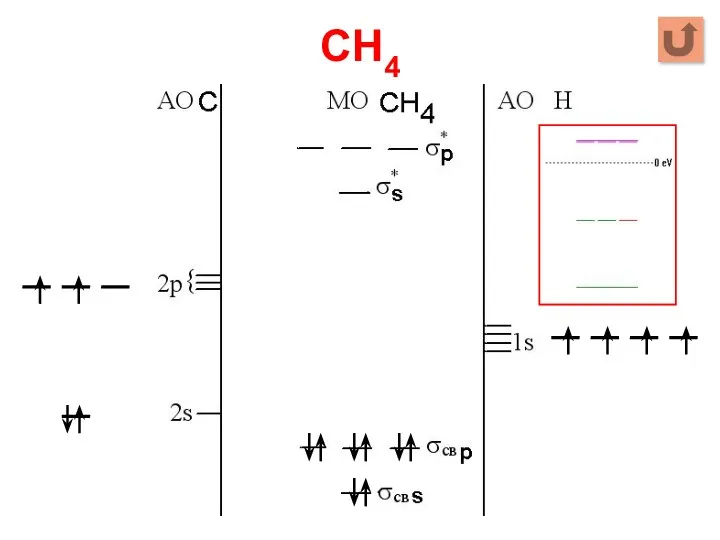
- 25. CH4 Σ МО = 4 АО C + 4 АО Н = 8 Σ МОсвяз =
- 26. CH4
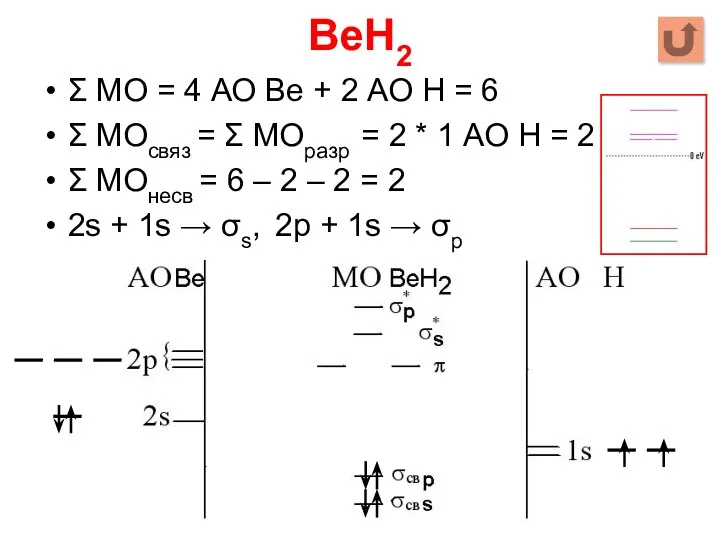
- 27. BeH2 Σ МО = 4 АО Be + 2 АО Н = 6 Σ МОсвяз =
- 29. Скачать презентацию








 Стратегия химической промышленности
Стратегия химической промышленности Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Catalysis. Topic 3.2
Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Catalysis. Topic 3.2 Химия в повседневной жизни человека
Химия в повседневной жизни человека Емтихан сұрақтары
Емтихан сұрақтары Managing chemicals. Green chemistry for every laboratory
Managing chemicals. Green chemistry for every laboratory Классификация химических реакций
Классификация химических реакций 20230419_azot
20230419_azot Органикалық қосылыстар
Органикалық қосылыстар Хозяйственные товары из пластических масс
Хозяйственные товары из пластических масс Металлы побочных подгрупп
Металлы побочных подгрупп Периодический закон и система элементов Д.И. Менделеева
Периодический закон и система элементов Д.И. Менделеева Минералы горных пород
Минералы горных пород Охрана труда в кабинете (лаборатории) химии образовательного учреждения
Охрана труда в кабинете (лаборатории) химии образовательного учреждения Водородная связь
Водородная связь Хроматография. Классификации хроматографических методов
Хроматография. Классификации хроматографических методов Амины. Анилин
Амины. Анилин Шкала не Мооса
Шкала не Мооса Растворы. Лекция №4
Растворы. Лекция №4 Оценка опасности взрыва горючих газов
Оценка опасности взрыва горючих газов Хімічні властивості насичених одноатомних спиртів. Одержання етанолу
Хімічні властивості насичених одноатомних спиртів. Одержання етанолу Нефть, её производство, авиационное и дизельное топливо
Нефть, её производство, авиационное и дизельное топливо Органическая химия. Лекция 13
Органическая химия. Лекция 13 Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов
Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов Вуглеводні. Підсумковий урок 9 клас
Вуглеводні. Підсумковий урок 9 клас Химия. D-элементтер
Химия. D-элементтер сложные эфиры
сложные эфиры Күрделі белоктар
Күрделі белоктар Простые вещества. Сложные вещества
Простые вещества. Сложные вещества