Содержание
- 2. •Подгруппа меди (медь, серебро, золото) •Подгруппа цинка (цинк, кадмий, ртуть) •Переходные металлы (хром, марганец, молибден, вольфрам
- 3. Особенностью является наличие заполненного предвнешнего d-подуровня, достигаемое за счёт перескока электрона с внешнего s-подуровня. Причина такого
- 4. • при 400–500°С : 2Cu + O2 = 2CuO; • при 1000°С : 4Cu + O2
- 5. Растворяется в разбавленной азотной кислоте: 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O Реагирует с
- 6. • Соли Cu2+ обычно окрашены в голубой или зеленоватый цвет. • Образование нерастворимого гидроксида меди (II)
- 7. При обычных условиях реагирует с серой, образуя сульфид серебра (I): 2Ag + S = Ag2S, при
- 8. • Образование белого творожистого осадка Ag+ + Cl- = AgCl↓, растворимого в гидрате аммиака AgCl +
- 9. • Цинк [Ar] 3d10 4s2 хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем
- 10. • На воздухе покрывается оксидной пленкой, при сильном нагреве горит голубоватым пламенем 2Zn + O2 =
- 11. Типичный переходный элемент. Zn + 2H2SO4 = ZnSO4 + SO2 + 2H2O; Zn + 4HNO3 =
- 12. Образование нерастворимого основания Zn2+ + 2OH- = Zn(OH)2↓ + 2OH- = [Zn(OH)4]2- осадок белого цвета, растворимый
- 13. Эл. Конфигурация [Ar] 3d5 4s1 В свободном виде — голубовато-белый металл с кубической решеткой, один из
- 14. • Оксид хрома(2) - СrО – твердое ярко – красное вещество, типичный основной оксид (ему соответствует
- 15. Наиболее устойчивая с.о. хрома. • Оксид хрома(3) - Сr2О3 нерастворим в воде, тугоплавкий, по твёрдости близок
- 16. Оксид хрома (6) - СrО3 – темно – красное кристаллическое вещество, хорошо растворимо в воде, типичный
- 17. В кислой среде раствора хроматы переходят в дихроматы: 2К2СrО4 + Н2SО4 = К2Сr2О7 + К2SО4 +
- 18. Дихроматы – сильные окислители. Под действием восстановителей в кислой среде переходят в соли хрома (III) K2Cr2O7
- 19. Электронная конфигурация [Ar] 3d5 4s2 Простое вещество марганец — металл серебристо-белого цвета. Наряду с железом и
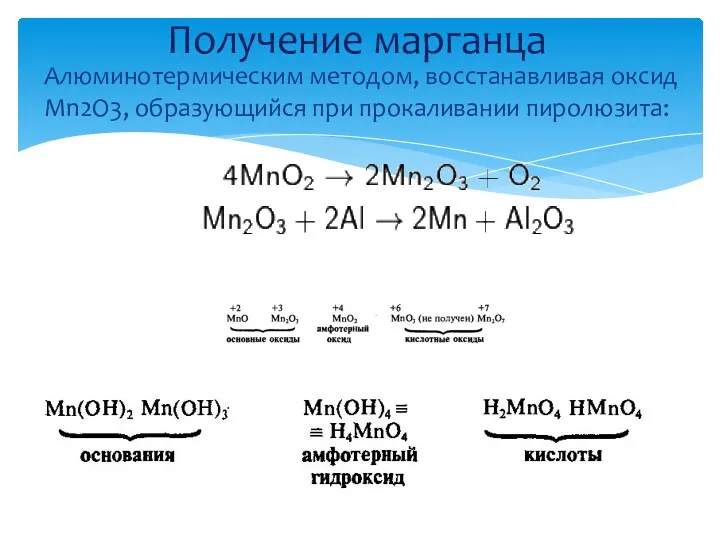
- 20. Степени окисления и соединения Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита: Получение марганца
- 21. Соединения Mn 4+ Наиболее устойчивым соединением марганца является темно-бурый диоксид марганца MnO2 (главный компонент важнейшего природного
- 22. Соли Mn 2+ MnCl2 MnSO4 Mn(OH)2 + 2HCl = MnCl2 + 2H2O. Соли марганца (II) образуются
- 23. Соединения Мn 7+ Марганцевая кислота — сильная, нестабильная, неорганическая кислота фиолетово-красного цвета с химической формулой HMnO4.
- 25. Скачать презентацию







![• Цинк [Ar] 3d10 4s2 хрупкий переходный металл голубовато-белого цвета](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/188819/slide-8.jpg)



![Эл. Конфигурация [Ar] 3d5 4s1 В свободном виде — голубовато-белый](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/188819/slide-12.jpg)





![Электронная конфигурация [Ar] 3d5 4s2 Простое вещество марганец — металл](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/188819/slide-18.jpg)



 Кислоты. Состав кислот
Кислоты. Состав кислот Реакції йонного обміну. Йонно-молекулярні рівняння
Реакції йонного обміну. Йонно-молекулярні рівняння Амфотерные соединения
Амфотерные соединения Гетероциклические соединения
Гетероциклические соединения Фенолы. Химические свойства и способы получения
Фенолы. Химические свойства и способы получения Chemical Formulas and Nomenclature of compounds
Chemical Formulas and Nomenclature of compounds Товары бытовой химии
Товары бытовой химии Кристаллофизика_часть_1
Кристаллофизика_часть_1 Тяжелые металлы. Опасность токсичных металлов для организма
Тяжелые металлы. Опасность токсичных металлов для организма Домашнее задание по теме Химические свойства альдегидов, их получение
Домашнее задание по теме Химические свойства альдегидов, их получение Электронные конфигурации атомов химических элементов. Графическое изображение электронных конфигураций атомов
Электронные конфигурации атомов химических элементов. Графическое изображение электронных конфигураций атомов Переработка газа. Первичная переработка нефти. Лекция 9
Переработка газа. Первичная переработка нефти. Лекция 9 Химические соединения в организме человека
Химические соединения в организме человека Способы и степень дробления
Способы и степень дробления Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Осадочные и метаморфические горные породы
Осадочные и метаморфические горные породы Химическая термодинамика
Химическая термодинамика Свойства воды. Оценка качества
Свойства воды. Оценка качества Состав и свойства сжиженного газа. Вопрос №1
Состав и свойства сжиженного газа. Вопрос №1 Химический элемент фосфор
Химический элемент фосфор Углерод и его соединения
Углерод и его соединения Характеристика металу Ферум
Характеристика металу Ферум Separation amp confirmation
Separation amp confirmation Оксиды. Физические свойства
Оксиды. Физические свойства Галогены. Нахождение в природе
Галогены. Нахождение в природе Химия и проблемы экологии. Кислотные дожди
Химия и проблемы экологии. Кислотные дожди Алкины. Гомологический ряд, получение, свойства и применение
Алкины. Гомологический ряд, получение, свойства и применение Биоорганическая химия
Биоорганическая химия