Содержание
- 2. ГЕОМЕТРИЧЕСКАЯ КРИСТАЛЛОГРАФИЯ Для направлений: «Техническая физика», «Электроника и наноэлектроника», «Материаловедение и технология материалов» «Электроника и микроэлектроника»
- 3. ПРИОБРЕТАЕМЫЕ КОМПЕТЕНЦИИ Готовность: - использовать кристаллографическую символику при описании симметрии кристаллов и кристаллических структур; - использовать
- 4. Научить использовать теорию симметрии и метод кристаллографических проекций для описания и анализа структуры кристаллов. Разделы курса:
- 5. Раздел 1 Симметрия кристаллических многогранников Лекция 1 Структура кристалла и понятие о пространственной решетке У кристаллов
- 6. Закон постоянства углов Углы между соответственными гранями (и ребрами) во всех кристаллах одного вещества одной полиморфной
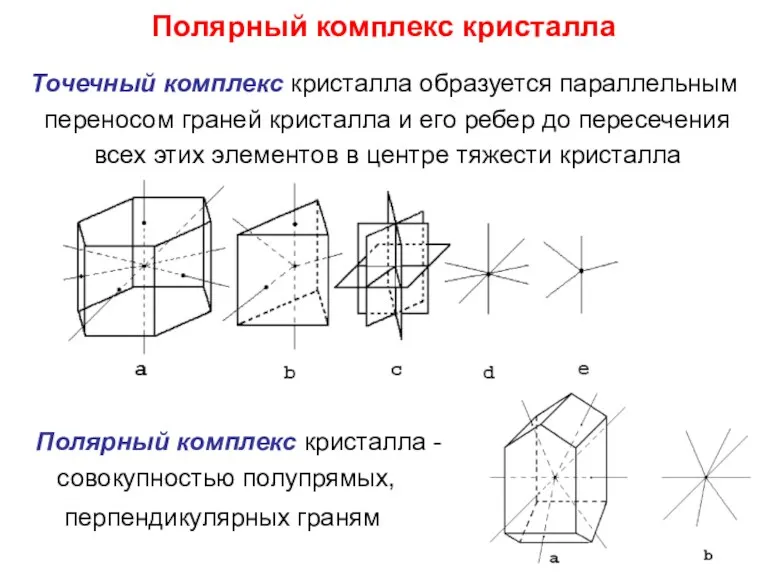
- 7. Полярный комплекс кристалла Точечный комплекс кристалла образуется параллельным переносом граней кристалла и его ребер до пересечения
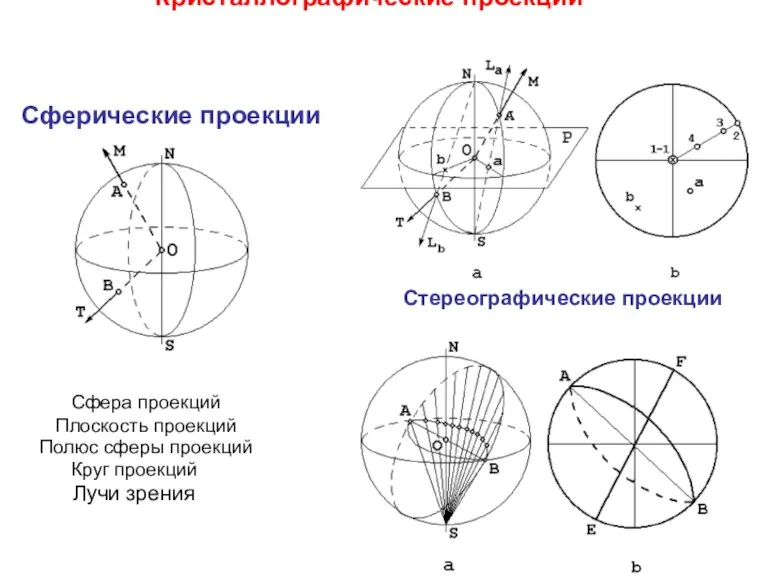
- 8. Кристаллографические проекции Сферические проекции Стереографические проекции Сфера проекций Плоскость проекций Полюс сферы проекций Круг проекций Лучи
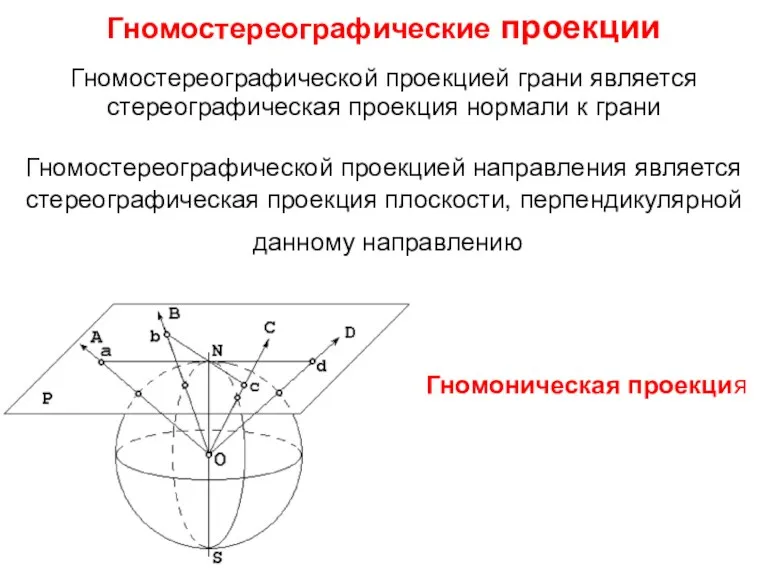
- 9. Гномостереографические проекции Гномостереографической проекцией грани является стереографическая проекция нормали к грани Гномостереографической проекцией направления является стереографическая
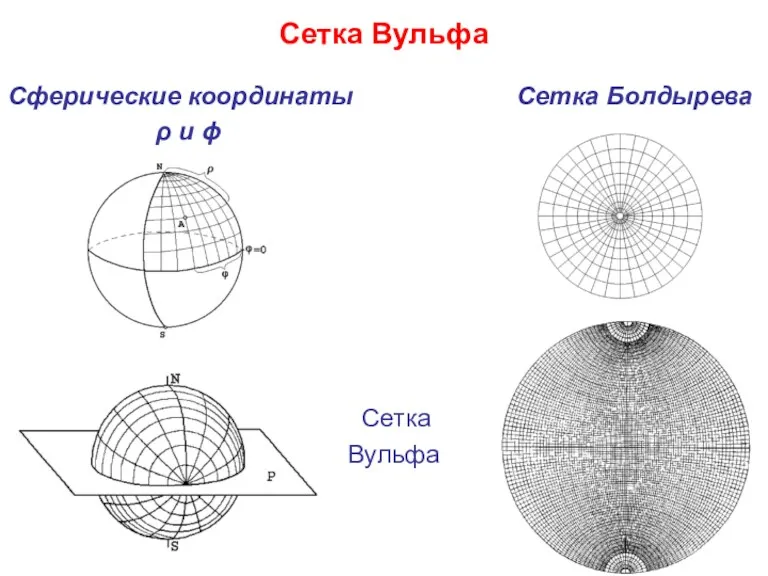
- 10. Сетка Вульфа Сферические координаты Сетка Болдырева ρ и ϕ Сетка Вульфа
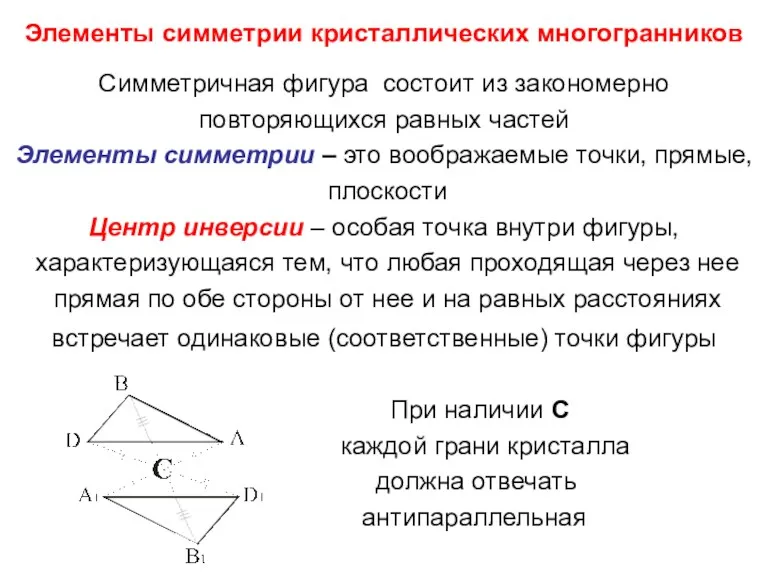
- 11. Элементы симметрии кристаллических многогранников Симметричная фигура состоит из закономерно повторяющихся равных частей Элементы симметрии – это
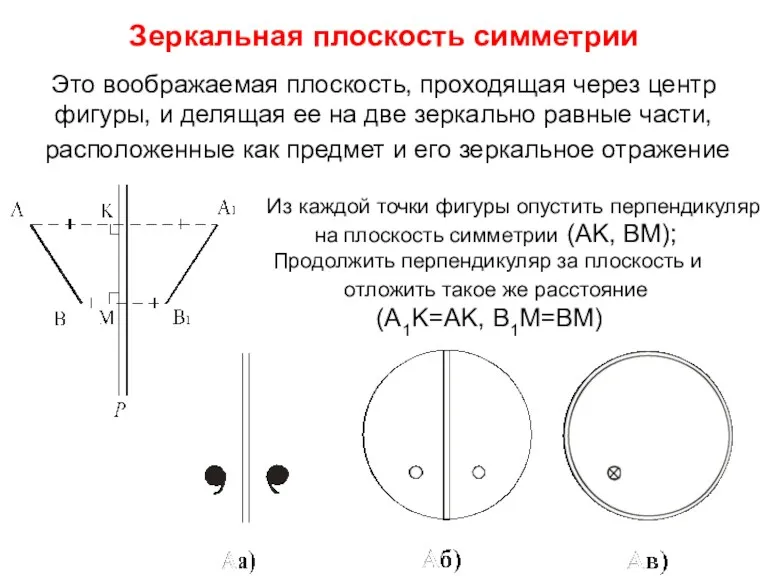
- 12. Зеркальная плоскость симметрии Это воображаемая плоскость, проходящая через центр фигуры, и делящая ее на две зеркально
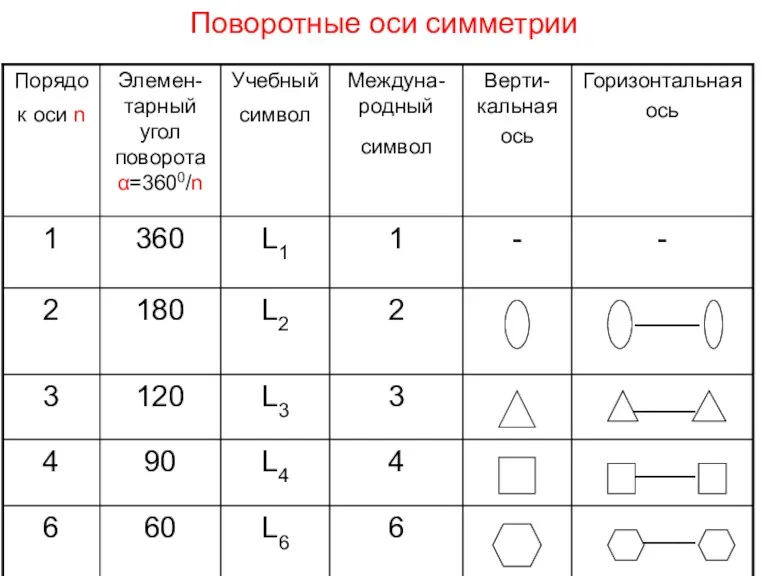
- 13. Поворотные оси симметрии Поворотная ось симметрии – воображаемая прямая линия, проходящая через центр фигуры, вокруг которой
- 14. Поворотные оси симметрии
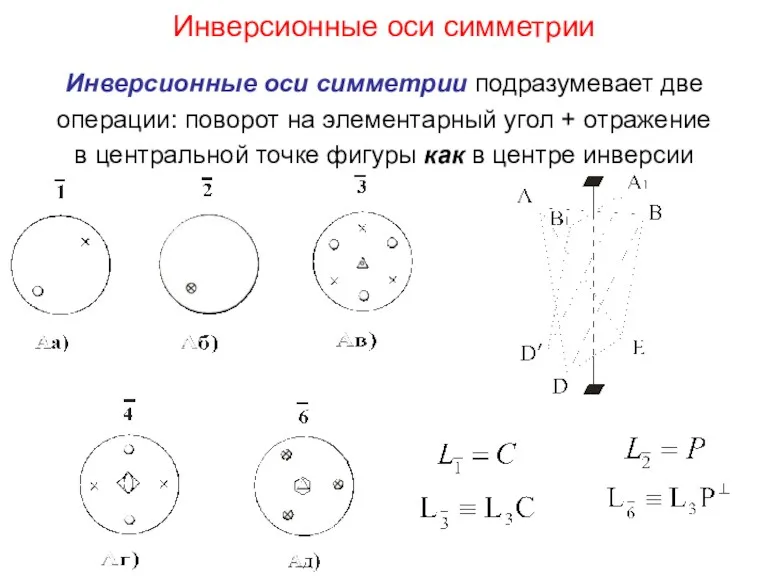
- 15. Инверсионные оси симметрии Инверсионные оси симметрии подразумевает две операции: поворот на элементарный угол + отражение в
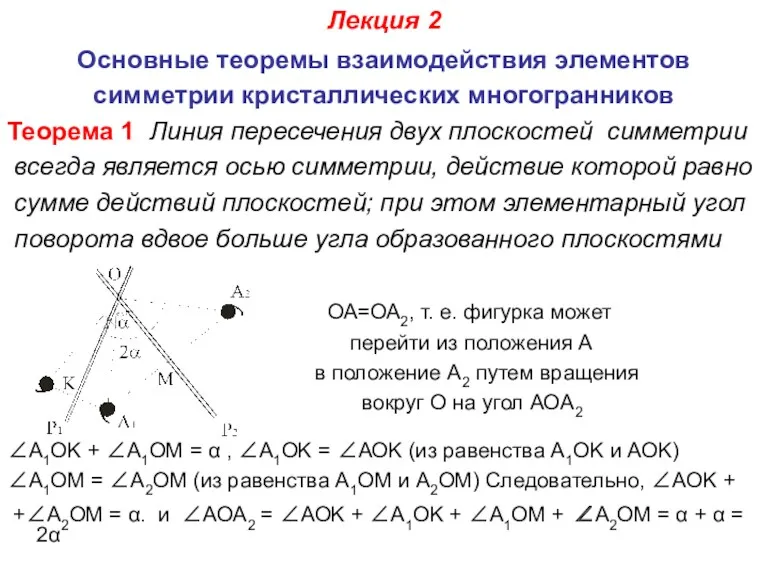
- 16. Лекция 2 Основные теоремы взаимодействия элементов симметрии кристаллических многогранников Теорема 1 Линия пересечения двух плоскостей симметрии
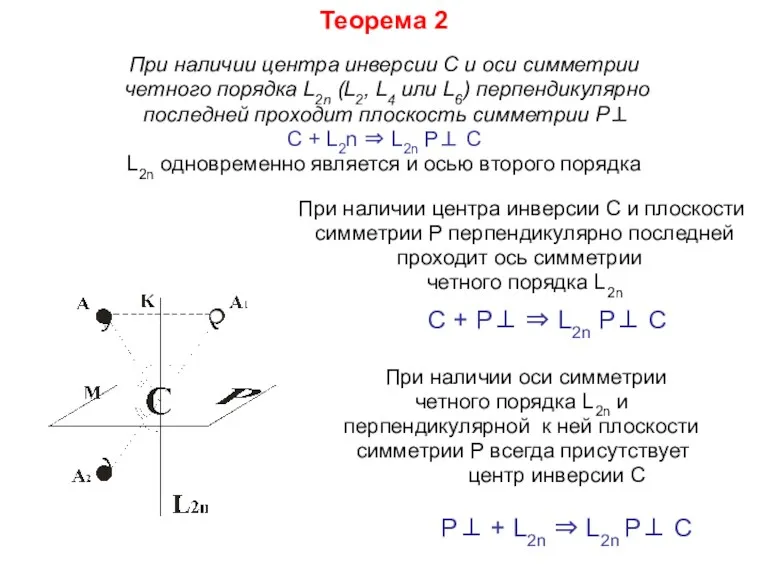
- 17. Теорема 2 При наличии центра инверсии С и оси симметрии четного порядка L2n (L2, L4 или
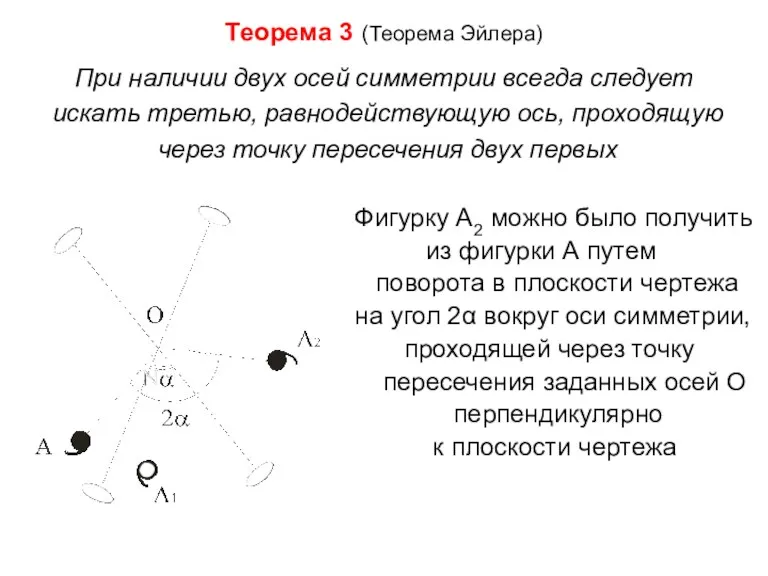
- 18. Теорема 3 (Теорема Эйлера) При наличии двух осей симметрии всегда следует искать третью, равнодействующую ось, проходящую
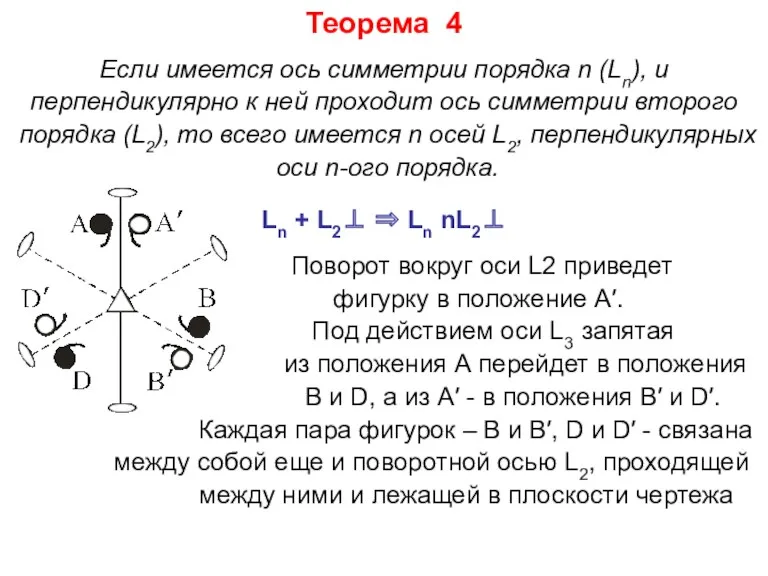
- 19. Теорема 4 Если имеется ось симметрии порядка n (Ln), и перпендикулярно к ней проходит ось симметрии
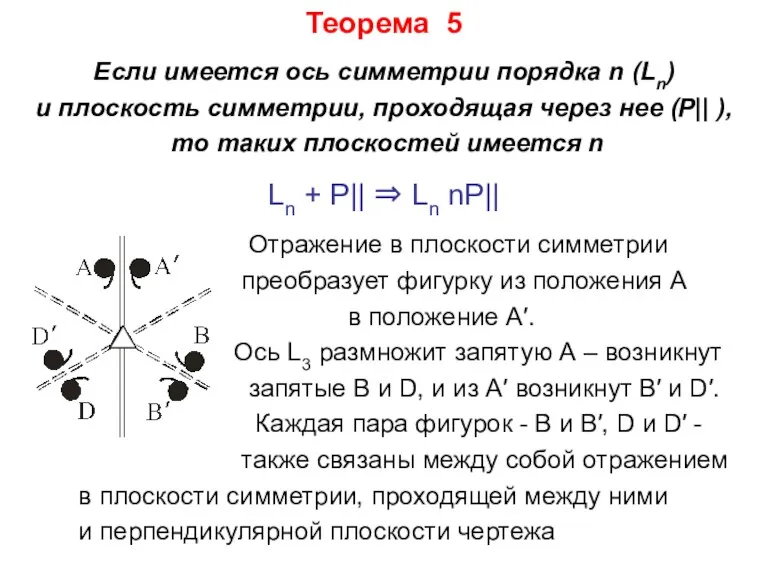
- 20. Теорема 5 Если имеется ось симметрии порядка n (Ln) и плоскость симметрии, проходящая через нее (P||
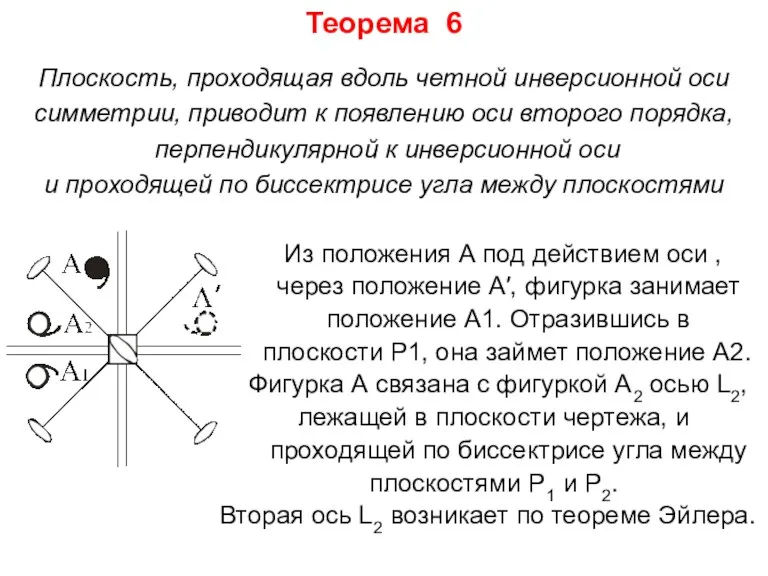
- 21. Теорема 6 Плоскость, проходящая вдоль четной инверсионной оси симметрии, приводит к появлению оси второго порядка, перпендикулярной
- 22. Единичные и полярные направления Не повторяющееся в кристалле направление называется единичным Полярное направление – такое направление,
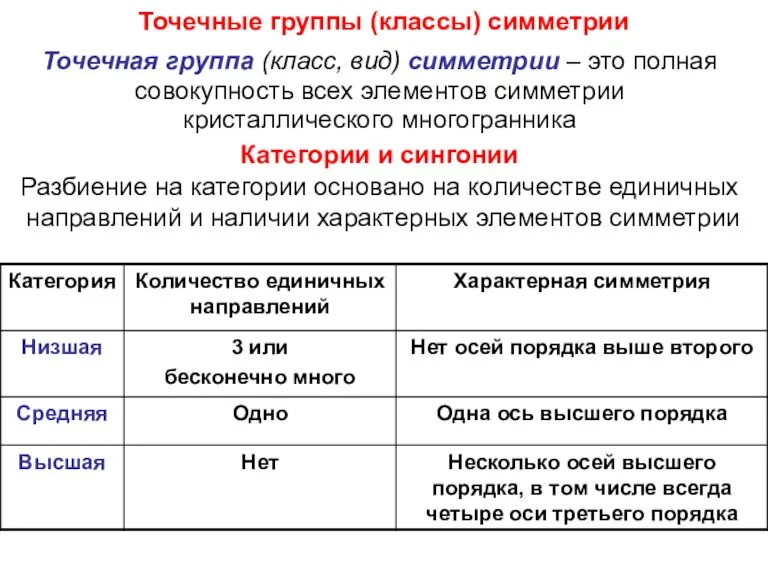
- 23. Точечные группы (классы) симметрии Точечная группа (класс, вид) симметрии – это полная совокупность всех элементов симметрии
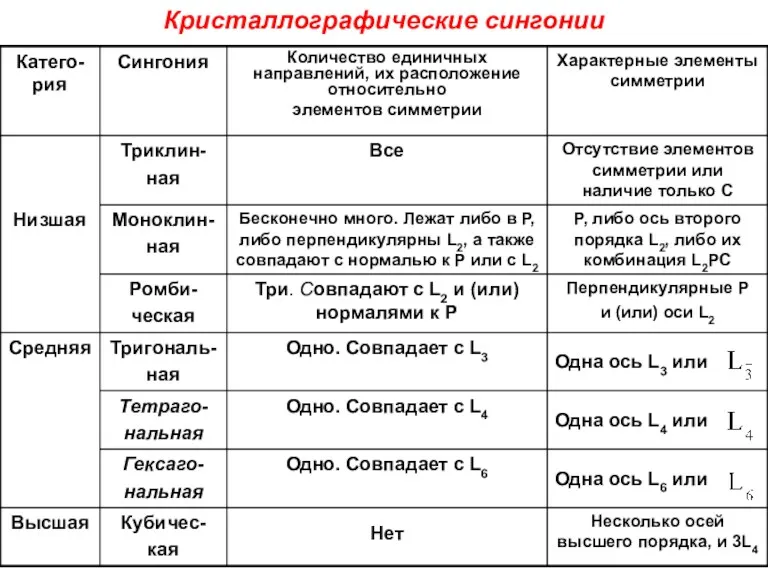
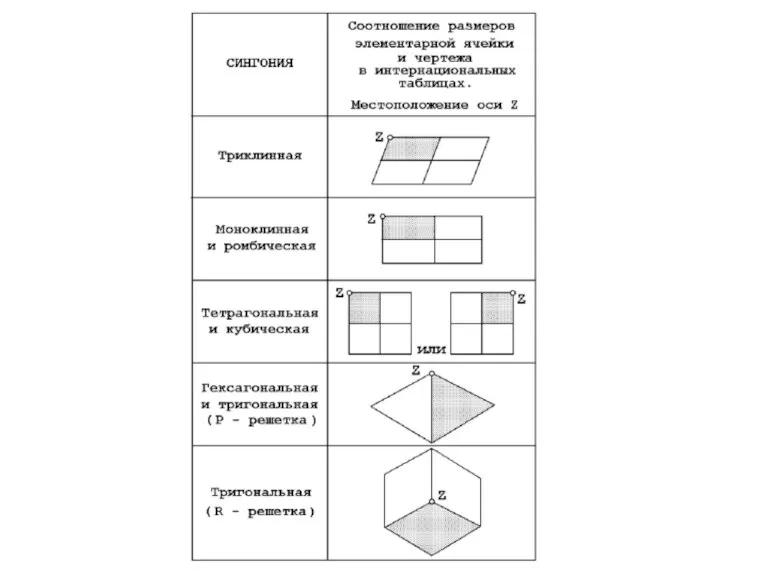
- 24. Кристаллографические сингонии
- 25. Принцип вывода 32 классов симметрии Формула симметрии - это записанные все элементы симметрии кристалла: сначала оси
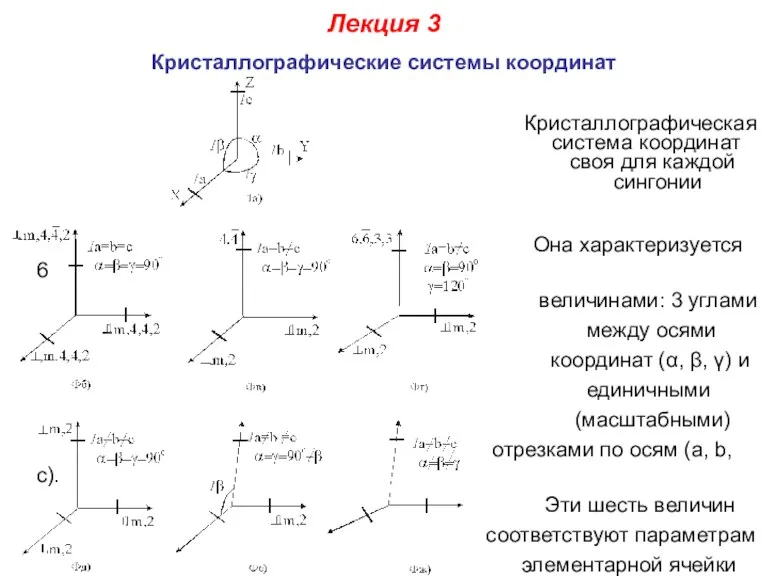
- 26. Лекция 3 Кристаллографические системы координат Кристаллографическая система координат своя для каждой сингонии Она характеризуется 6 величинами:
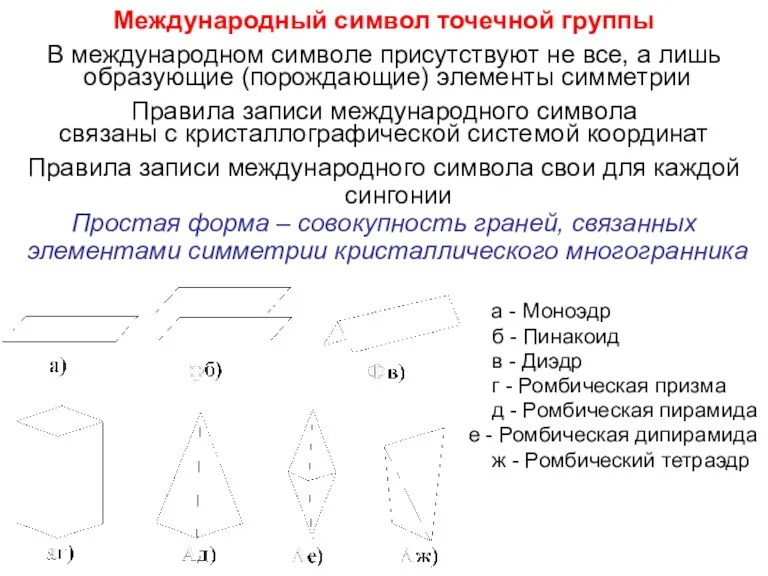
- 27. Международный символ точечной группы В международном символе присутствуют не все, а лишь образующие (порождающие) элементы симметрии
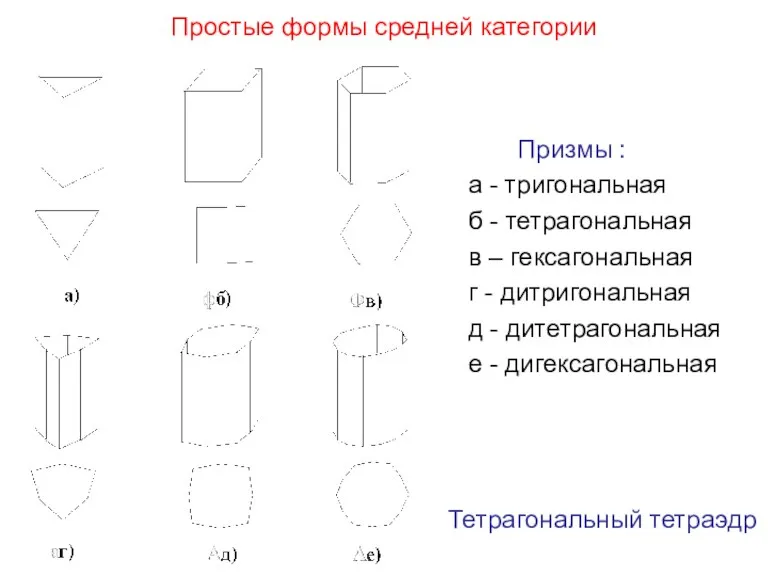
- 28. Простые формы средней категории Призмы : а - тригональная б - тетрагональная в – гексагональная г
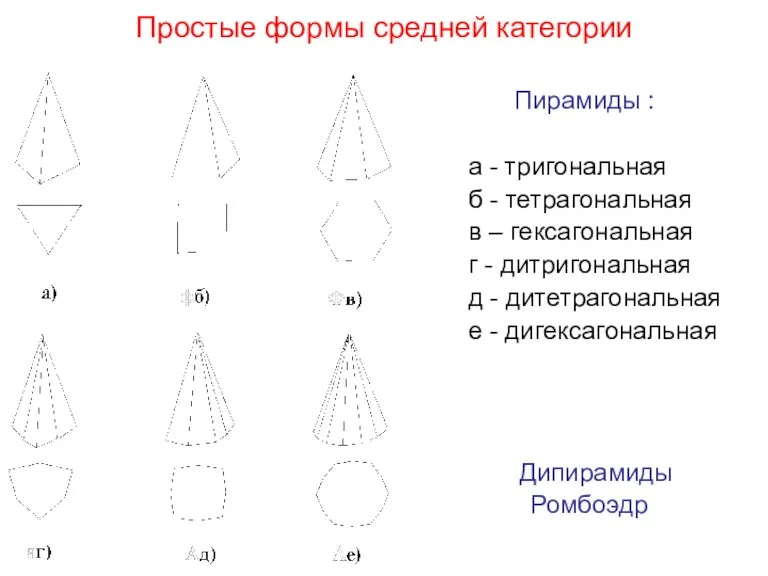
- 29. Простые формы средней категории Пирамиды : а - тригональная б - тетрагональная в – гексагональная г
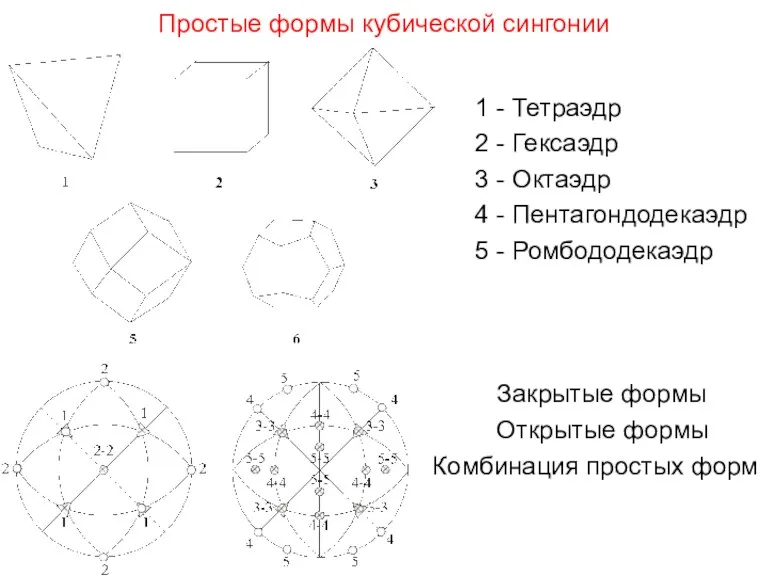
- 30. Простые формы кубической сингонии 1 - Тетраэдр 2 - Гексаэдр 3 - Октаэдр 4 - Пентагондодекаэдр
- 31. Индицирование кристаллов Индицирование узлов Символ узла - [[mnp]] – совокупность чисел m, n, p, заключенных в
- 32. Индицирование плоскостей (граней кристалла) Закон рациональности отношений параметров Двойные отношения параметров, отсекаемых двумя любыми гранями кристалла
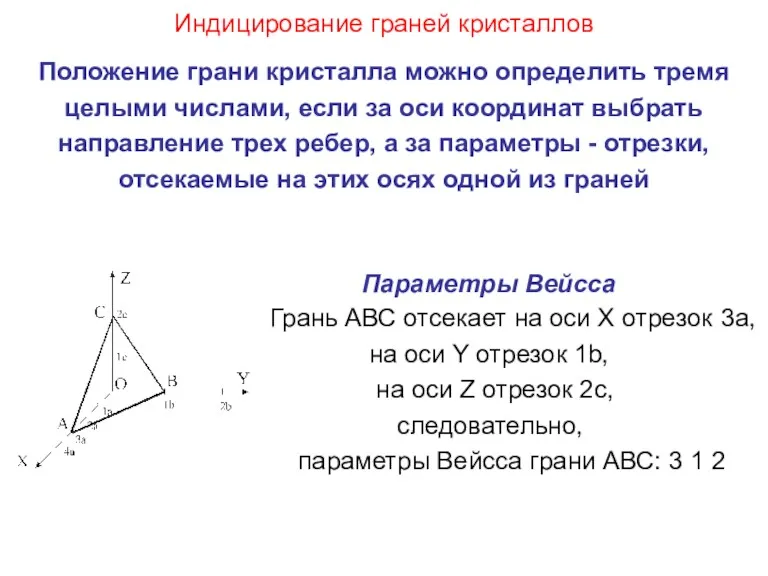
- 33. Индицирование граней кристаллов Положение грани кристалла можно определить тремя целыми числами, если за оси координат выбрать
- 34. Индексы Миллера это величины, обратно пропорциональные отрезкам (в осевых единицах а, b, с), которые грань отсекает
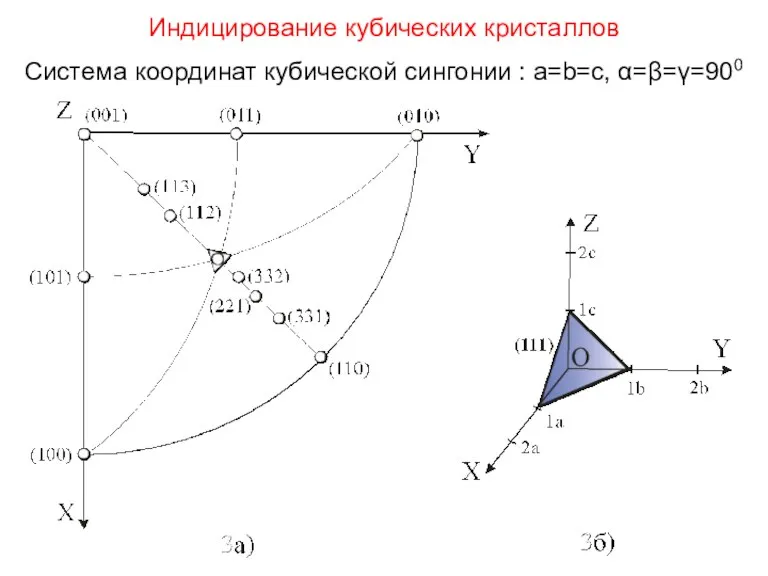
- 35. Индицирование кубических кристаллов Система координат кубической сингонии : a=b=c, α=β=γ=900
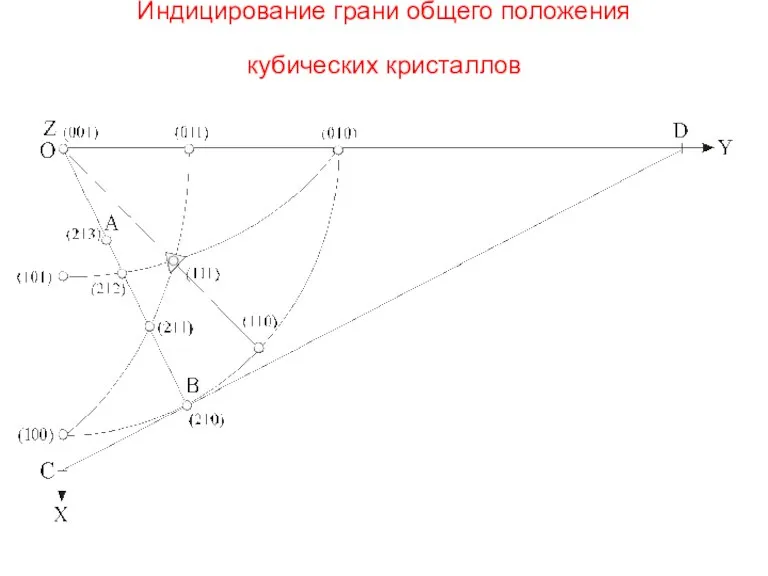
- 36. Индицирование грани общего положения кубических кристаллов
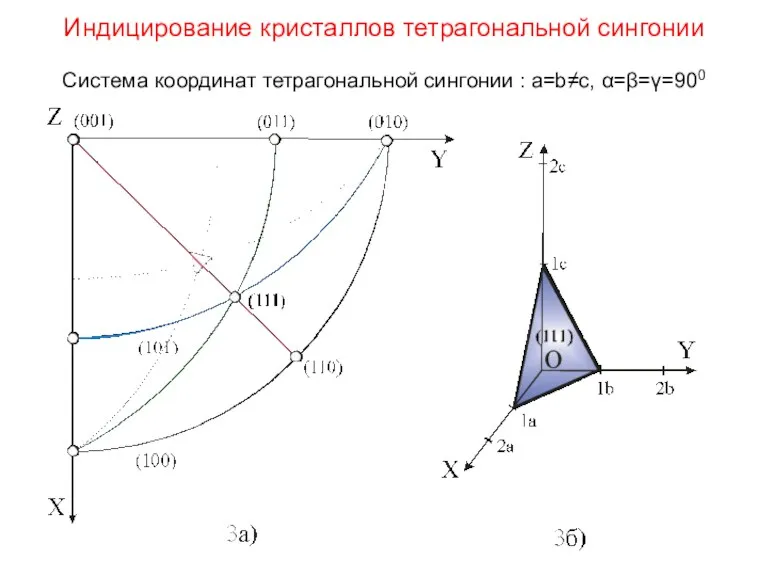
- 37. Индицирование кристаллов тетрагональной сингонии Система координат тетрагональной сингонии : a=b≠c, α=β=γ=900
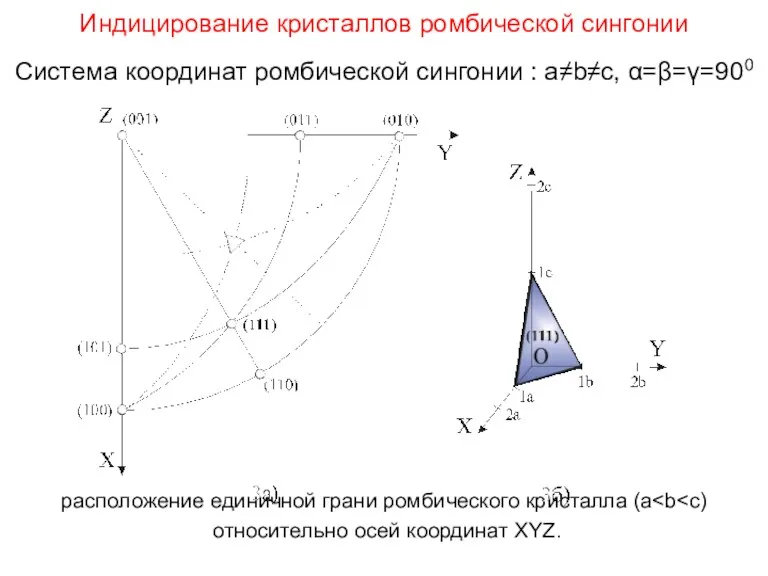
- 38. Индицирование кристаллов ромбической сингонии Система координат ромбической сингонии : a≠b≠c, α=β=γ=900 расположение единичной грани ромбического кристалла
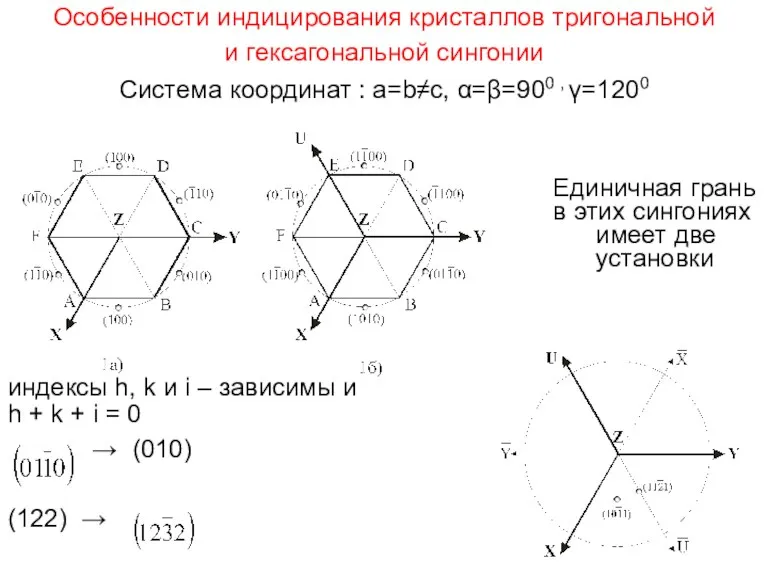
- 39. Особенности индицирования кристаллов тригональной и гексагональной сингонии Система координат : a=b≠c, α=β=900 , γ=1200 Единичная грань
- 40. Определение символа грани кристалла по методу косинусов Для ортогональной системы координат Из треугольников AON, BON и
- 41. Зоны в кристаллах Зона (пояс) в кристалле – совокупность граней, пересекающихся по параллельным ребрам. Ось зоны
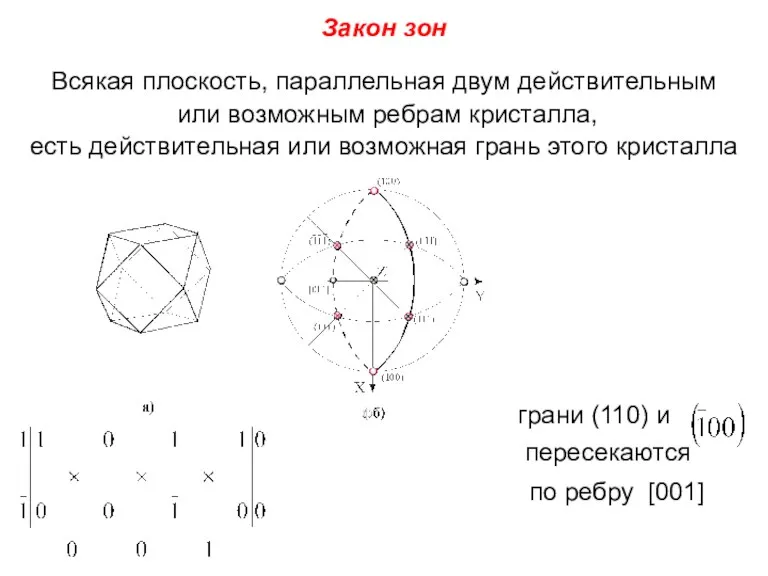
- 42. Закон зон Всякая плоскость, параллельная двум действительным или возможным ребрам кристалла, есть действительная или возможная грань
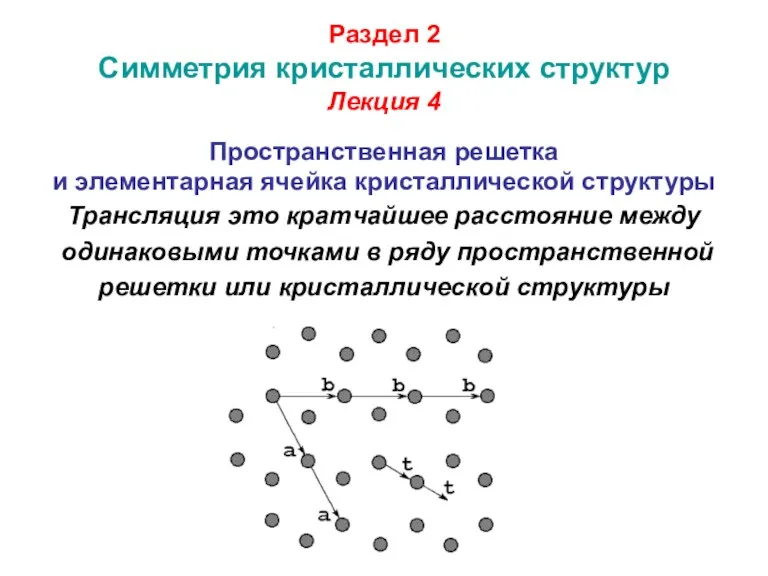
- 43. Раздел 2 Симметрия кристаллических структур Лекция 4 Пространственная решетка и элементарная ячейка кристаллической структуры Трансляция это
- 44. Пространственная решетка это тройка элементарных некомпланарных трансляций или система эквивалентных узлов, преобразующихся друг в друга с
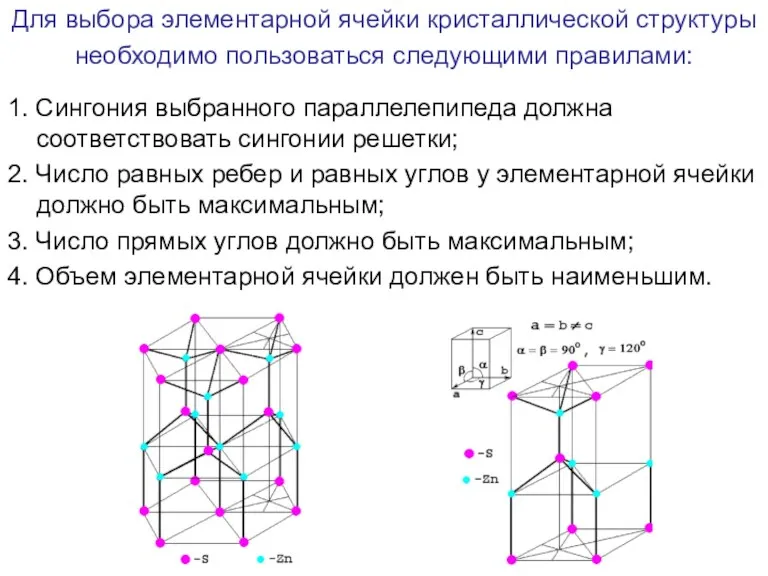
- 45. Для выбора элементарной ячейки кристаллической структуры необходимо пользоваться следующими правилами: 1. Сингония выбранного параллелепипеда должна соответствовать
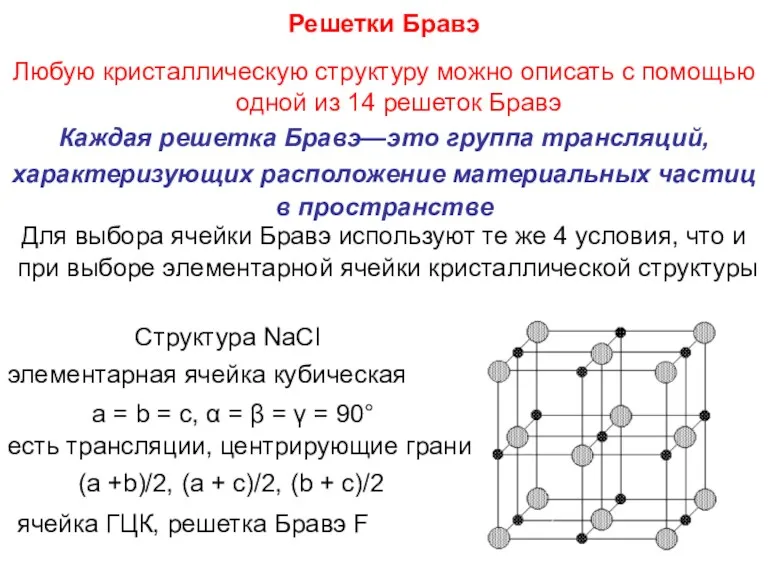
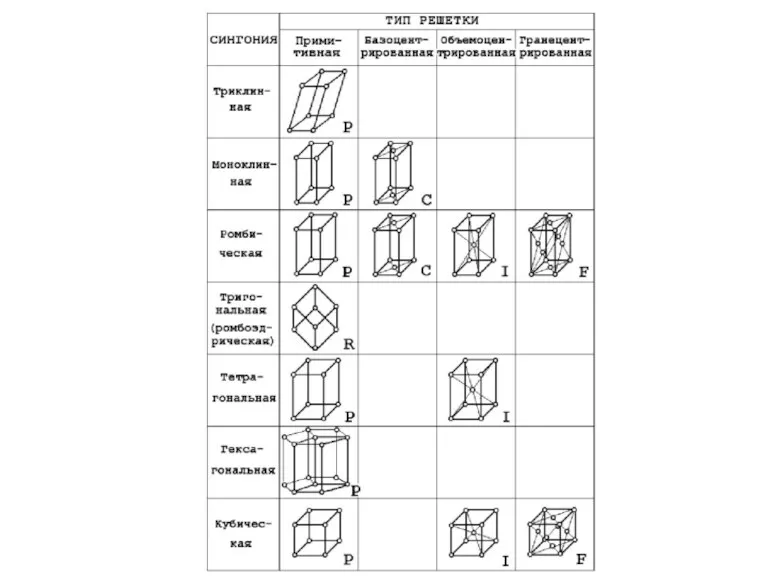
- 46. Решетки Бравэ Любую кристаллическую структуру можно описать с помощью одной из 14 решеток Бравэ Каждая решетка
- 48. Лекция 5 Элементы симметрии кристаллических структур Сочетание трансляции с плоскостями m и поворотными осями симметрии приводит
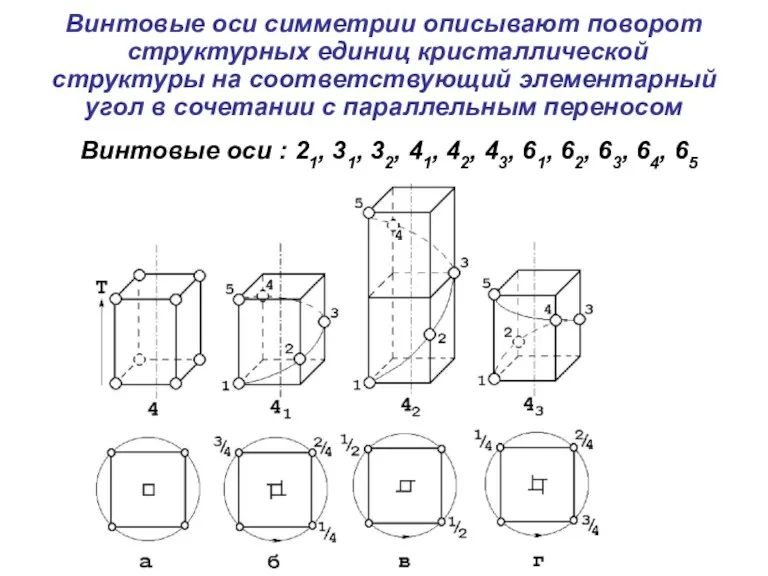
- 49. Винтовые оси симметрии описывают поворот структурных единиц кристаллической структуры на соответствующий элементарный угол в сочетании с
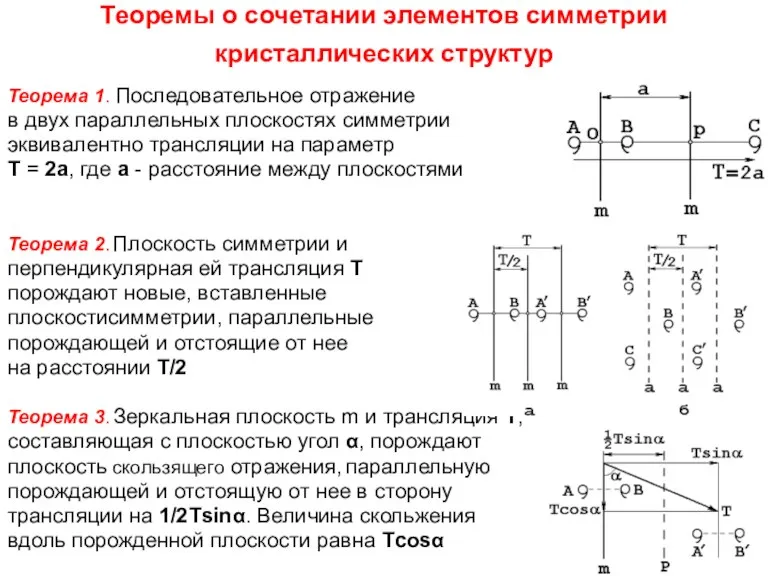
- 50. Теоремы о сочетании элементов симметрии кристаллических структур Теорема 1. Последовательное отражение в двух параллельных плоскостях симметрии
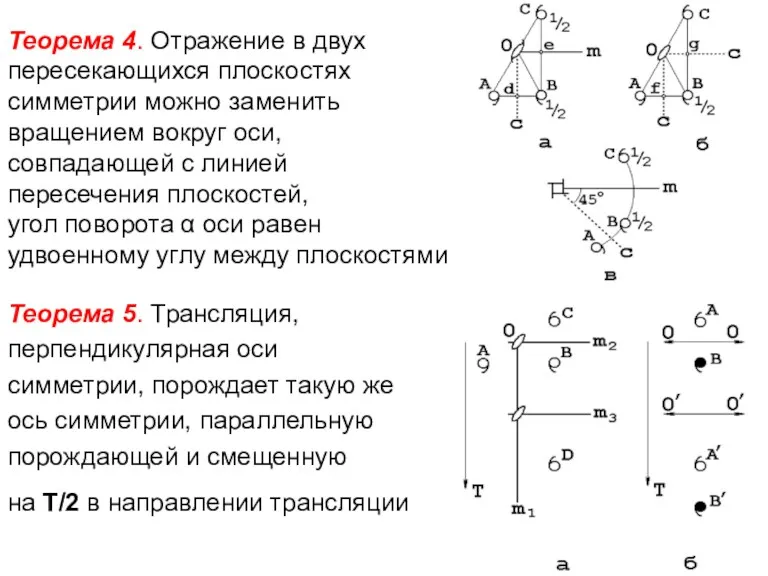
- 51. Теорема 4. Отражение в двух пересекающихся плоскостях симметрии можно заменить вращением вокруг оси, совпадающей с линией
- 52. Пространственные группы симметрии Если к точечным группам симметрии (с учетом плоскостей скользящего отражения и винтовых осей)
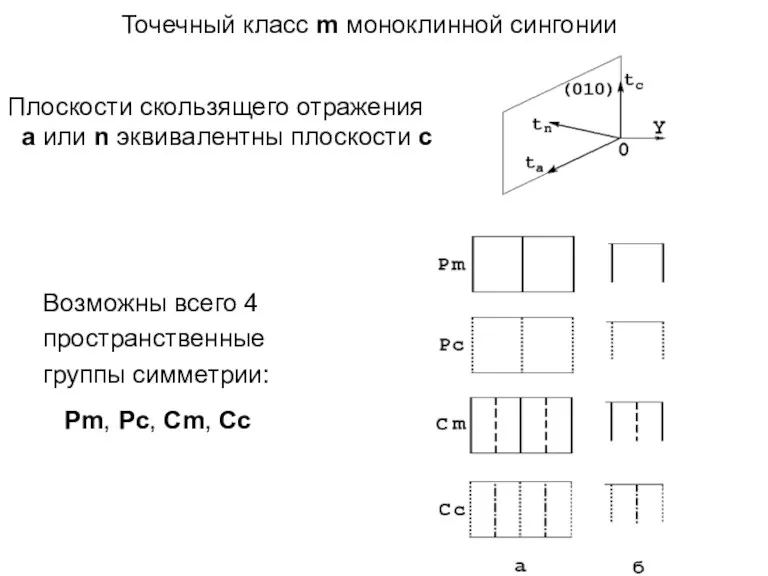
- 53. Точечный класс m моноклинной сингонии Плоскости скользящего отражения а или n эквивалентны плоскости с Возможны всего
- 54. Точечный класс 2/m моноклинной сингонии Возможны 6 пространственных групп симметрии: Р2/m, Р2/с, С2/m, С2/с, Р21/m и
- 55. Лекция 6 Правильные системы точек Правильной системой точек называется совокупность точек (симметрично эквивалентных позиций), связанных между
- 56. Базис структуры Базисом кристаллической структуры называется совокупность координат структурных единиц всех правильных систем точек Положение оси
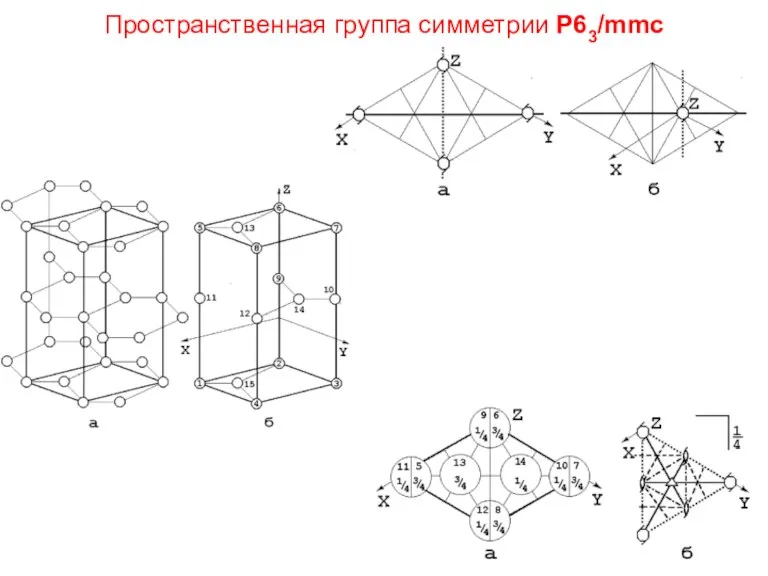
- 58. Пространственная группа симметрии Р63/mmс
- 59. Правильные системы точек в пространственных группах симметрии Р63/mmс и Р63mс
- 60. Понятие обратной решетки Прямая решетка построена на векторах а, b, c (ai), а оси обратной решетки
- 61. Важнейшие свойства обратной решетки Если провести радиус-вектор из начала координат в узел обратной решетки [[h1h2h3]] ,
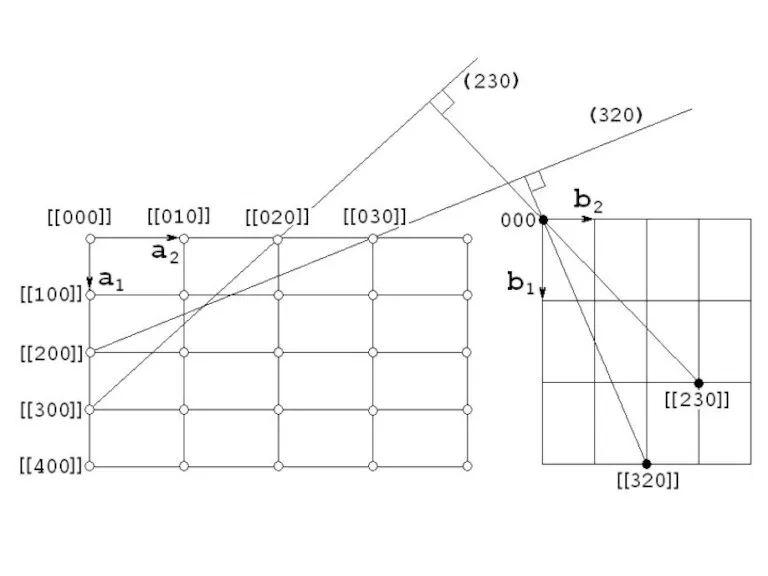
- 62. Проведем построение обратной решетки для плоской сетки 1. Выбираем начало координат для обратной решетки 2. Через
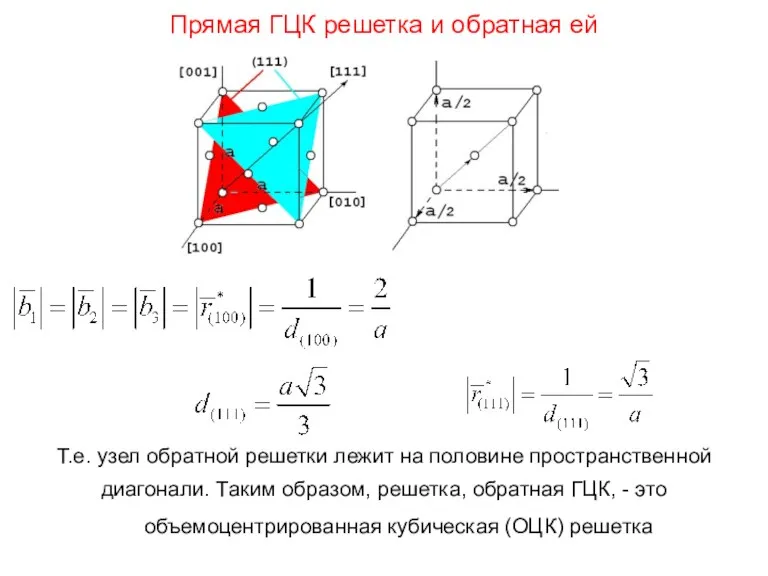
- 64. Прямая ГЦК решетка и обратная ей Т.е. узел обратной решетки лежит на половине пространственной диагонали. Таким
- 65. Раздел 3 Элементы кристаллохимии и дефекты в кристаллах Лекция 8 Типы химической связи в кристаллах Кристаллохимия
- 66. Ионная связь Потенциал ионизации - энергия, затрачиваемая на отрыв валентных электронов от атома катиона Атом металлоида,
- 67. Ковалентная связь Сближающиеся атомы создают законченные электронные оболочки, обобществляя валентные электроны (с антипараллельными спинами ) соседей
- 68. Ионно-ковалентная связь Для чисто ковалентной связи характерно одинаковое распределение электронной плотности между атомами (Si, Ge, C).
- 69. Металлическая связь Для металлической связи характерно равномерное распределение валентных электронов между всеми атомами. При металлической связи
- 70. Слабая (ван-дер-ваальсова) связь Слабые связи наблюдаются между атомами с замкнутыми электронными оболочками (благородные газы) или между
- 71. Координационные числа и многогранники Симметрия кристалла подчиняется принципу Кюри, т.е. симметрия структурных единиц включает симметрию кристалла
- 72. Типы координационных полиэдров
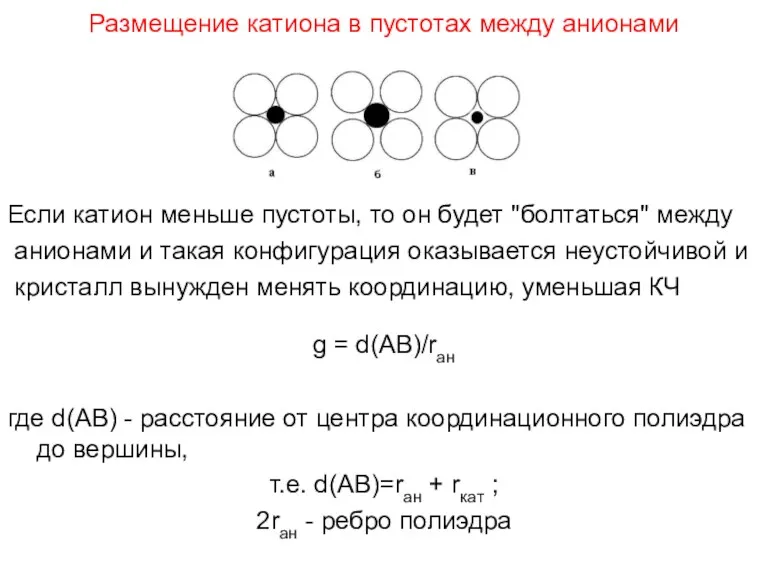
- 73. Размещение катиона в пустотах между анионами Если катион меньше пустоты, то он будет "болтаться" между анионами
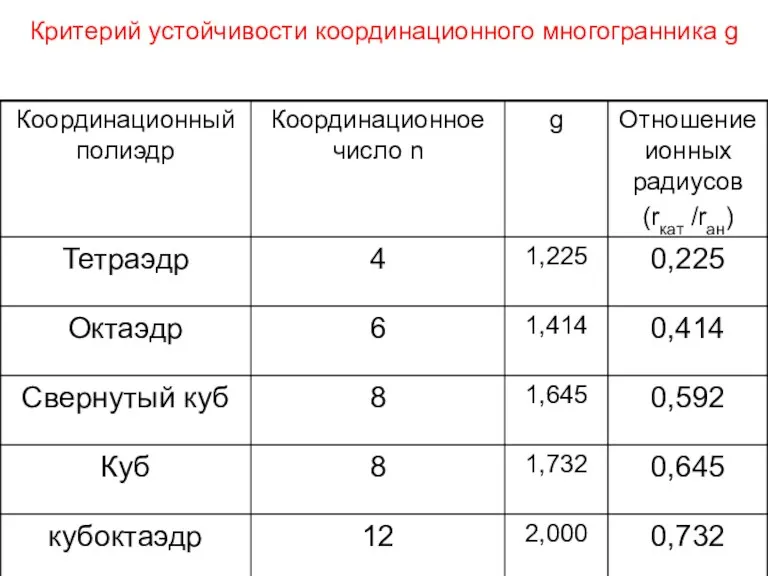
- 74. Критерий устойчивости координационного многогранника g
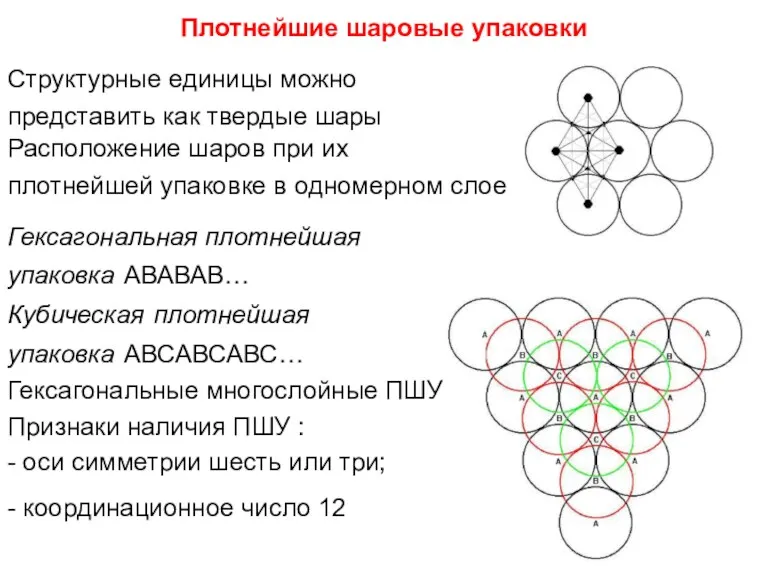
- 75. Плотнейшие шаровые упаковки Структурные единицы можно представить как твердые шары Расположение шаров при их плотнейшей упаковке
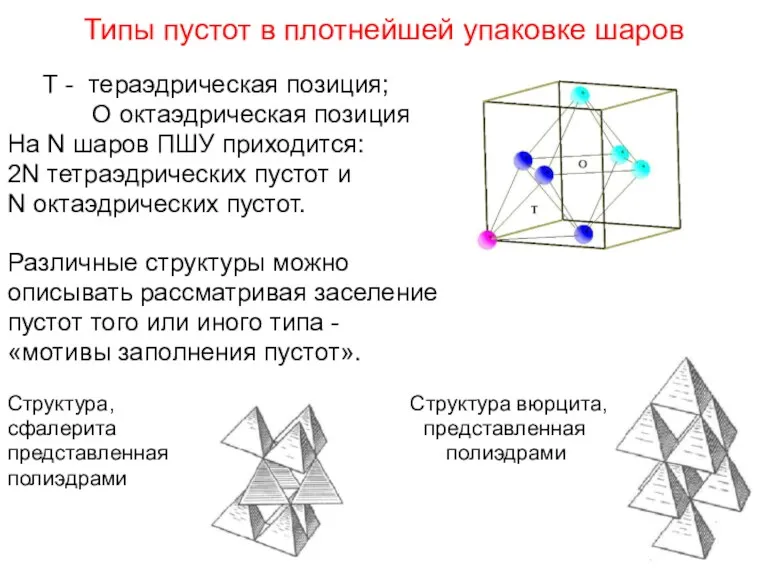
- 76. Типы пустот в плотнейшей упаковке шаров Т - тераэдрическая позиция; О октаэдрическая позиция На N шаров
- 77. Изоморфизм Атомы с одинаковыми валентностями, типом связи, поляризацией с близкими атомными радиусами могут замещать друг друга
- 78. Полиморфизм Способность некоторых веществ существовать в нескольких кристаллических фазах, отличающихся по симметрии структуры и по свойствам.
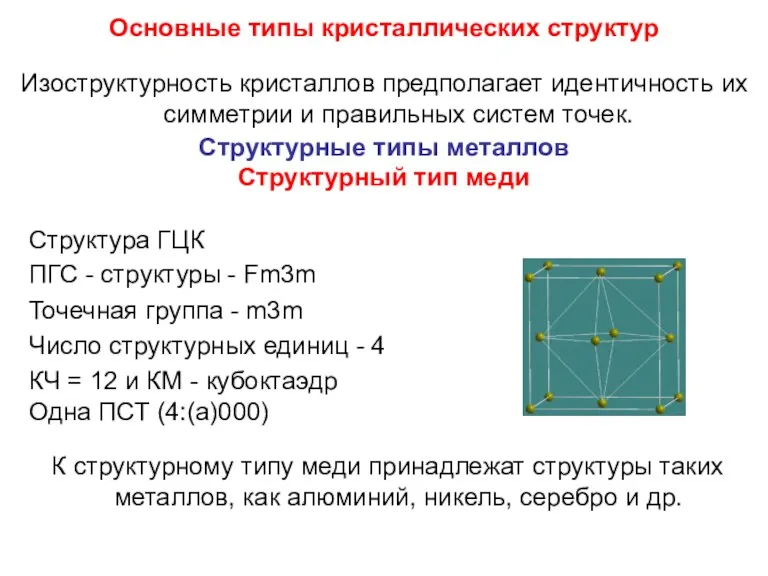
- 79. Основные типы кристаллических структур Изоструктурность кристаллов предполагает идентичность их симметрии и правильных систем точек. Структурные типы
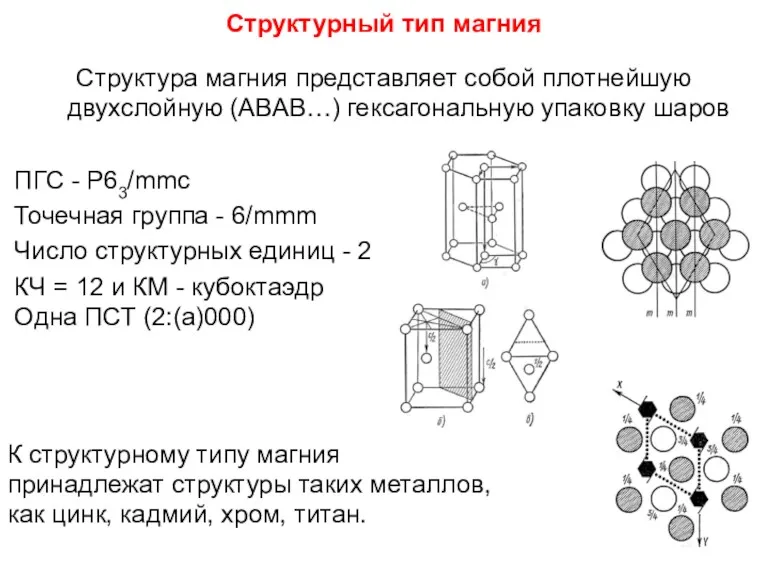
- 80. Структурный тип магния Структура магния представляет собой плотнейшую двухслойную (АВАВ…) гексагональную упаковку шаров ПГС - Р63/mmc
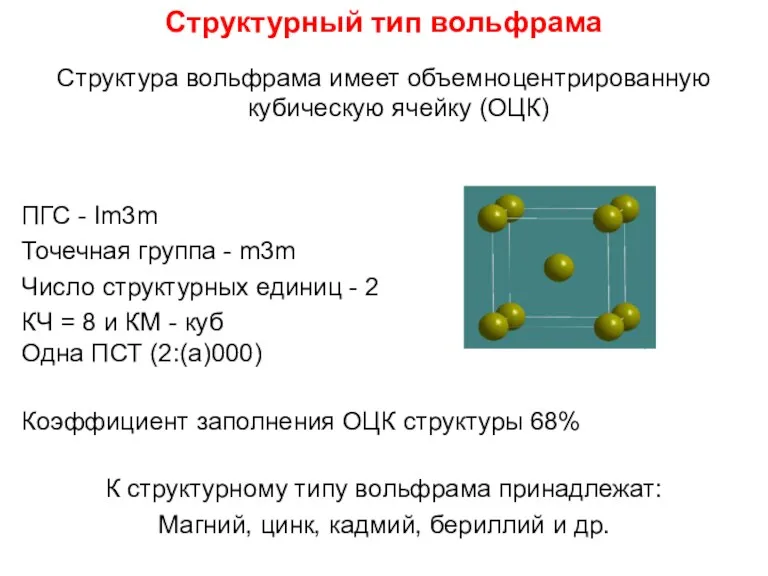
- 81. Структурный тип вольфрама Структура вольфрама имеет объемноцентрированную кубическую ячейку (ОЦК) ПГС - Im3m Точечная группа -
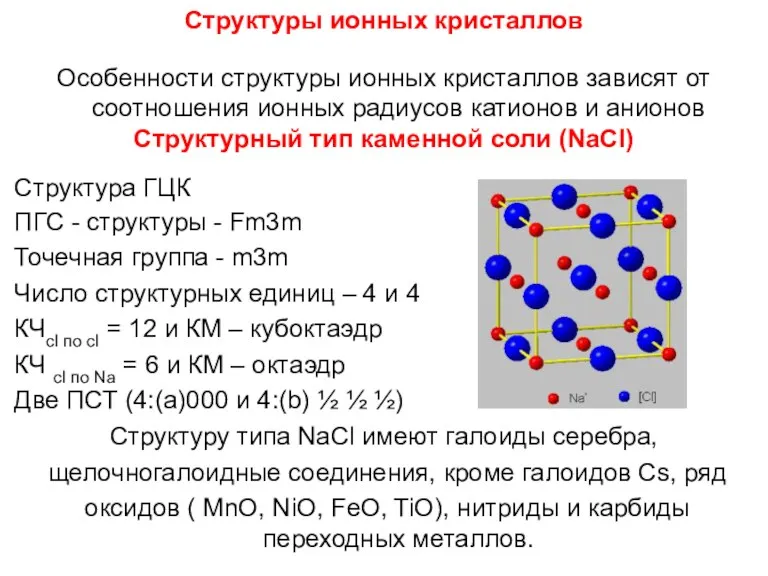
- 82. Структуры ионных кристаллов Особенности структуры ионных кристаллов зависят от соотношения ионных радиусов катионов и анионов Структурный
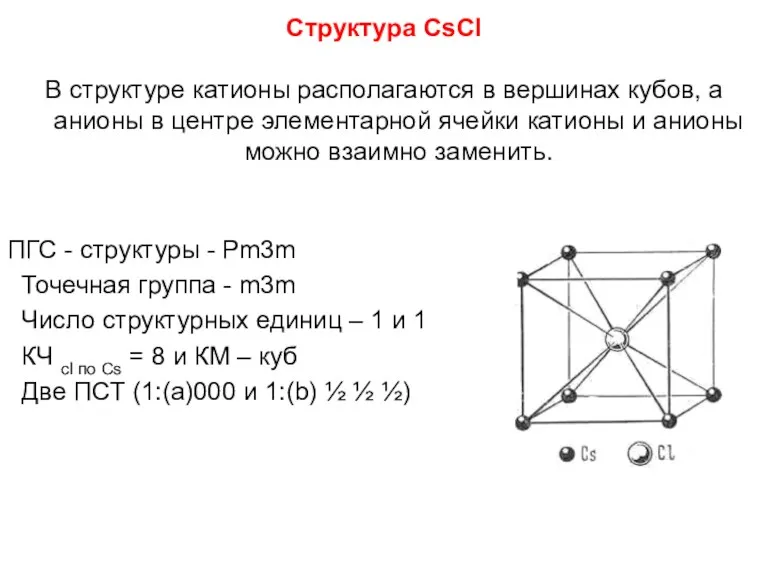
- 83. Структура CsCl В структуре катионы располагаются в вершинах кубов, а анионы в центре элементарной ячейки катионы
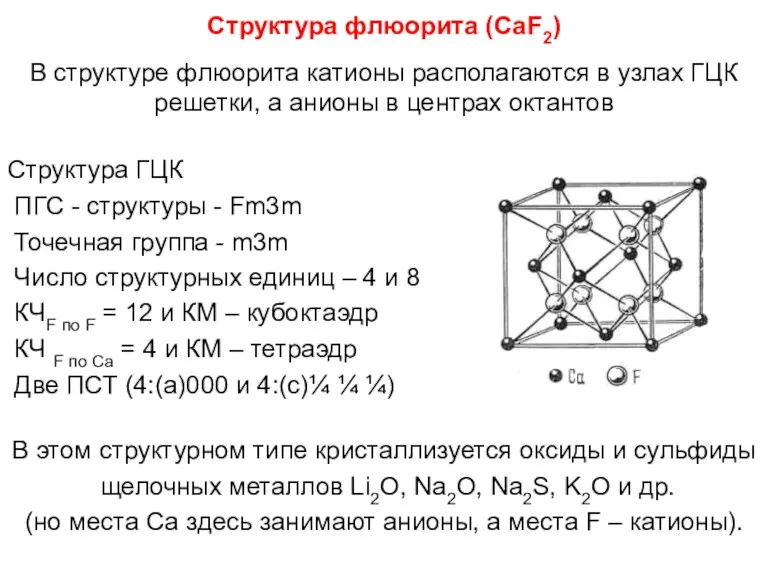
- 84. Структура флюорита (СaF2) В структуре флюорита катионы располагаются в узлах ГЦК решетки, а анионы в центрах
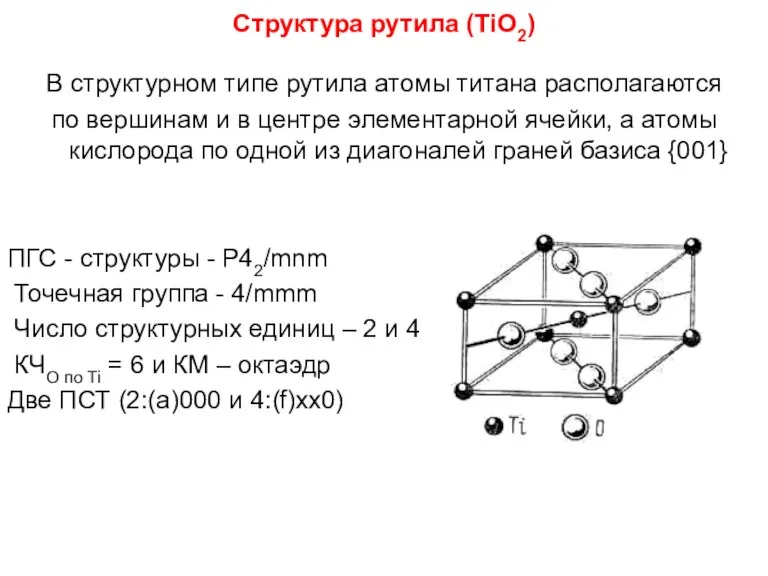
- 85. Структура рутила (TiO2) В структурном типе рутила атомы титана располагаются по вершинам и в центре элементарной
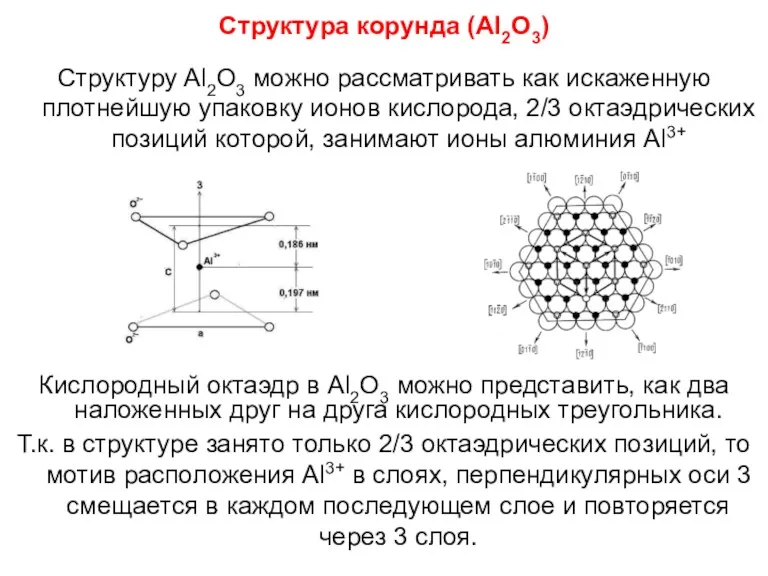
- 86. Структура корунда (Al2O3) Структуру Al2O3 можно рассматривать как искаженную плотнейшую упаковку ионов кислорода, 2/3 октаэдрических позиций
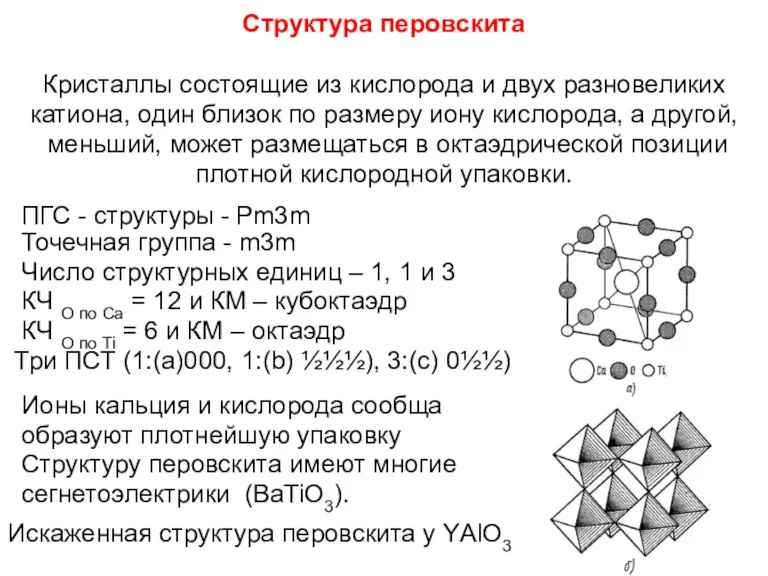
- 87. Структура перовскита Кристаллы состоящие из кислорода и двух разновеликих катиона, один близок по размеру иону кислорода,
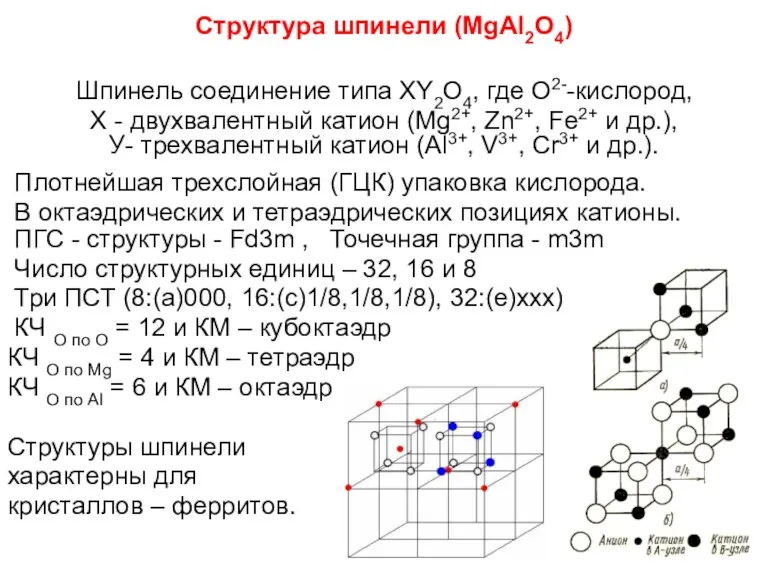
- 88. Структура шпинели (MgAl2О4) Шпинель соединение типа XY2O4, где О2--кислород, Х - двухвалентный катион (Mg2+, Zn2+, Fe2+
- 89. Структура гранатов Естественные гранаты - силикаты с химической формулой М3М2[SiO4]3, где M2+ - Mg, Ca, Mn,
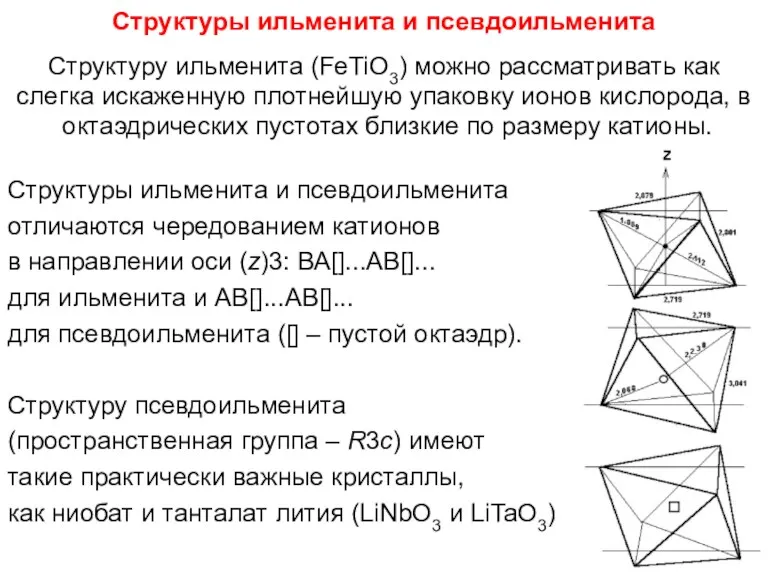
- 90. Структуры ильменита и псевдоильменита Структуру ильменита (FeTiO3) можно рассматривать как слегка искаженную плотнейшую упаковку ионов кислорода,
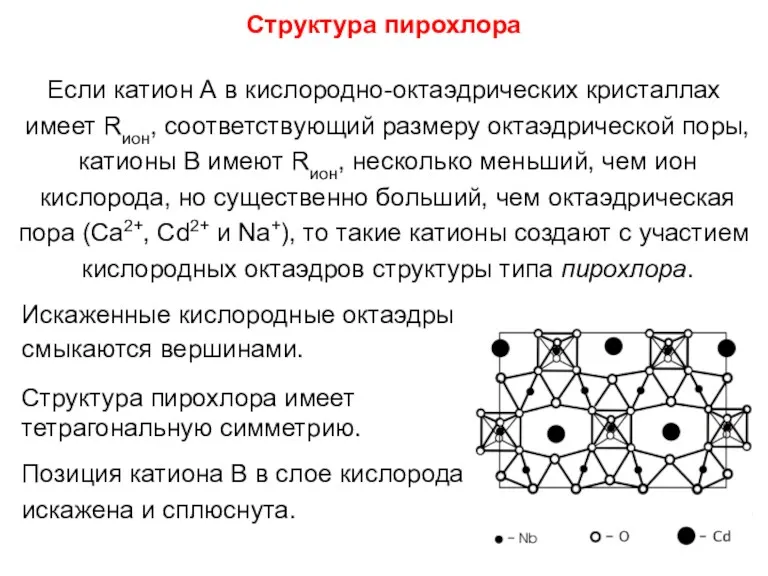
- 91. Структура пирохлора Если катион А в кислородно-октаэдрических кристаллах имеет Rион, соответствующий размеру октаэдрической поры, катионы В
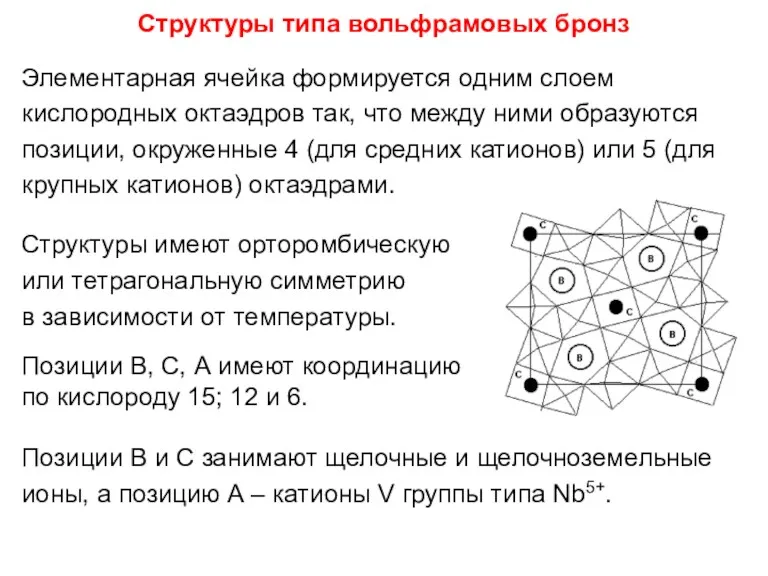
- 92. Структуры типа вольфрамовых бронз Элементарная ячейка формируется одним слоем кислородных октаэдров так, что между ними образуются
- 93. Ковалентные структуры Структура графита При построении ковалентных структур основную роль играет геометрия связей (взаимное направление связей).
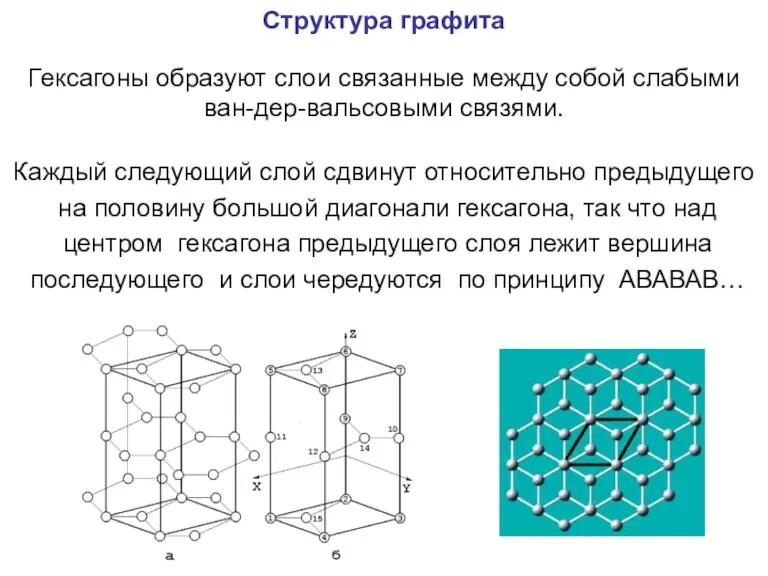
- 94. Структура графита Гексагоны образуют слои связанные между собой слабыми ван-дер-вальсовыми связями. Каждый следующий слой сдвинут относительно
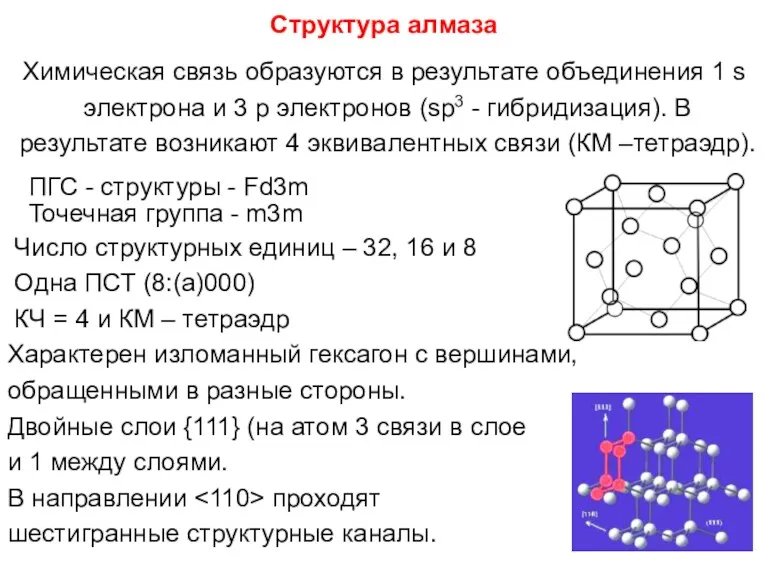
- 95. Структура алмаза Химическая связь образуются в результате объединения 1 s электрона и 3 p электронов (sp3
- 96. Алмазоподобные структуры Алмазоподобными обычно называют структуры : - Каждый атом связан с соседями 4 равноценными связями
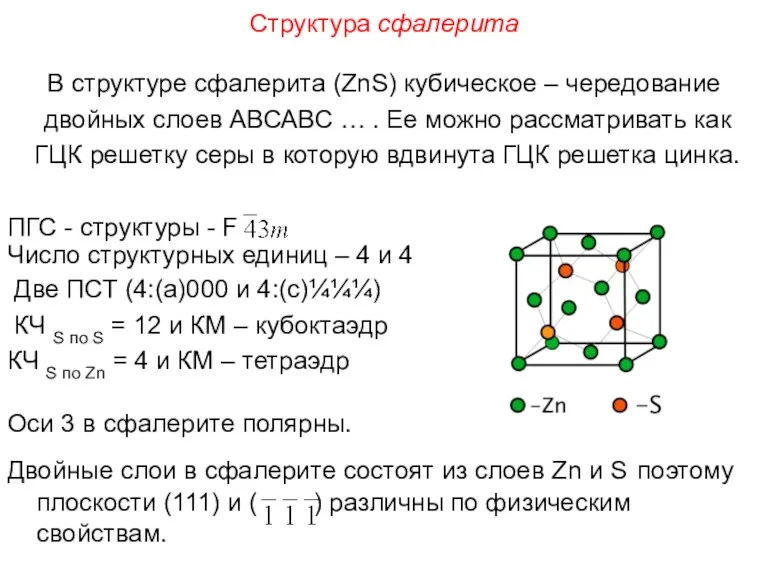
- 97. Структура сфалерита В структуре сфалерита (ZnS) кубическое – чередование двойных слоев АВСАВС … . Ее можно
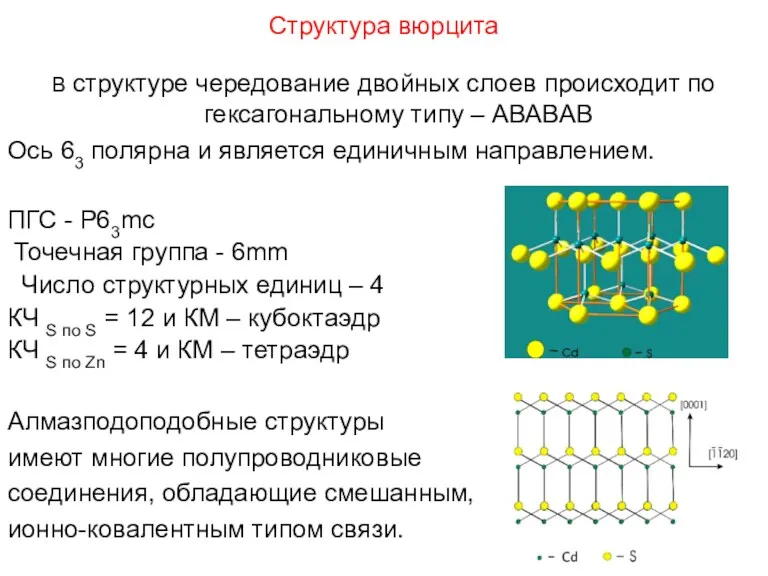
- 98. Структура вюрцита В структуре чередование двойных слоев происходит по гексагональному типу – АВАВАВ Ось 63 полярна
- 99. Дефекты в кристаллах Лекция 9 Классы дефектов в кристаллах по геометрическим признакам: Точечные (нульмерные) дефекты. Размеры
- 100. Понятие о дислокации Дислокация линейный дефект и неравновесный. Изменение свободной энергии, связанное с ее образованием, равно
- 101. Движение дислокации в решетке происходит много легче, чем одновременный сдвиг одной части кристалла относительно другой Дислокация
- 102. Вектор мощности дислокации (b) - вектор Бюргерса, вектор, замыкающий контур Бюргерса, (произвольный замкнутый контур в совершенном
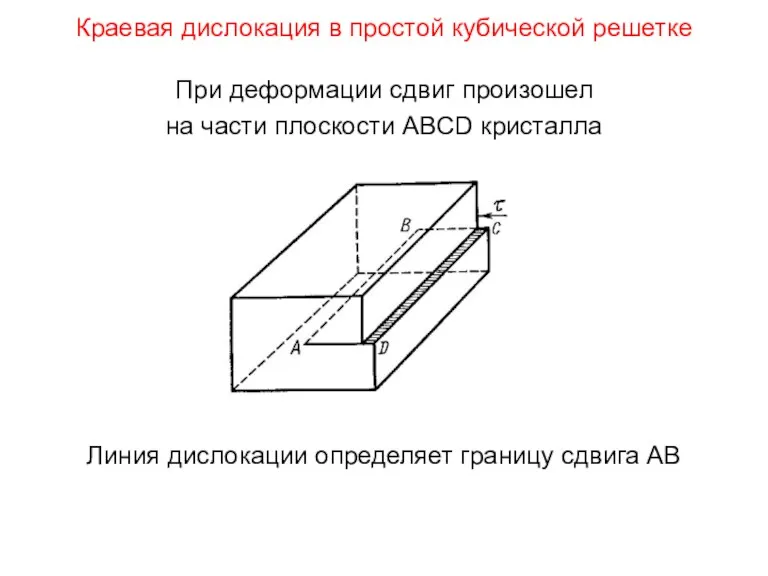
- 103. Краевая дислокация в простой кубической решетке При деформации сдвиг произошел на части плоскости АBCD кристалла Линия
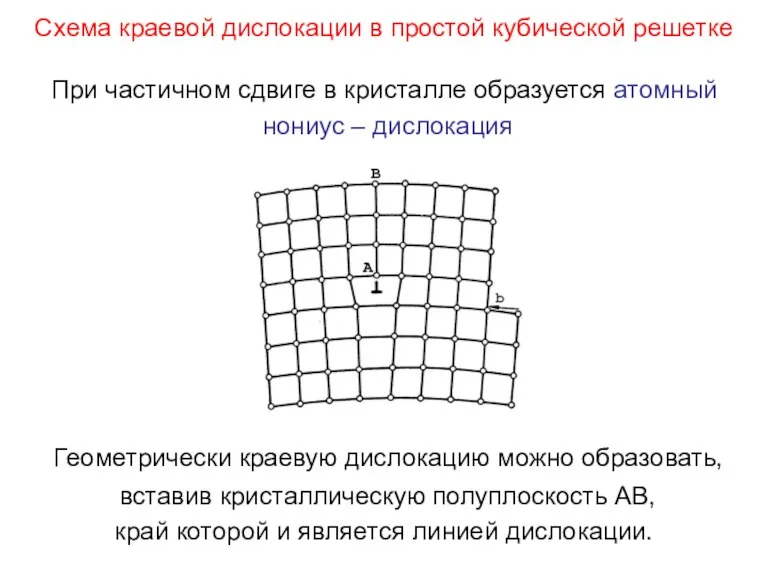
- 104. Схема краевой дислокации в простой кубической решетке При частичном сдвиге в кристалле образуется атомный нониус –
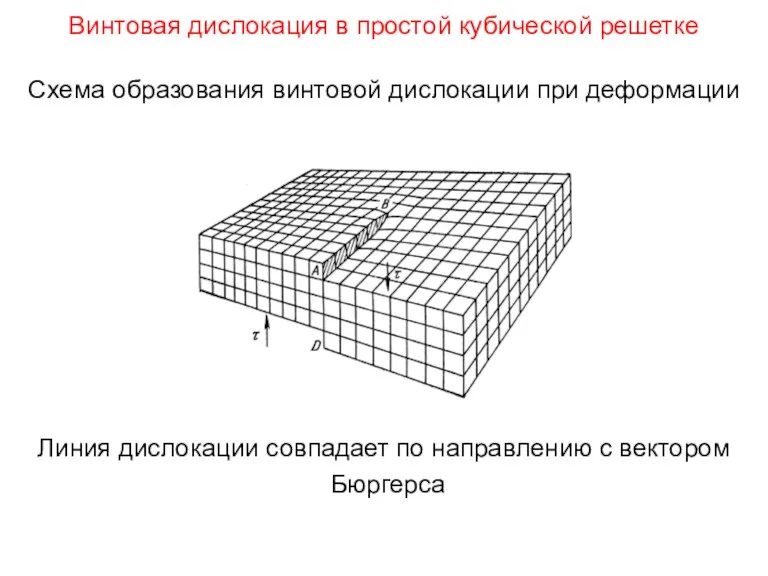
- 105. Винтовая дислокация в простой кубической решетке Схема образования винтовой дислокации при деформации Линия дислокации совпадает по
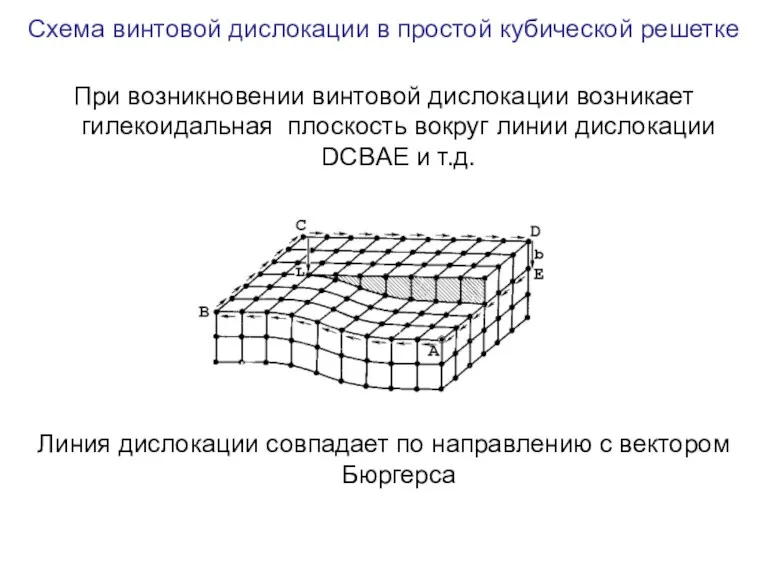
- 106. Схема винтовой дислокации в простой кубической решетке При возникновении винтовой дислокации возникает гилекоидальная плоскость вокруг линии
- 108. Скачать презентацию








![Индицирование кристаллов Индицирование узлов Символ узла - [[mnp]] – совокупность](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/434024/slide-30.jpg)
























![Структура гранатов Естественные гранаты - силикаты с химической формулой М3М2[SiO4]3,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/434024/slide-88.jpg)






 Агрегатное состояние веществ и типы химических связей
Агрегатное состояние веществ и типы химических связей Вода - вещество обычное или необычное
Вода - вещество обычное или необычное Химические реакции
Химические реакции Основания
Основания Галогены. Строение атомов и молекул галогенов
Галогены. Строение атомов и молекул галогенов Химический элемент алюминий
Химический элемент алюминий Ионные уравнения реакций
Ионные уравнения реакций Термический анализ
Термический анализ Формирование ключевых компетенций на уроках химии
Формирование ключевых компетенций на уроках химии Приготовление растворов солей с определенной массовой долей растворенного вещества
Приготовление растворов солей с определенной массовой долей растворенного вещества Растворы. Термодинамическая теория растворов
Растворы. Термодинамическая теория растворов Типы химических реакций
Типы химических реакций Химические формулы
Химические формулы Галогены
Галогены проект по биологииНаучно-исследовательская работа
проект по биологииНаучно-исследовательская работа Химия в косметологии
Химия в косметологии Беломорская соль, проектная работа
Беломорская соль, проектная работа Циклоалканы
Циклоалканы Щелочноземельные металлы
Щелочноземельные металлы Распространение водорода в природе. Получение в лаболатории
Распространение водорода в природе. Получение в лаболатории Элементы теории горения
Элементы теории горения Кислоты, содержащие серу (S)
Кислоты, содержащие серу (S) Гетерофункциональные соединения, участвующие в процессах жизнедеятельности
Гетерофункциональные соединения, участвующие в процессах жизнедеятельности Композиционные материалы – материалы будущего
Композиционные материалы – материалы будущего Неорганические полимеры
Неорганические полимеры Первичная структура, идентификация белка. Масс-спектрометрия
Первичная структура, идентификация белка. Масс-спектрометрия Кристаллические решетки
Кристаллические решетки Циклические углеводороды. Циклоалканы
Циклические углеводороды. Циклоалканы