Содержание
- 2. Галогены
- 3. Задачи урока: 1.Систематизировать и углубить знания о галогенах на основании сравнительной характеристики. 2.Ознакомиться с окислительными свойствами
- 4. План урока: 1.Определить положение галогенов в ПСХЭ. 2.Рассмотреть строение атомов и молекул галогенов. 3.Физические свойства простых
- 5. Проверка домашнего задания: тестирование выписать номера свойств и характеристик для (1 варианта) металлов, для (2 варианта)
- 6. 1.Маленький радиус атомов 2.Большой радиус атомов 3.На внешнем уровне от 1 до 3 электронов 4.На внешнем
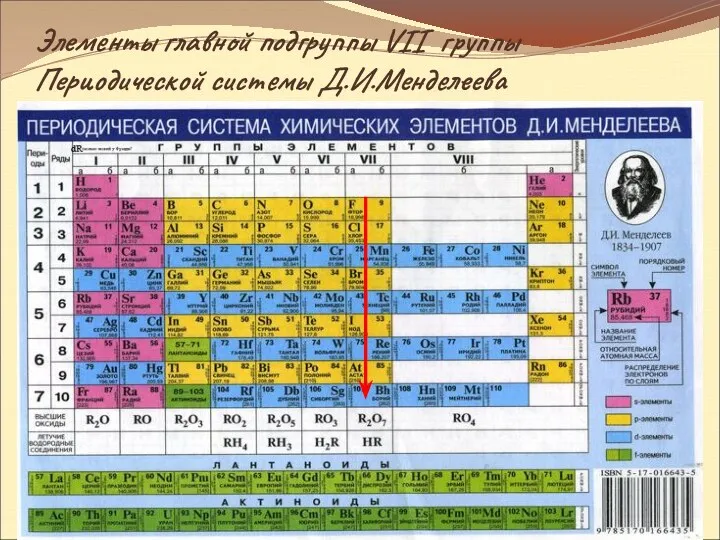
- 7. Элементы главной подгруппы VII группы Периодической системы Д.И.Менделеева
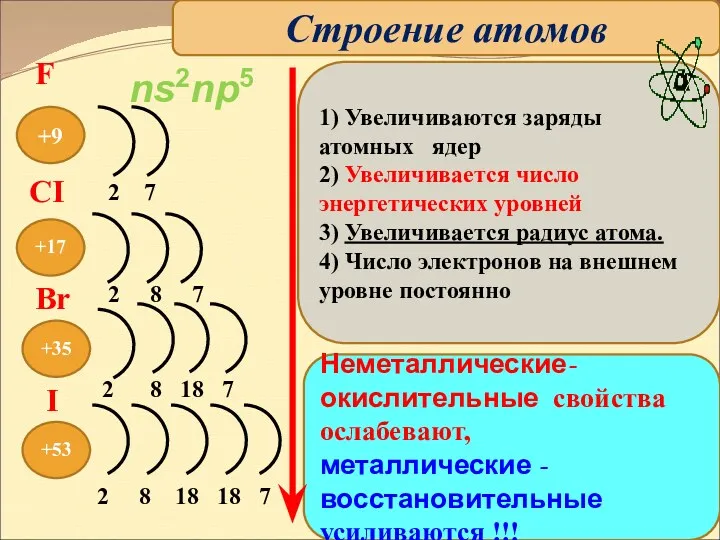
- 8. +9 +53 +35 +17 Неметаллические-окислительные свойства ослабевают, металлические -восстановительные усиливаются !!! 2 7 2 8 7
- 9. Строение атомов галогенов На внешнем энергетическом уровне по 7 электронов. Малый радиус атома (в сравнении с
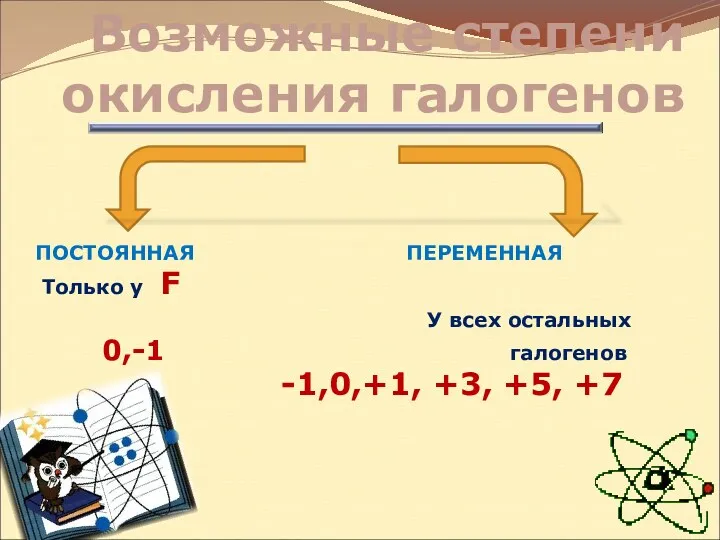
- 10. Возможные степени окисления галогенов ПОСТОЯННАЯ ПЕРЕМЕННАЯ Только у F У всех остальных 0,-1 галогенов -1,0,+1, +3,
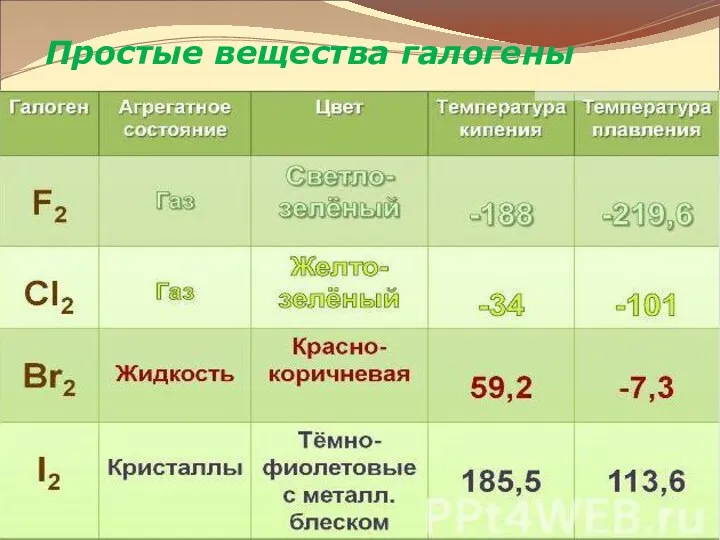
- 11. Простые вещества галогены
- 12. Простые вещества галогены Молекулы галогенов состоят из двух атомов F2 Cl2 Br2 I2 Тип химической связи
- 13. Простые вещества галогены
- 14. История открытия Карл Вильгельм Шееле Английский поэт Уилфред Оуэн, погибший в сражениях Первой мировой войны, оставил
- 15. История открытия Антуан Жером Балар (1802 – 1876) "Бром" по-гречески "зловонный" (Очень "миленькое" имя!), Да ещё
- 16. История открытия Открыт в 1811г Йод красой своей гордился, Твердым был, но испарился. Фиолетовый, как ночь,
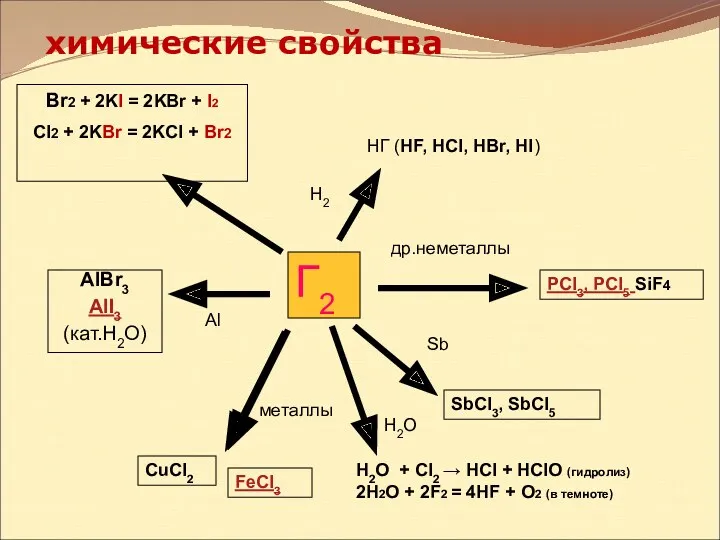
- 17. Химические свойства Галогены очень сильные окислители. Фтор в химической реакции проявляет только окислительные свойства. Хлор, бром,
- 18. химические свойства Г2 Br2 + 2KI = 2KBr + I2 CI2 + 2KBr = 2KCI +
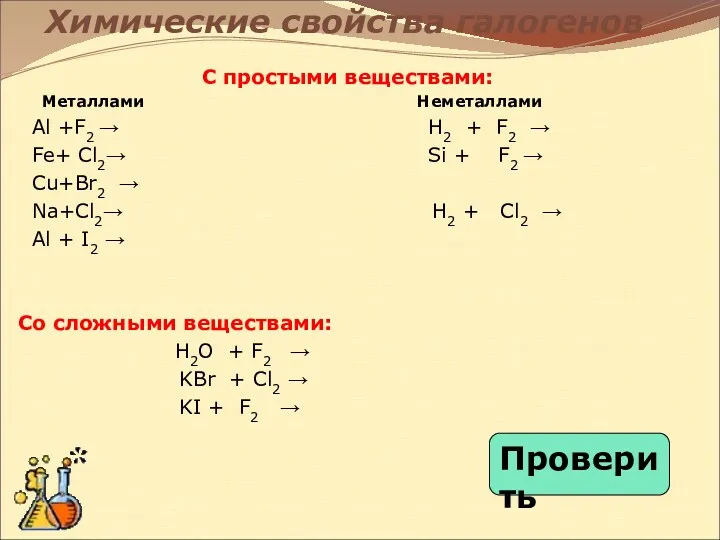
- 19. Химические свойства галогенов С простыми веществами: Металлами Неметаллами Al +F2 → H2 + F2 → Fe+
- 20. Химические свойства С простыми веществами: Металлами Неметаллами 2Al + 3F2 → 2AlF3 H2 + F2 →
- 21. Галогены в природе Флюорит – CaF2
- 22. История открытия «Фторос» - разрушающий Открыт в 1866г. Анри Муассан Самый активный, самый электроотрицательный, самый реакционноспособный,
- 23. История открытия Второй после технеция элемент. Получен в 1940 г. американскими учеными Т. (Д.) Корсоном, У.
- 24. «Все есть яд и все есть лекарство. Только доза делает лекарство ядом, яд лекарством». Парацельс. Биологическое
- 25. Хлор взаимодействует со всеми веществами ряда: Zn, КF, H2 Al, КI, H2 Cu, O2, NaBr O2,
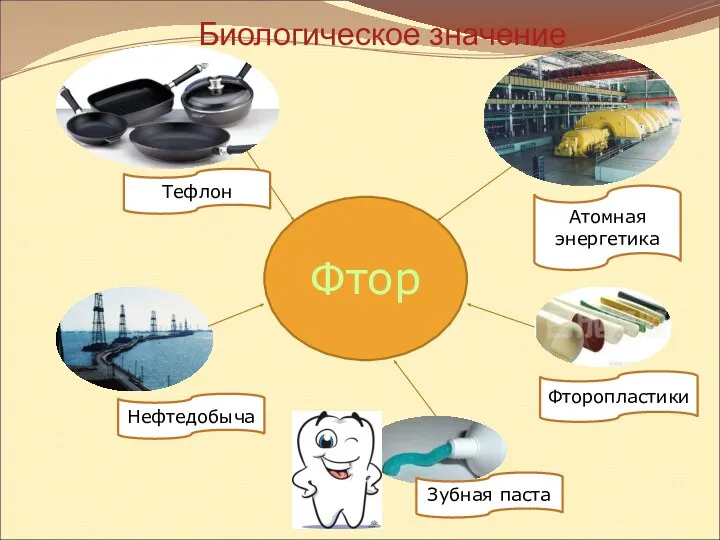
- 29. Фтор Тефлон Нефтедобыча Зубная паста Фторопластики Атомная энергетика Биологическое значение
- 30. Хлор Отбеливатели Пестициды Хлорирование воды Синтетический каучук Растворители Пластмассы Лекарства
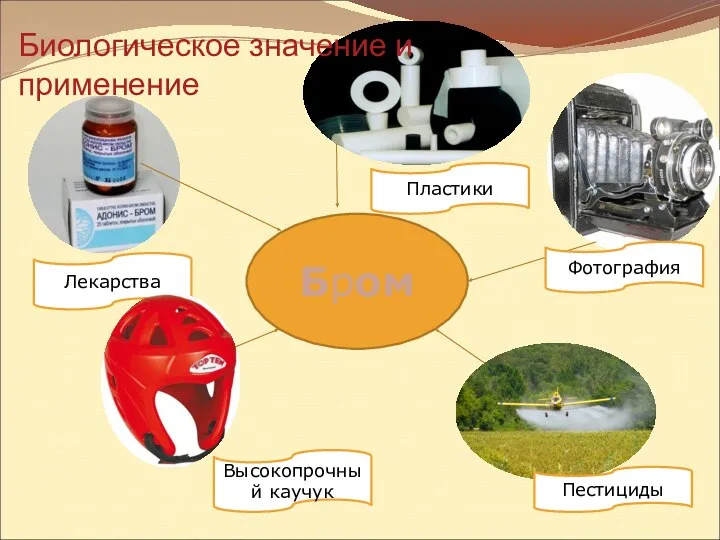
- 31. Бром Лекарства Высокопрочный каучук Фотография Пластики Пестициды Биологическое значение и применение
- 32. №1 Из перечисленных химических элементов наибольший радиус у атома: А) йода Б) брома В) фтора Г)
- 33. Правильные ответы на тест: А) Б) Б) В) В)
- 34. Какой объем хлора (н.у.) потребуется для вытеснения всего иода из 200г 16.6%-ного раствора иодида калия. А.
- 35. Вывод: В 7 группе главной подгруппе у атомов галогенов увеличивается радиус атома, ослабевает окислительная способность и
- 36. Вопросы для закрепления материала: Галогенами называют элементы ... подгруппы. 2. Внешний энергетический уровень атомов галогенов содержит
- 37. Домашнее задание: параграф 22 задача№6 Изучили мы отменно элементы галогены (А по-русски - солероды), Все –
- 38. СПАСИБО ЗА ВНИМАНИЕ!!!
- 40. Скачать презентацию



























 Лекция 15. Аминокислоты
Лекция 15. Аминокислоты Наглядное пособие Динамические модели. Химическое равновесие в растворах
Наглядное пособие Динамические модели. Химическое равновесие в растворах Содержание кислорода и углекислого газа в помещениях школы
Содержание кислорода и углекислого газа в помещениях школы Основные классы неорганических соединений
Основные классы неорганических соединений Жуғыш заттар және жуғыш әсері. 2 Лекция
Жуғыш заттар және жуғыш әсері. 2 Лекция Основания. Классификация оснований
Основания. Классификация оснований Минералы и горные породы
Минералы и горные породы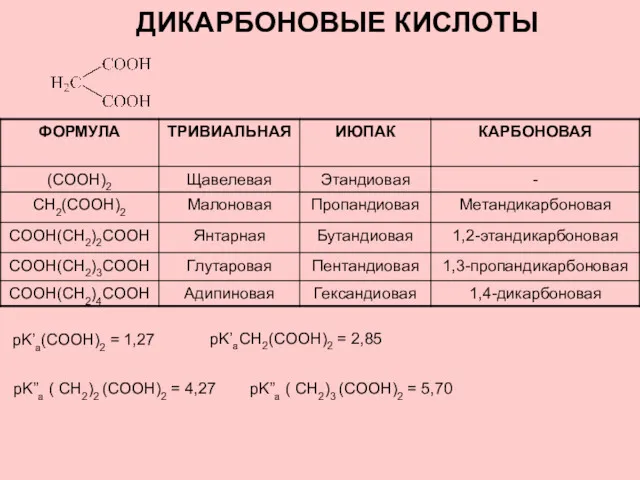 Дикарбоновые кислоты
Дикарбоновые кислоты Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Химико-аналитический контроль. Основы химико-аналитического контроля товаров
Химико-аналитический контроль. Основы химико-аналитического контроля товаров Коррозионная стойкость и повышение долговечности полимерных строительных материалов
Коррозионная стойкость и повышение долговечности полимерных строительных материалов Кислородные соединения азота
Кислородные соединения азота Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги
Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева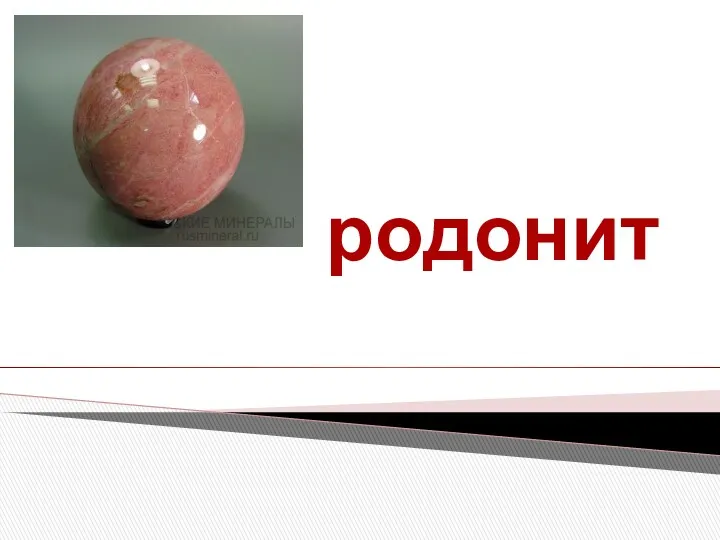 Минерал родонит. Месторождения
Минерал родонит. Месторождения Простые вещества – неметаллы
Простые вещества – неметаллы Углеводы (сахариды)
Углеводы (сахариды) Металлическая связь. Агрегатные состояния вещества
Металлическая связь. Агрегатные состояния вещества Соли (12 класс)
Соли (12 класс) 20230306_gidroliz
20230306_gidroliz Арены. Бензол и его гомологи. Химия. 10 класс
Арены. Бензол и его гомологи. Химия. 10 класс Хімічні явища в побуті
Хімічні явища в побуті Соли
Соли Классификации, номенклатура, строение и свойства органических соединений
Классификации, номенклатура, строение и свойства органических соединений Ароматические углеводороды. 10 класс
Ароматические углеводороды. 10 класс Азотные удобрения
Азотные удобрения Простые вещества - неметаллы. 8 класс
Простые вещества - неметаллы. 8 класс Волокна. Классификация волокон
Волокна. Классификация волокон