Содержание
- 2. Оксиды азота. Азот образует шесть кислородных соединений. степени окисления +1 N2O +2 NO +3 N2O3 +4
- 3. Получение: NH4NO = N2O +2H2O Химические свойства: 1. разложение при нагревании 2N2+1O = 2N20+O2 2. с
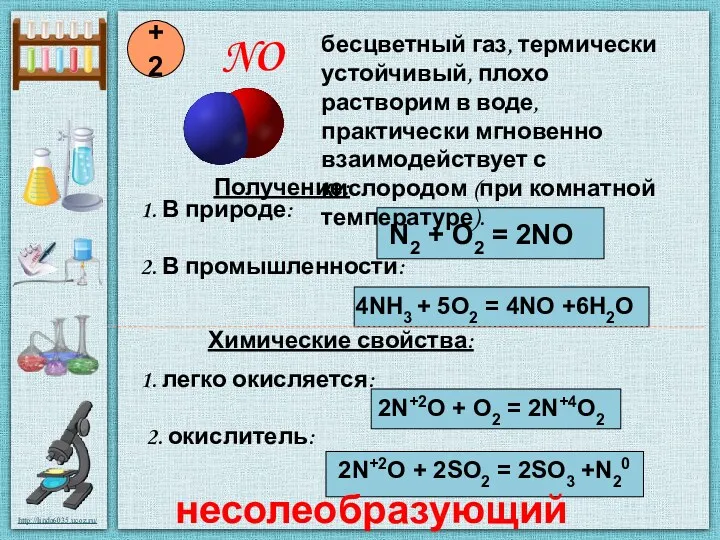
- 4. NO +2 Получение: 1. В природе: N2 + O2 = 2NO 2. В промышленности: 4NH3 +
- 5. N2O3 +3 Химические свойства: NO2 + NO N2O3 Получение: ВСЕ свойства кислотных оксидов. кислотный оксид жидкость
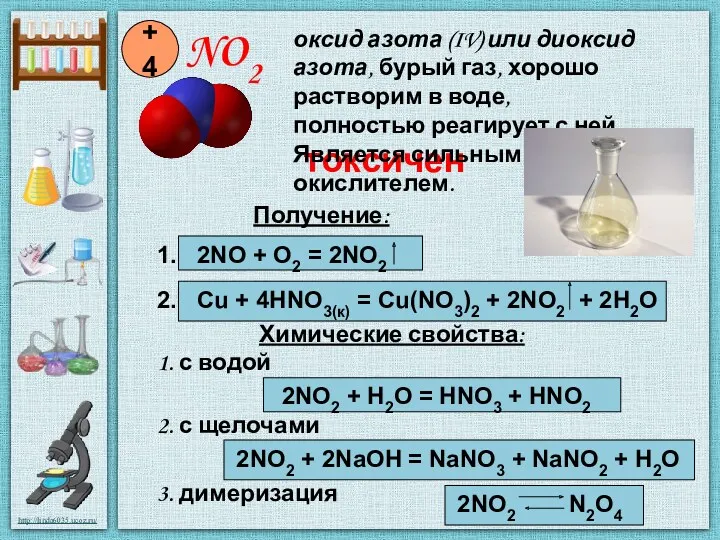
- 6. NO2 +4 Получение: 1. 2NO + O2 = 2NO2 2. Cu + 4HNO3(к) = Cu(NO3)2 +
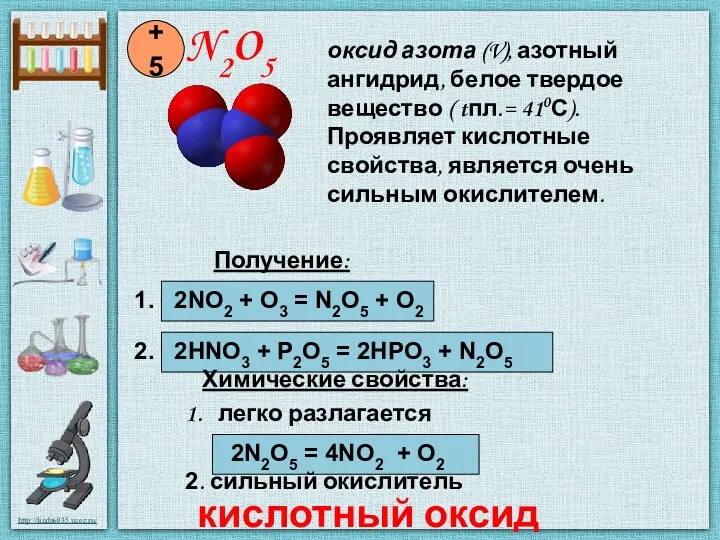
- 7. N2O5 +5 Получение: 1. 2NO2 + O3 = N2O5 + O2 2. 2HNO3 + P2O5 =
- 8. HNO3 Состав. Строение. Свойства. H O N O O — — степень окисления азота валентность азота
- 9. Азотная кислота (HNO3) Классификация по: наличию кислорода: основности: растворимости в воде: летучести: степени электролитической диссоциации: кислородсодержащая
- 10. Получение азотной кислоты в промышленности NH3 NO NO2 HNO3 4NH3+ 5O2 = 4NO + 6H2O 2NO+O2
- 11. В лаборатории азотную кислоту получают действием концентрированной серной кислоты на нитраты при слабом нагревании. NaNO3 +
- 12. Химические свойства азотной кислоты Азотная кислота проявляет все типичные свойства кислот. 1. Свойства HNO3 как электролита:
- 13. 2. Окислительные свойства: особенности взаимодействия с металлами: (азотная кислота никогда не выделяет водород!) Me + HNO3
- 14. С металлами, стоящими в ряду напряжений левее водорода: С металлами, стоящими в ряду напряжений правее водорода:
- 15. 2. Окислительные свойства 2) Особенности взаимодействия с неметаллами (S, P, C): 3) Взаимодействует с органическими веществами
- 16. Применение азотной кислоты 1 5 4 6 2 3 Производство азотных и комплексных удобрений. Производство взрывчатых
- 17. Нитраты – соли азотной кислоты, получают при действии кислоты на металлы, их оксиды и гидроксиды. Селитры
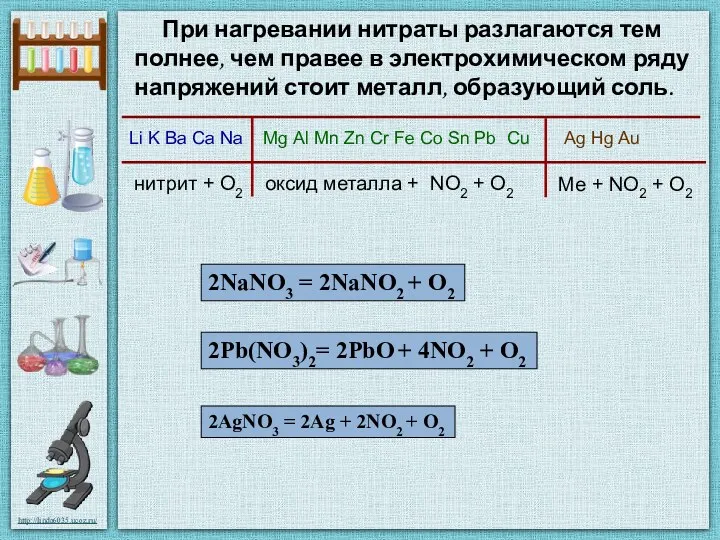
- 18. При нагревании нитраты разлагаются тем полнее, чем правее в электрохимическом ряду напряжений стоит металл, образующий соль.
- 20. Скачать презентацию













 Химия в повседневной жизни человека
Химия в повседневной жизни человека Химические тест-методы анализа экологических проб. Лекция 6
Химические тест-методы анализа экологических проб. Лекция 6 Значення хімічних процесів у природі
Значення хімічних процесів у природі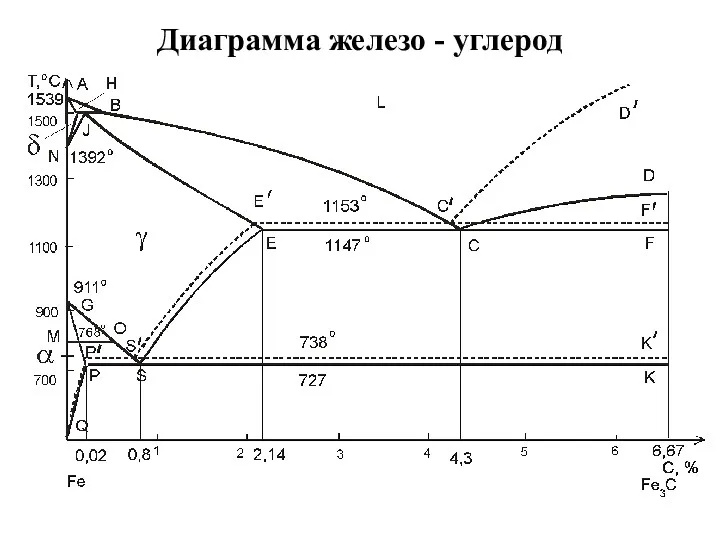 Диаграмма железо - углерод
Диаграмма железо - углерод 36fd4612109c46a6a8f3b83635fe0e02
36fd4612109c46a6a8f3b83635fe0e02 Основы химического равновесия
Основы химического равновесия Природные источники углеводородов и их переработка
Природные источники углеводородов и их переработка Основные классы неорганических соединений
Основные классы неорганических соединений Спирты, фенолы, простые эфиры и их тиоаналоги. (Лекция 9)
Спирты, фенолы, простые эфиры и их тиоаналоги. (Лекция 9) Що ховається за цифрами? Харчові домішки
Що ховається за цифрами? Харчові домішки Характеристика хімічного елемента Hg
Характеристика хімічного елемента Hg Теоретические основы химической технологии переработки природных энергоносителей и углеводородных материалов
Теоретические основы химической технологии переработки природных энергоносителей и углеводородных материалов Непредельные углеводороды. Алкины
Непредельные углеводороды. Алкины Centrifugal Ultrafiltration Devices
Centrifugal Ultrafiltration Devices Химический элемент и вещество
Химический элемент и вещество Номенклатура органических соединений
Номенклатура органических соединений Хром, марганец
Хром, марганец Классификация химических реакций в неорганической химии
Классификация химических реакций в неорганической химии Managing chemicals. Green chemistry for every laboratory
Managing chemicals. Green chemistry for every laboratory Химиядан сұрақтар
Химиядан сұрақтар Металлы. Металлы главной подгруппы
Металлы. Металлы главной подгруппы Цепные химические реакции
Цепные химические реакции Химическая термодинамика. Лекция 3
Химическая термодинамика. Лекция 3 Витаминные препараты
Витаминные препараты Водород
Водород Электролитическая диссоциация
Электролитическая диссоциация Периодический закон и периодическая система химических элементов
Периодический закон и периодическая система химических элементов Введение в химию. 8 класс
Введение в химию. 8 класс