Содержание
- 2. раздел химии, изучающий энергетику химических и фазовых превращений, направление протекания процессов в физико-химических системах, химические и
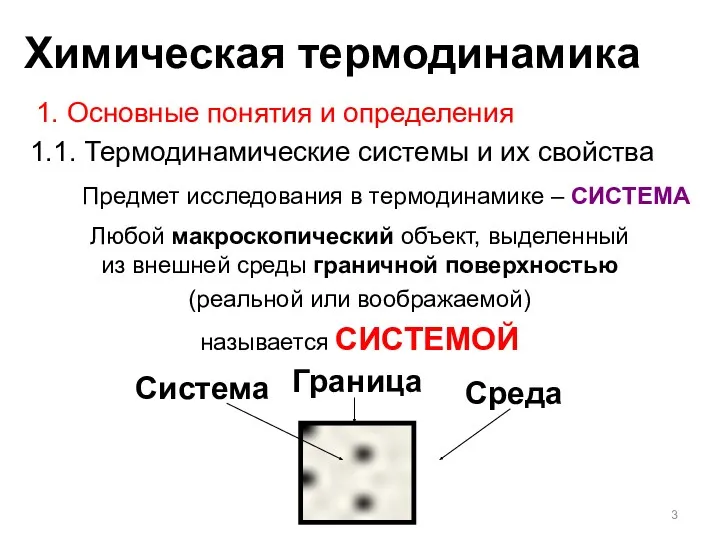
- 3. Предмет исследования в термодинамике – СИСТЕМА Граница Любой макроскопический объект, выделенный из внешней среды граничной поверхностью
- 4. Гомогенные Интенсивные свойства одинаковы во всех частях системы Хотя бы некоторые интенсивные свойства в пределах системы
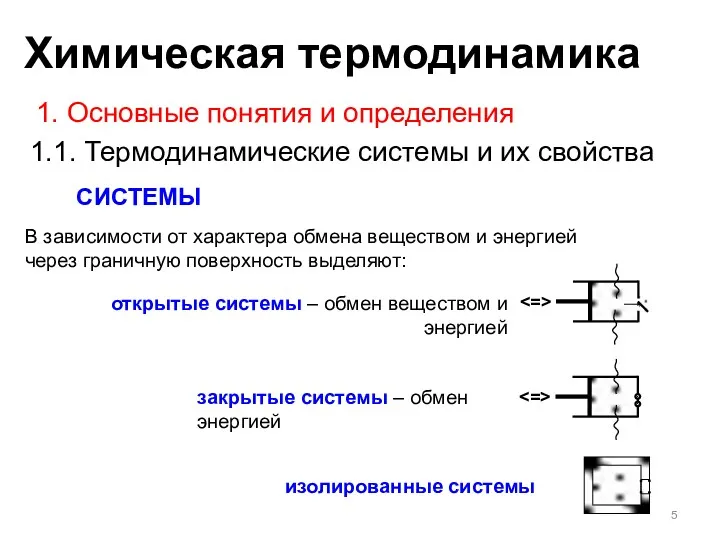
- 5. СИСТЕМЫ 1. Основные понятия и определения 1.1. Термодинамические системы и их свойства открытые системы – обмен
- 6. 1. Основные понятия и определения 1.1. Термодинамические системы и их свойства Термодинамические свойства – любые свойства,
- 7. Интенсивные свойства имеют определенное значение в каждой точке системы Примеры интенсивных свойств: давление, концентрация, температура, …
- 8. В гомогенных системах совокупность интенсивных термодинамических свойств характеризует термодинамическое состояние системы Для обозначения термодинамического состояния вещества
- 9. Термодинамические переменные – это величины, количественно выражающие термодинамические свойства Все термодинамические свойства связаны друг с другом
- 10. Набор независимых переменных задает термодинамическое состояние системы В отличие от состояния вещества (фазы) для описания состояния
- 11. 1. Основные понятия и определения 1.3. Термодинамические процессы Работа – упорядоченная (макрофизическая) форма передачи энергии от
- 12. Существует аддитивная функция состояния термодинамической системы – внутренняя энергия (U), такая что мерой изменения внутренней энергии
- 13. Понятие энергии Абсолютное значение внутренней энергии нельзя измерить и рассчитать В термодинамике обычно выбирают какой-то исходный
- 14. 2. Законы термодинамики 2.1.1. Энтальпия и Теплоемкость энтальпия - внутреннее теплосодержание термодинамической системы В изобарном процессе
- 15. Закон Гесса (основной закон термохимии) Химические превращения веществ, происходящие при постоянстве всех рабочих координат, либо при
- 16. Первое следствие из Закона Гесса Тепловой эффект реакции равен разности между суммой теплот горения исходных веществ
- 17. Стандартные состояния (состояния сравнения) Если не оговорено особо, то обычно за стандартное состояние вещества выбирают его
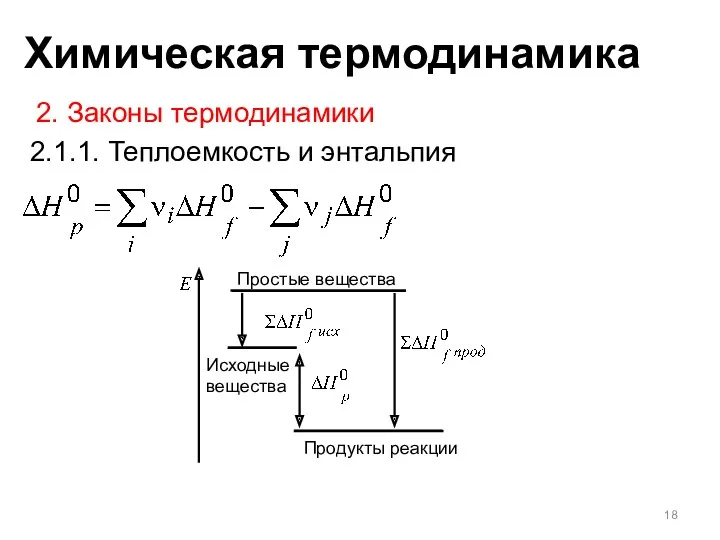
- 18. 2. Законы термодинамики 2.1.1. Теплоемкость и энтальпия Простые вещества Продукты реакции Исходные вещества Химическая термодинамика
- 19. При поглощении тепла веществом его температура, как правило, увеличивается Теплоемкость зависит от пути процесса, т.е. является
- 20. 2. Законы термодинамики 2.1.1. Теплоемкость и энтальпия Химическая термодинамика
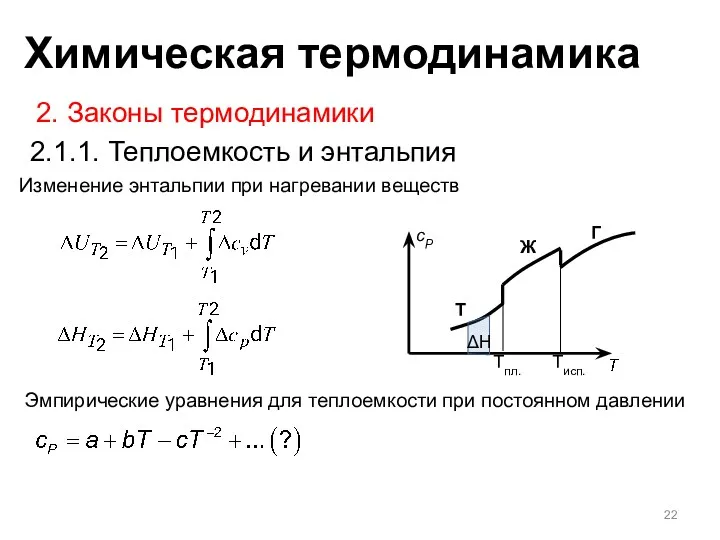
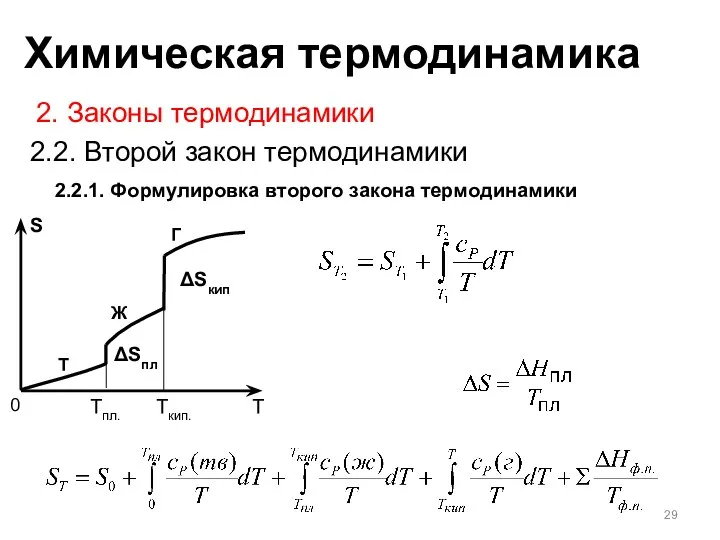
- 21. Изменение энтальпии при нагревании веществ T Ж Г Tпл. Tисп. Изменение энтальпии без изменения температуры (плавление,
- 22. Изменение энтальпии при нагревании веществ 2. Законы термодинамики 2.1.1. Теплоемкость и энтальпия Эмпирические уравнения для теплоемкости
- 23. Первый закон термодинамики утверждает, что в системах вообще говоря могут протекать любые процессы, в которых энергия
- 24. Существует аддитивная функция состояния термодинамической системы – энтропия. При обратимых процессах в адиабатически изолированной системе энтропия
- 25. 2.2.1. Формулировка второго закона термодинамики 2. Законы термодинамики 2.2. Второй закон термодинамики Энтропия определяется термодинамической вероятностью:
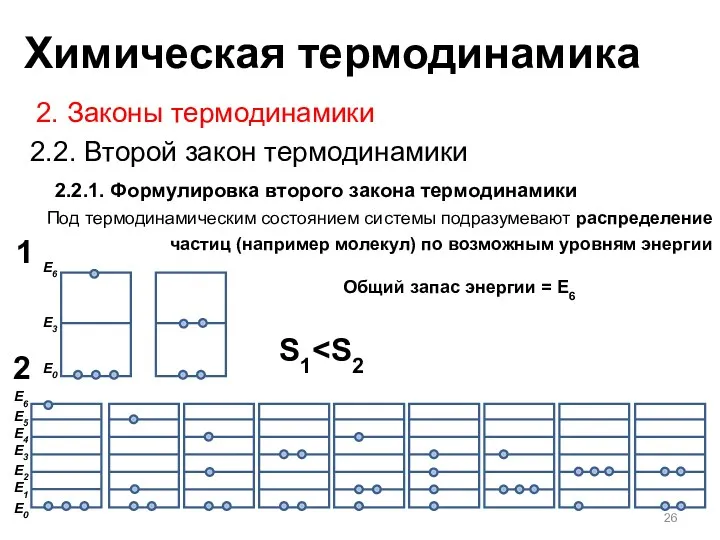
- 26. 2.2.1. Формулировка второго закона термодинамики 2. Законы термодинамики 2.2. Второй закон термодинамики Под термодинамическим состоянием системы
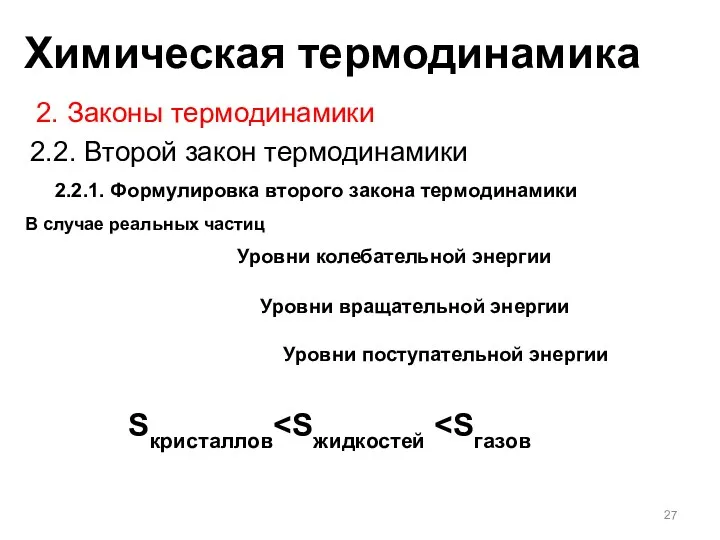
- 27. 2.2.1. Формулировка второго закона термодинамики 2. Законы термодинамики 2.2. Второй закон термодинамики В случае реальных частиц
- 28. 2.2.1. Формулировка второго закона термодинамики 2. Законы термодинамики 2.2. Второй закон термодинамики Энтропия идеального кристалла индивидуального
- 29. 2.2.1. Формулировка второго закона термодинамики 2. Законы термодинамики 2.2. Второй закон термодинамики T Ж Г Tпл.
- 30. 2.2.1. Формулировка второго закона термодинамики 2. Законы термодинамики 2.2. Второй закон термодинамики Во многих случаях изменение
- 31. 2.2.1. Формулировка второго закона термодинамики 2. Законы термодинамики 2.2. Второй закон термодинамики Второе начало термодинамики регламентирует
- 32. 3. Критерии самопроизвольного протекания процесса 3.1. Энергии Гиббса и Гельмгольца Любая система стремится к минимуму энтальпии
- 33. 3. Критерии самопроизвольного протекания процесса 3.1. Энергии Гиббса и Гельмгольца G ≡ H-TS Новая функция, связывающая
- 34. 3. Критерии самопроизвольного протекания процесса 3.1. Энергии Гиббса и Гельмгольца F ≡ U-TS – энергия Гельмгольца
- 35. 3. Критерии самопроизвольного протекания процесса 3.1. Энергии Гиббса и Гельмгольца Критерии самопроизвольного протекания процесса Химическая термодинамика
- 36. 4. Зависимость изменения энергии Гиббса от реальных условий При изменении давления энергия Гиббса меняется следующим образом
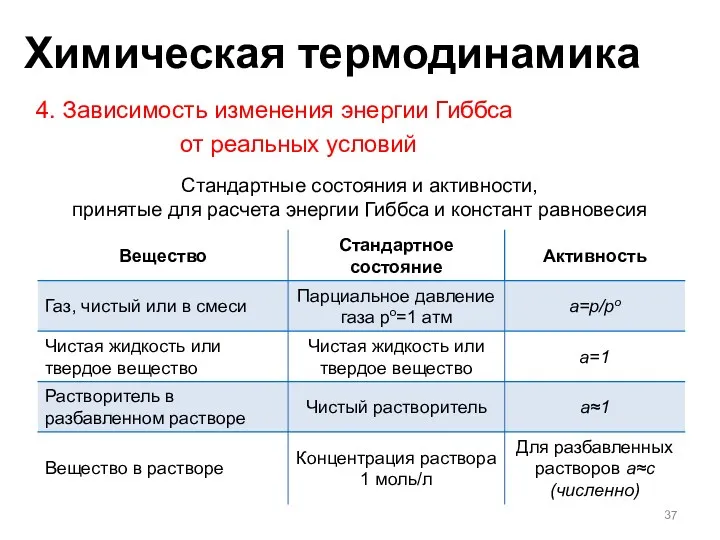
- 37. 4. Зависимость изменения энергии Гиббса от реальных условий Стандартные состояния и активности, принятые для расчета энергии
- 38. 4. Зависимость изменения энергии Гиббса от реальных условий В общем виде для произвольной реакции зависимость изменения
- 39. Условие равновесия Константа равновесия – критерий полноты протекания реакции K>>1 в равновесной смеси преобладают продукты реакции
- 40. Следует различать истинное равновесие и мнимое или кажущееся, которое называют еще заторможенным равновесием или метастабильным состоянием
- 41. (с учетом ΔGo=ΔHo-TΔSo) к уменьшению K для экзотермических реакций к увеличению K для эндотермических реакций Повышение
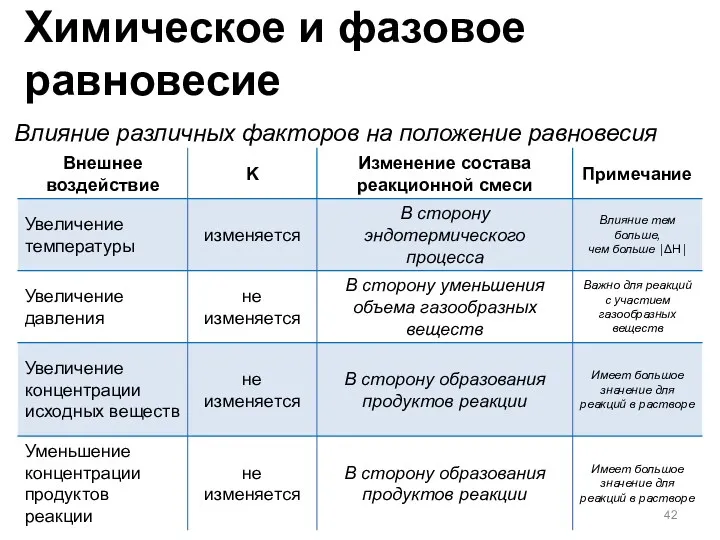
- 42. Влияние различных факторов на положение равновесия Химическое и фазовое равновесие
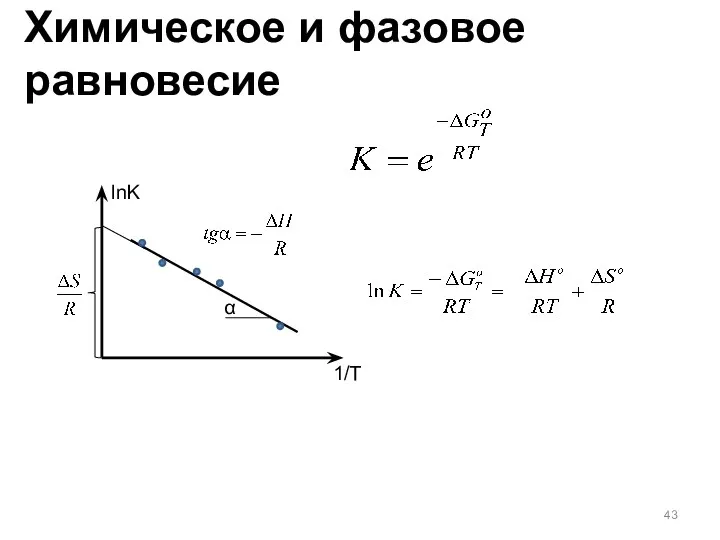
- 43. lnK 1/T α Химическое и фазовое равновесие
- 44. Фазовые диаграммы От химического индивида к фазе Клод Луи Бертолле Джон Дальтон Герман Минковский Джозайя Уиллард
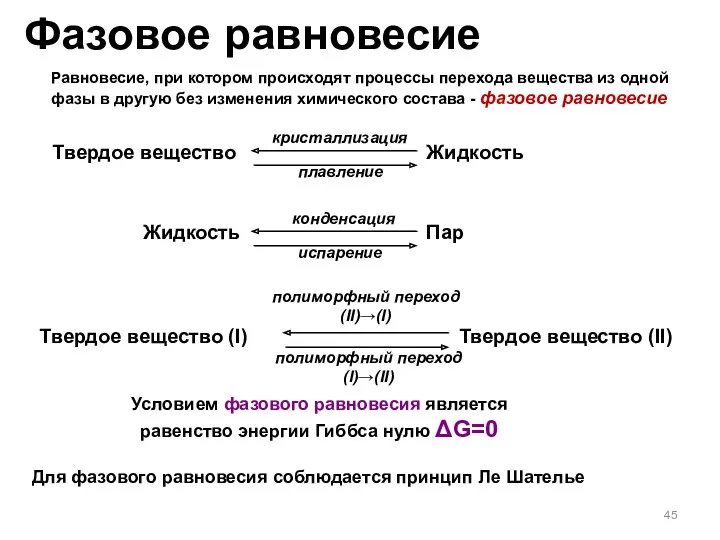
- 45. Фазовое равновесие Равновесие, при котором происходят процессы перехода вещества из одной фазы в другую без изменения
- 46. Фазовое равновесие Выбор параметров, влияющих на равновесие гетерогенной системы и условие равновесия определяется ПРАВИЛОМ ФАЗ Правило
- 47. Физико-химический анализ ФИЗИКО-ХИМИЧЕСКИЙ АНАЛИЗ изучает зависимости между составом и свойствами макроскопических систем, составленных из нескольких исходных
- 48. Преимущество физико-химического анализа как метода исследования заключается в том, что он не требует выделения продукта химического
- 49. Наглядное обобщение физико-химической информации Фазовые диаграммы
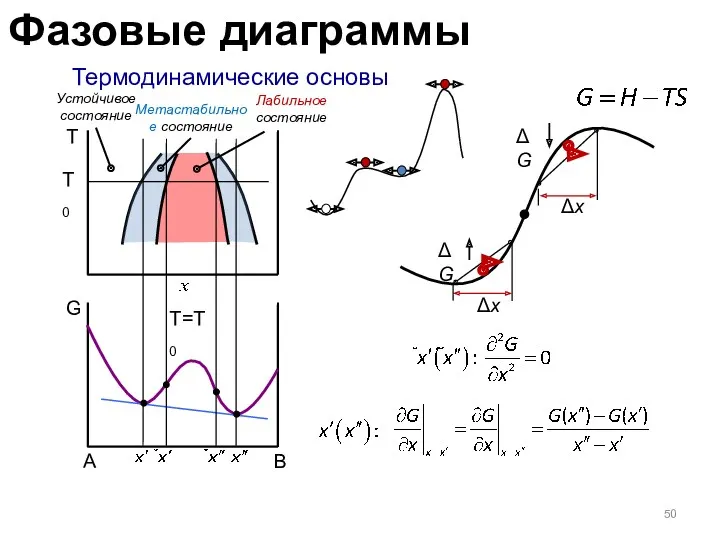
- 50. Термодинамические основы T G T0 T=T0 A Δx Δx ΔG ΔG Устойчивое состояние Метастабильное состояние Лабильное
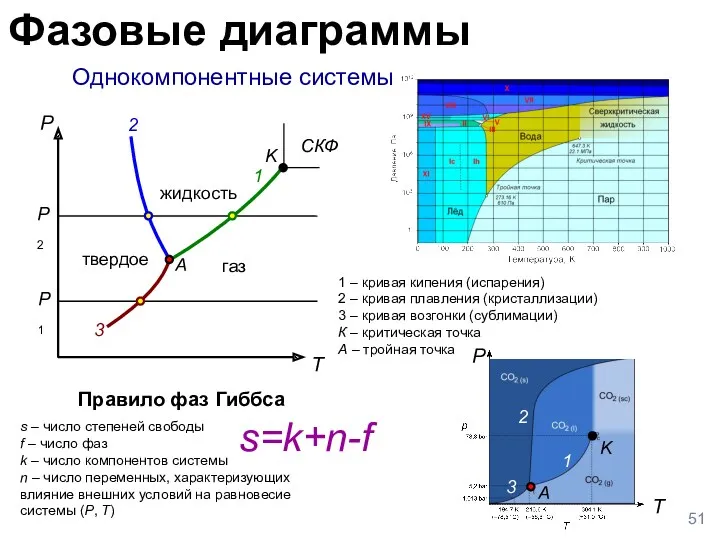
- 51. Однокомпонентные системы 1 – кривая кипения (испарения) 2 – кривая плавления (кристаллизации) 3 – кривая возгонки
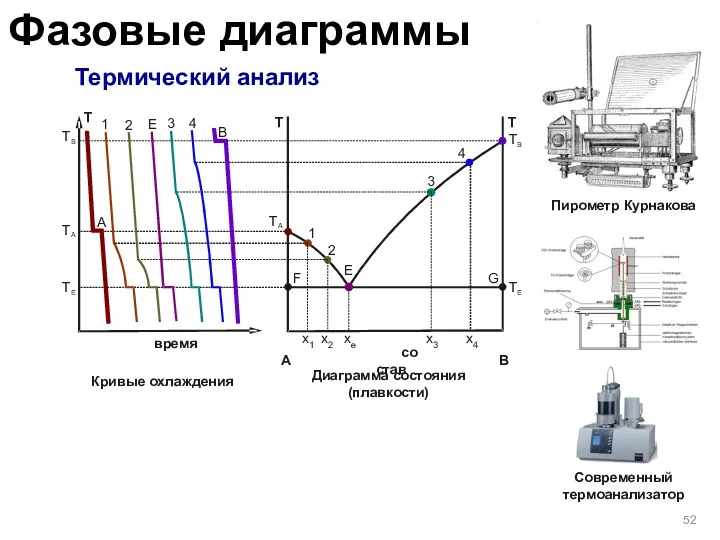
- 52. Термический анализ Фазовые диаграммы Т Е Т А Т В Т А В время Т А
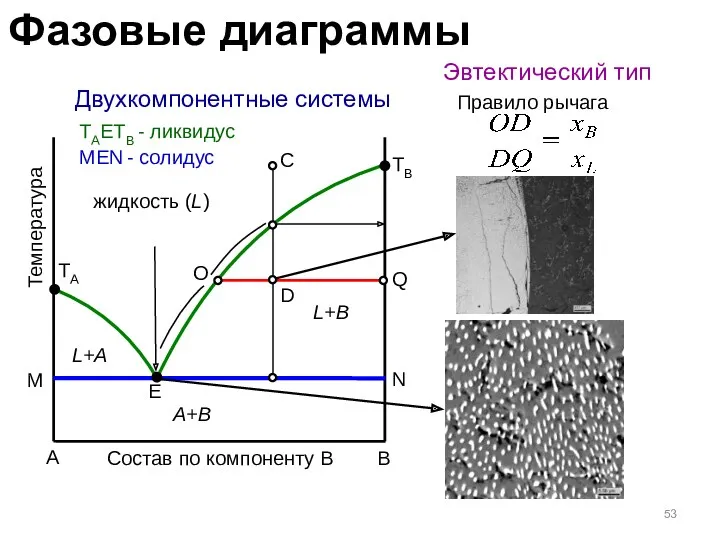
- 53. Двухкомпонентные системы Эвтектический тип A B Состав по компоненту B Температура TA TB жидкость (L) L+A
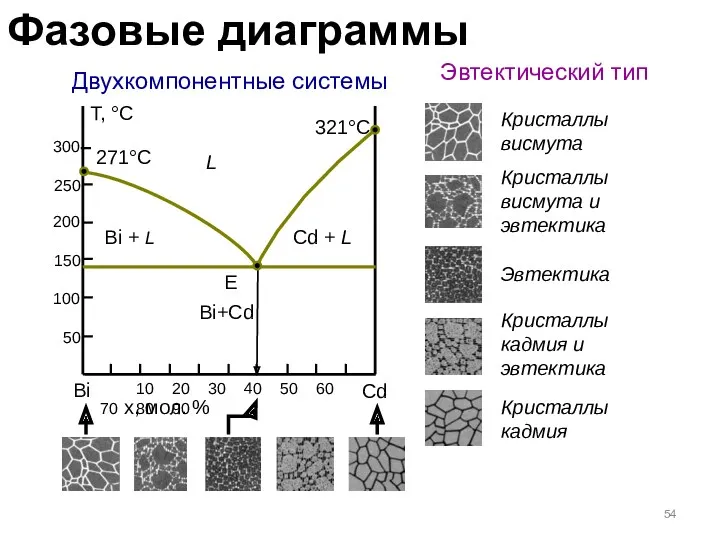
- 54. Двухкомпонентные системы Эвтектический тип Bi Cd x, мол. % Т, °С 271°C L Bi + L
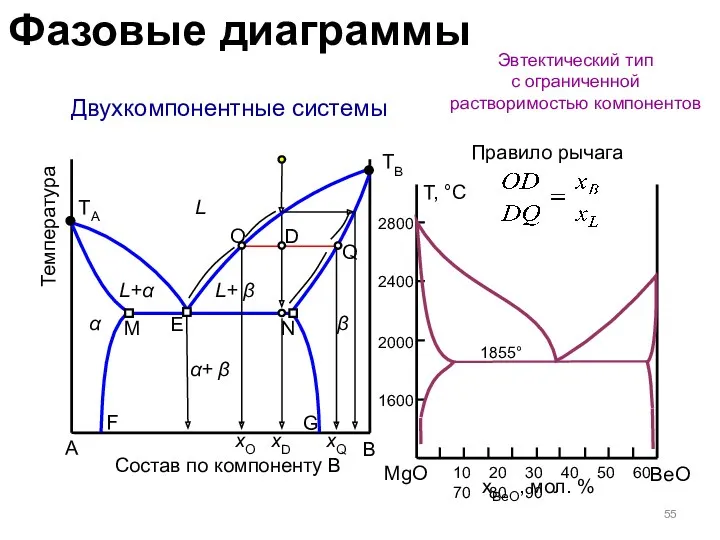
- 55. Двухкомпонентные системы Эвтектический тип с ограниченной растворимостью компонентов A B Состав по компоненту B Температура TA
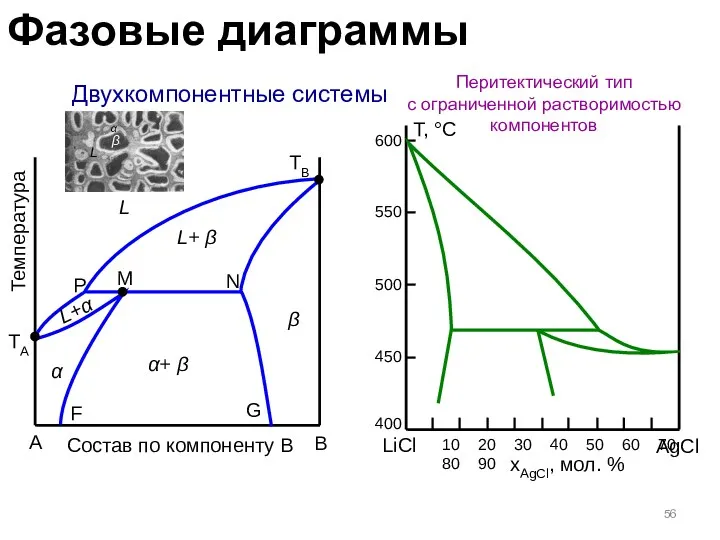
- 56. Двухкомпонентные системы Перитектический тип с ограниченной растворимостью компонентов A B Температура TA TB L L+α L+
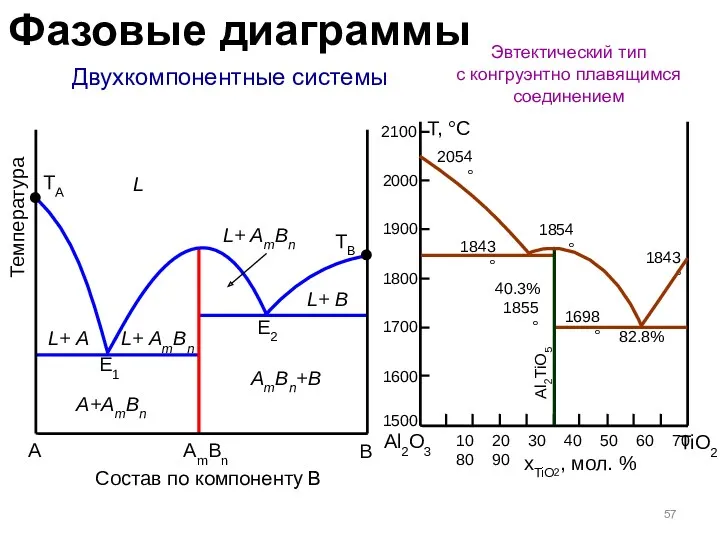
- 57. Двухкомпонентные системы Эвтектический тип с конгруэнтно плавящимся соединением A B Состав по компоненту B Температура TA
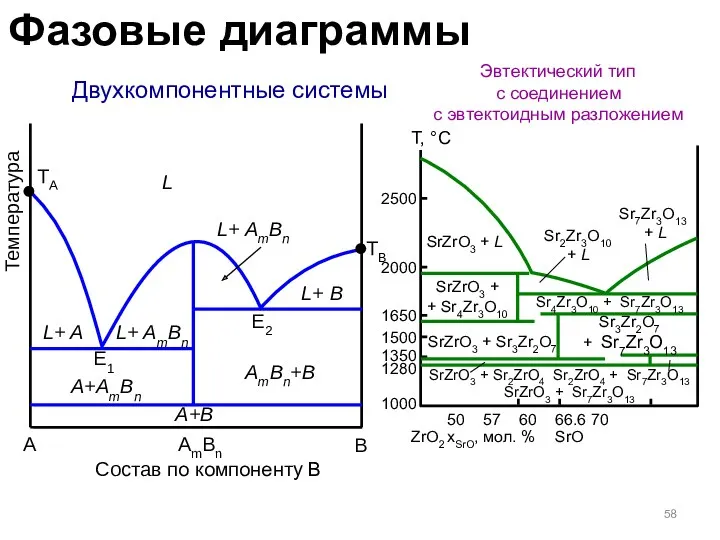
- 58. Двухкомпонентные системы Эвтектический тип с соединением с эвтектоидным разложением A B Температура TA L L+ A
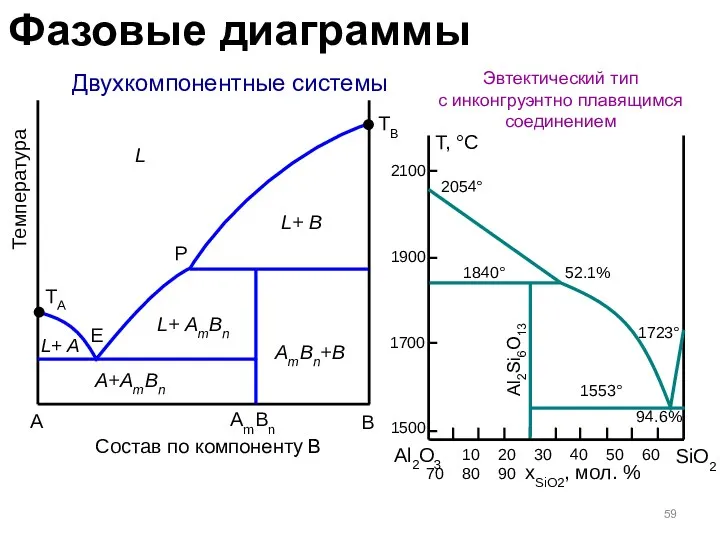
- 59. Двухкомпонентные системы Эвтектический тип с инконгруэнтно плавящимся соединением A B Температура TA L L+ A TB
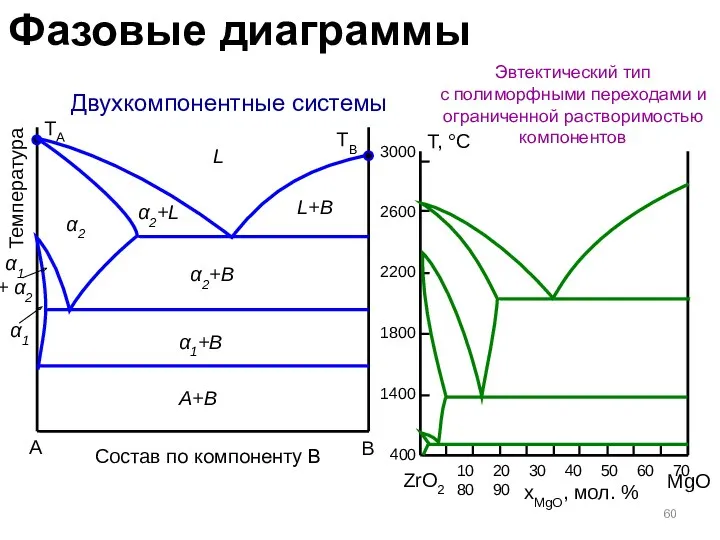
- 60. Двухкомпонентные системы Эвтектический тип с полиморфными переходами и ограниченной растворимостью компонентов A B Температура TA TB
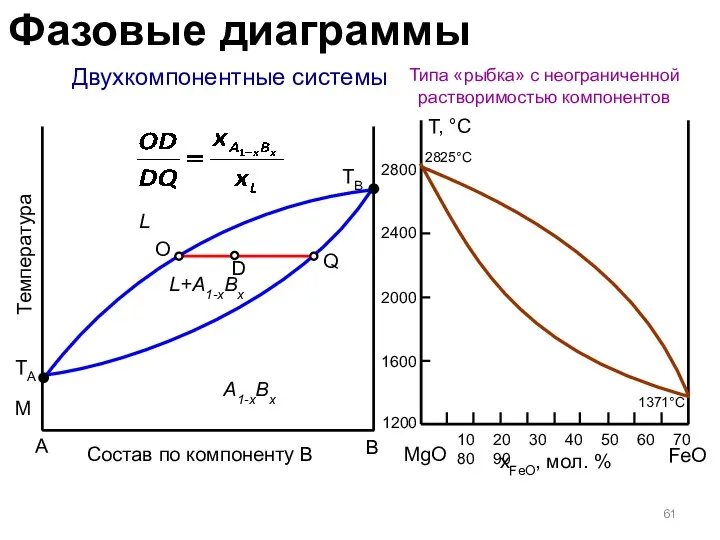
- 61. Двухкомпонентные системы Типа «рыбка» с неограниченной растворимостью компонентов A B Температура L M TB A1-xBx L+A1-xBx
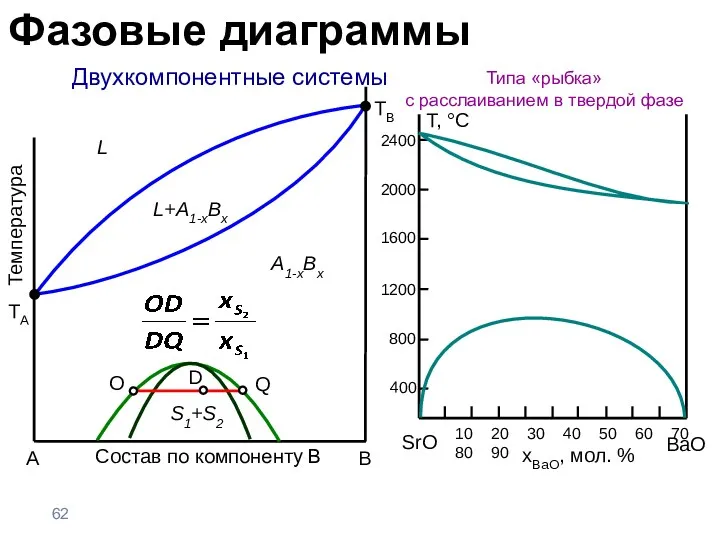
- 62. Двухкомпонентные системы Типа «рыбка» с расслаиванием в твердой фазе A B Температура TA L A1-xBx L+A1-xBx
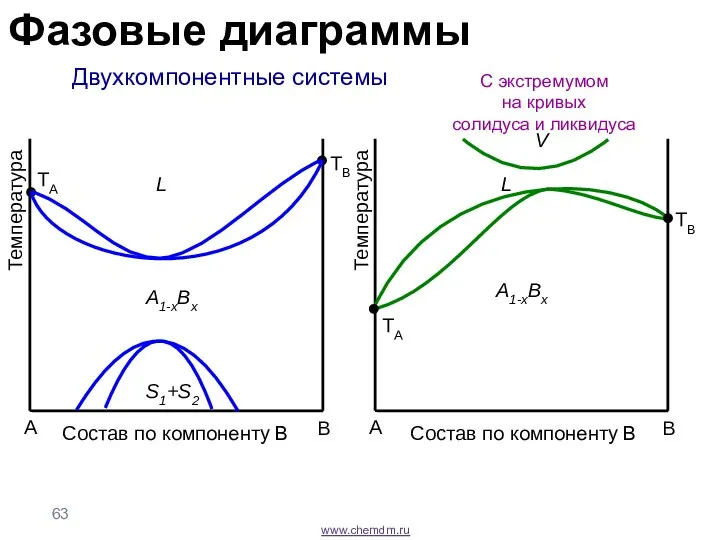
- 63. www.chemdm.ru Двухкомпонентные системы С экстремумом на кривых солидуса и ликвидуса A B Температура TA L TB
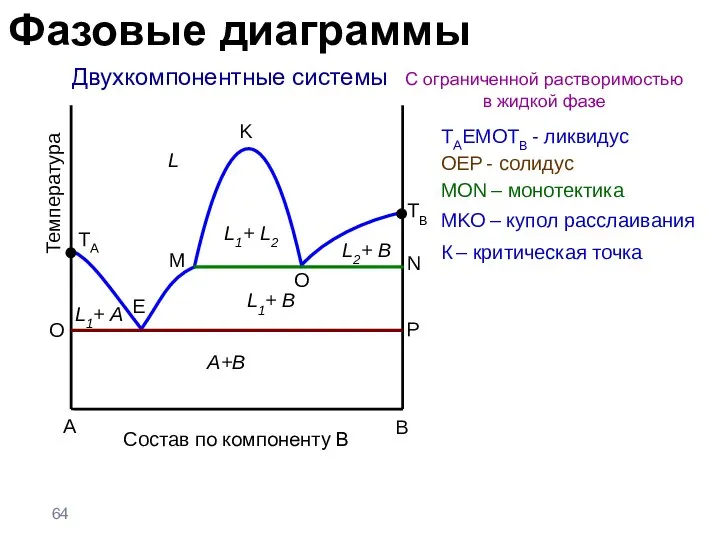
- 64. Двухкомпонентные системы С ограниченной растворимостью в жидкой фазе A B Температура TA L L1+ A TB
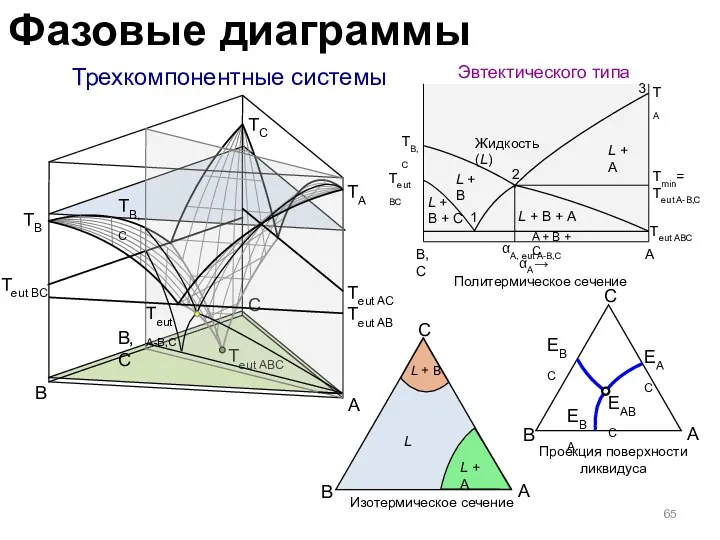
- 65. Трехкомпонентные системы Эвтектического типа B A C B,C Teut ABC Teut AB Teut AC Teut BC
- 66. Системы высшего порядка Ура! Я, наконец-то понял, как выглядит диаграмма состояния четырехкомпонентной системы в семимерном пространстве!!!
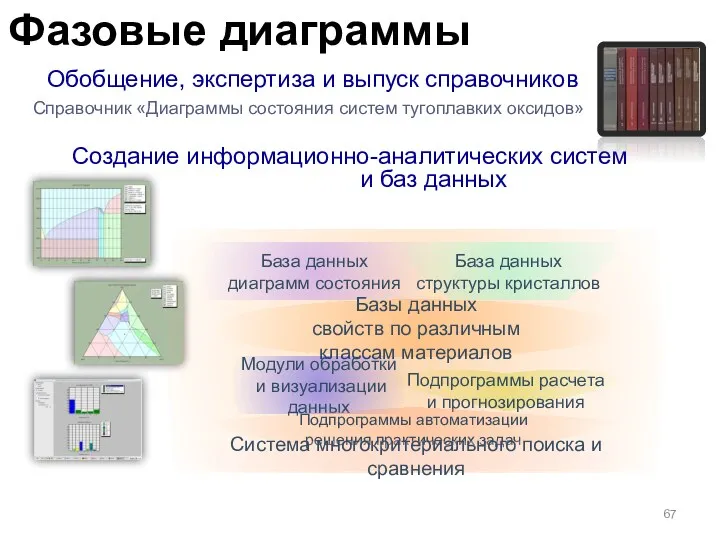
- 67. Обобщение, экспертиза и выпуск справочников Справочник «Диаграммы состояния систем тугоплавких оксидов» Создание информационно-аналитических систем и баз
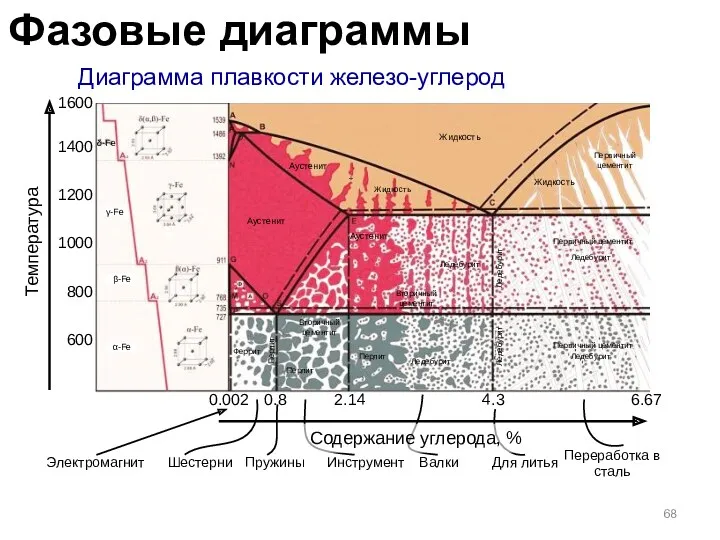
- 68. Диаграмма плавкости железо-углерод 600 800 1000 1200 1400 1600 0.002 0.8 2.14 4.3 6.67 Температура Аустенит
- 70. Скачать презентацию





































 Цікаві історичні факти з походження назв хімічних елементів
Цікаві історичні факти з походження назв хімічних елементів Структурно-механические свойства дисперсных систем
Структурно-механические свойства дисперсных систем Мытье головы
Мытье головы Chemical kinetics
Chemical kinetics Нітроген
Нітроген Гидролиз солей
Гидролиз солей Гетероциклдық қосылыстардың туындылары
Гетероциклдық қосылыстардың туындылары Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока
Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока Ароматические соединения. Тема № 5
Ароматические соединения. Тема № 5 Альдегиды и кетоны. Циветон
Альдегиды и кетоны. Циветон Составление формул химических соединений
Составление формул химических соединений Понятие о СМС и моющем процессе
Понятие о СМС и моющем процессе Биохимия. Критерии оценки косметических средств. Лекция 4. Индустрия красоты
Биохимия. Критерии оценки косметических средств. Лекция 4. Индустрия красоты Качественное определение химических элементов в почве
Качественное определение химических элементов в почве Электролиз
Электролиз 20190430_otkrytyy_urok_kislotypptx
20190430_otkrytyy_urok_kislotypptx Галогени. Знаходження в природі
Галогени. Знаходження в природі Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Теория электролитической диссоциации
Теория электролитической диссоциации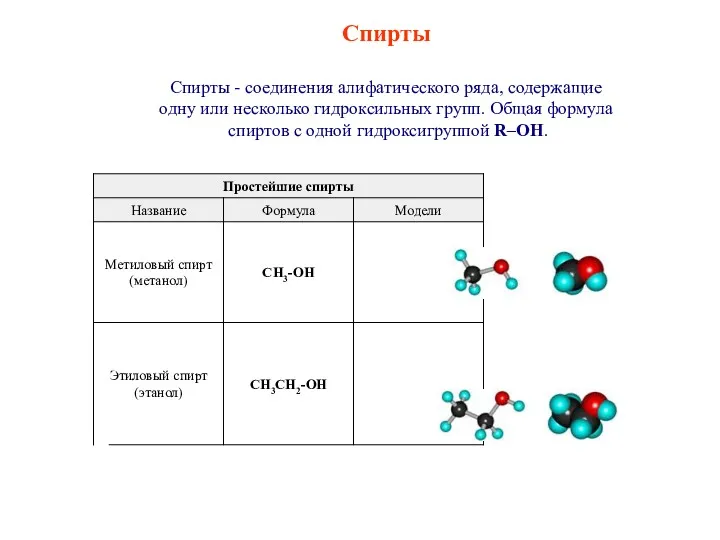 Спирты. Классификация спиртов
Спирты. Классификация спиртов Такой разный песок
Такой разный песок Изучение свойств горных пород, минералов и полезных ископаемых
Изучение свойств горных пород, минералов и полезных ископаемых Химический состав Земли
Химический состав Земли Значення хімічних процесів у природі
Значення хімічних процесів у природі Щелочные металлы
Щелочные металлы Экспериментально исследовательский проект Соль волшебница
Экспериментально исследовательский проект Соль волшебница Таблица Менделеева
Таблица Менделеева Закон сохранения массы веществ
Закон сохранения массы веществ