Содержание
- 2. Электролиз – это окислительно – восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав
- 3. Катионы (+) → катод (-) Анионы (-) → Анод (+)
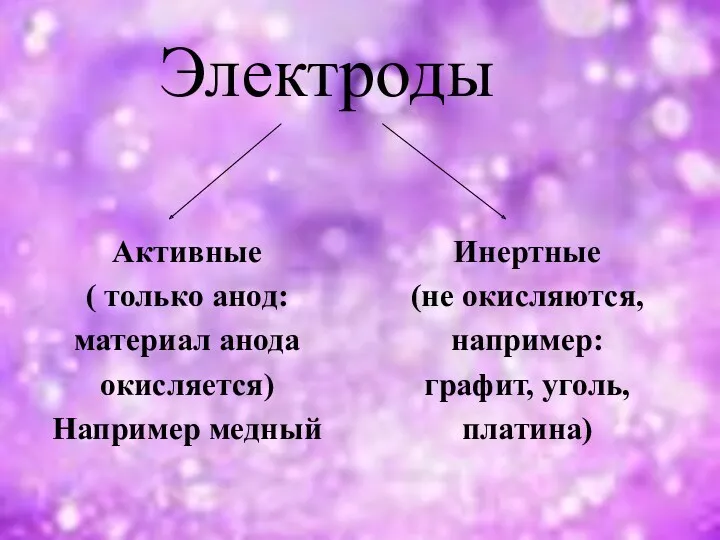
- 4. Электроды
- 5. 2 вида электролиза: - электролиз расплавов - электролиз растворов
- 6. Электролиз расплава Хлорида натрия NaCl → Na + + Cl – K (-)Na ++ ẽ →Na
- 7. Правила восстановления катионов на катоде:
- 8. Правила восстановления анионов на аноде: a) если анод не растворимый Cl-, Br-, S-, I -… Бескислородные
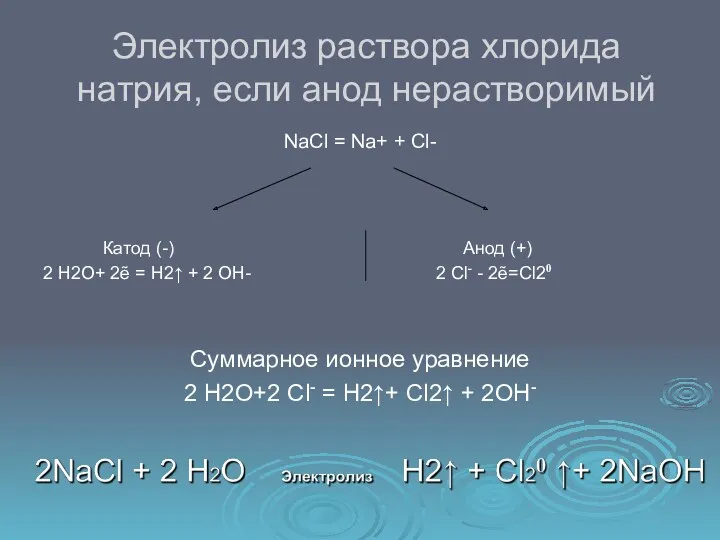
- 9. Электролиз раствора хлорида натрия, если анод нерастворимый NaCl = Na+ + Cl- Катод (-) Анод (+)
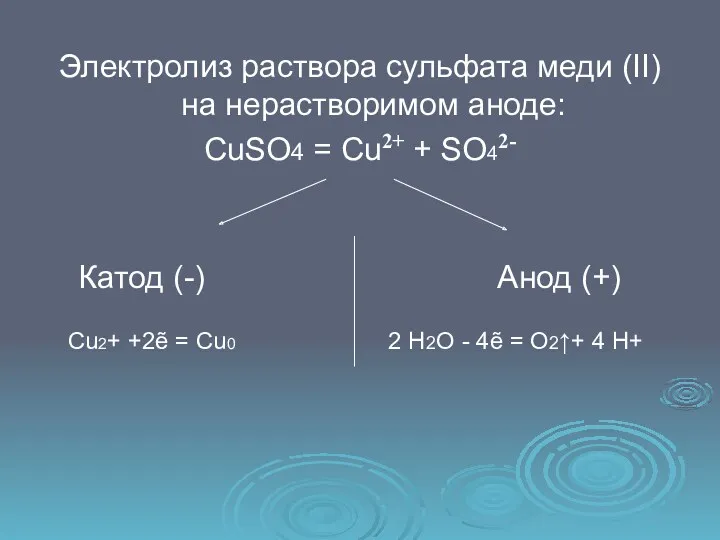
- 10. Электролиз раствора сульфата меди (II) на нерастворимом аноде: CuSO4 = Cu2+ + SO42- Катод (-) Анод
- 11. Cu2+ +2ẽ = Cu0 2 2 Н2О - 4ẽ = O2↑+ 4 H+ 1 Суммарное ионное
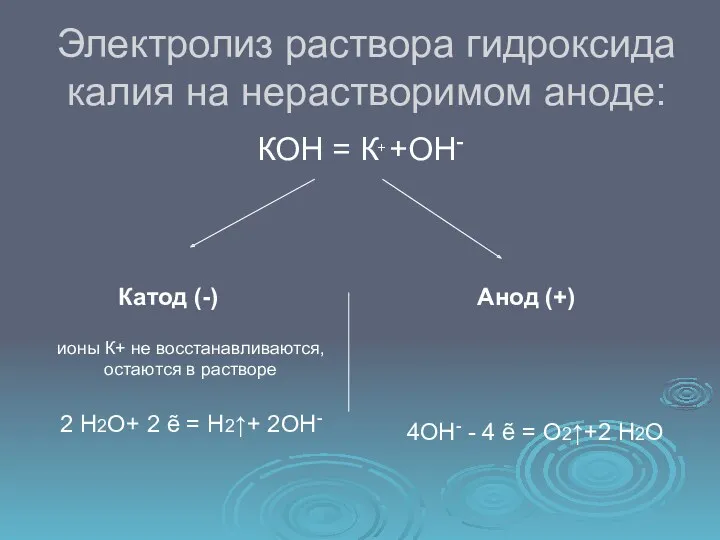
- 12. Электролиз раствора гидроксида калия на нерастворимом аноде: КОН = К+ +ОН- Катод (-) Анод (+) ионы
- 13. 2 Н2О+ 2 ẽ = Н2↑+ 2ОН- 2 4ОН- 4 ẽ = О2↑+2 Н2О 1 2
- 14. Суммарное молекулярное уравнение: 2 Н2О Электролиз 2Н2↑+ О2↑
- 15. Схема электролиза раствора сульфата меди CuSO4 , если анод медный: CuSO4 = Cu2+ + SO42- АНОД:
- 17. Скачать презентацию

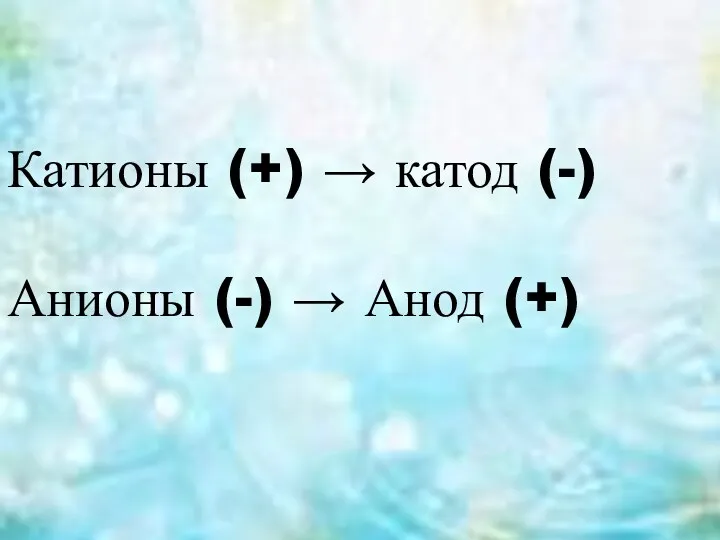








 Коллигативные свойства растворов неэлектролитов
Коллигативные свойства растворов неэлектролитов Mendel and the Gene Idea
Mendel and the Gene Idea Карбоновые кислоты. Свойства карбоновых кислот
Карбоновые кислоты. Свойства карбоновых кислот Коллоидные ПАВ
Коллоидные ПАВ Понятия и законы химии
Понятия и законы химии Химические уравнения. Закон сохранения массы веществ
Химические уравнения. Закон сохранения массы веществ Химия в строительстве
Химия в строительстве Защитно-декоративные покрытия
Защитно-декоративные покрытия Гидролиз солей
Гидролиз солей Complex compounds
Complex compounds Удивительные свойства воды
Удивительные свойства воды Синтетичні волокна
Синтетичні волокна Каталитикалық риформинг
Каталитикалық риформинг Узагальнення знань з теми Вуглеводні
Узагальнення знань з теми Вуглеводні Диеновые углеводороды или алкадиены (тема 4)
Диеновые углеводороды или алкадиены (тема 4) Химические свойства кислот
Химические свойства кислот Базовое нефтехимическое сырье
Базовое нефтехимическое сырье Спирты
Спирты Хлорид натрия (NaCI)
Хлорид натрия (NaCI) Биоорганикалық химия. Монофункционалды биоорганикалық қосылыстар: спирттер, альдегидтер мен кетондар
Биоорганикалық химия. Монофункционалды биоорганикалық қосылыстар: спирттер, альдегидтер мен кетондар Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері
Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері Углерод. Общая характеристика элементов подгруппы углерода
Углерод. Общая характеристика элементов подгруппы углерода Беттiк құбылыстар, олардың ағзадағы маңызы. Адсорбция
Беттiк құбылыстар, олардың ағзадағы маңызы. Адсорбция Элемент свинец Рb
Элемент свинец Рb Атомный и ионный радиусы. Принципы шаровых упаковок
Атомный и ионный радиусы. Принципы шаровых упаковок Огнетушащие вещества химического торможения реакции горения
Огнетушащие вещества химического торможения реакции горения Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Biomass Feedstocks
Biomass Feedstocks