Содержание
- 2. Абсолютная атомная или молекулярная масса ─ истинная масса атомов и молекул, выраженная в г или кг.
- 3. Относительная атомная или молекулярная масса ─ отношение массы атома или молекулы вещества к 1/12 массы атома
- 4. Относительная атомная или молекулярная масса показывает во сколько раз атом элемента или молекула тяжелее атомной единицы
- 5. Используя таблицу Д.И. Менделеева можно легко найти относительные атомные массы элементов, относительные молекулярные массы, а также
- 6. Закон сохранения массы веществ. (М.В.Ломоносов 1748г., А.Л.Лавуазье 1774г.) Массы веществ, вступающих в реакцию, равны массам веществ,
- 7. На основании закона сохранения масс веществ уравнивают химические реакции, выставляя стехиометрические коэффициенты (число элементов исходных веществ
- 8. Закон постоянства состава. (Ж.Л. Пруст, 1808г.) Всякое чистое вещество, независимо от способа его получения, всегда имеет
- 9. Количество вещества. Моль (n или ν) – количество вещества, содержащее столько структурных единиц (молекул, атомов, ионов
- 10. Молярная масса вещества (М) ─ масса вещества количеством 1 моль. Она численно равна относительной молекулярной массе
- 11. Ма(вещества) = М / NA Ма(Н3РО4) = 98 / 6,02 ∙ 10 23 = 1, 628
- 12. Газовые законы. При работе с газообразными веществами их заключают в определенный объем (V), который зависит от
- 13. Закон объемных отношений (Ж. Гей ─Люссака, 1808г.) Объемы вступивших в реакцию газов при одинаковых условиях (Р
- 14. ─ В равных объемах различных газов (V1 = V2 ) при одинаковых условиях (Р=const, Т= const)
- 15. Закон газового состояния или объединенный газовый закон. Данный закон позволяет переводить объем при заданных условиях V
- 16. Закон Менделеева – Клапейрона, 1874г. Данный закон считается универсальным, так как позволяет определить для газа любую
- 17. Пример: Газообразный хлороводород НCI имеет массу равную 2 граммам. Определить: Vо, n, N, V(t = 27оС
- 18. Молярные массы эквивалентов. Закон эквивалентов. Для количественных расчетов реагентов по уравнениям реакций можно избежать громоздких вычислений,
- 19. Масса одного эквивалента элемента называется его молярной массой эквивалента - М(1/Z) г/моль-экв. Молярная масса эквивалента воды
- 20. Для кислот Z – число замещаемых катионов водорода: Н2S f = 1/2 ; Н3РО4 f =
- 21. Пример: Zn + Н2SO4 = ZnSO4 + Н2S + Н2О. Молекула Н2SO4 (S+6), превращаясь в сероводород
- 22. Стехиометрические коэффициенты (мольные соотношения) в уравнениях реакций находят отражение в факторах эквивалентности, следовательно, и в эквивалентах
- 23. На основании закона эквивалентов можно проводить количественные расчеты реагентов, не составляя уравнения процессов, а ограничиваясь схемой.
- 25. Скачать презентацию






















 Липиды. Классификация липидов
Липиды. Классификация липидов Интеллектуальная игра Кто хочет стать отличником?. Химия. 11 класс
Интеллектуальная игра Кто хочет стать отличником?. Химия. 11 класс Ауыз судың химиялық тұрғыдан зиянсыздығын сипаттаушы көрсеткіштер
Ауыз судың химиялық тұрғыдан зиянсыздығын сипаттаушы көрсеткіштер Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас Роль металлов в нашей жизни
Роль металлов в нашей жизни Стереографическая проекция. Ориентация кристаллов высшей категории
Стереографическая проекция. Ориентация кристаллов высшей категории Галогены. Историческая справка
Галогены. Историческая справка Получение водорода. Проверка Н2 на чистоту. Практическая работа
Получение водорода. Проверка Н2 на чистоту. Практическая работа Кислоты. Химические свойства кислот
Кислоты. Химические свойства кислот Розділ 3. Теорія комплексних сполук. Комплексні сполуки
Розділ 3. Теорія комплексних сполук. Комплексні сполуки Введение в химию. 8 класс
Введение в химию. 8 класс Три кити нанохімії
Три кити нанохімії Період як особлива синтаксична конструкція
Період як особлива синтаксична конструкція Вуглеводи
Вуглеводи Історія відкриття періодичної системи хімічних елементів Д. І. Меделєєва
Історія відкриття періодичної системи хімічних елементів Д. І. Меделєєва Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Химическая связь
Химическая связь Дослідження оптичних властивостей нематичних рідких кристалів допованих Оксидом церію IV (СеО2)
Дослідження оптичних властивостей нематичних рідких кристалів допованих Оксидом церію IV (СеО2) Электронное строение элементов-органогенов. Типы химической связи
Электронное строение элементов-органогенов. Типы химической связи Гидролиз солей
Гидролиз солей Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс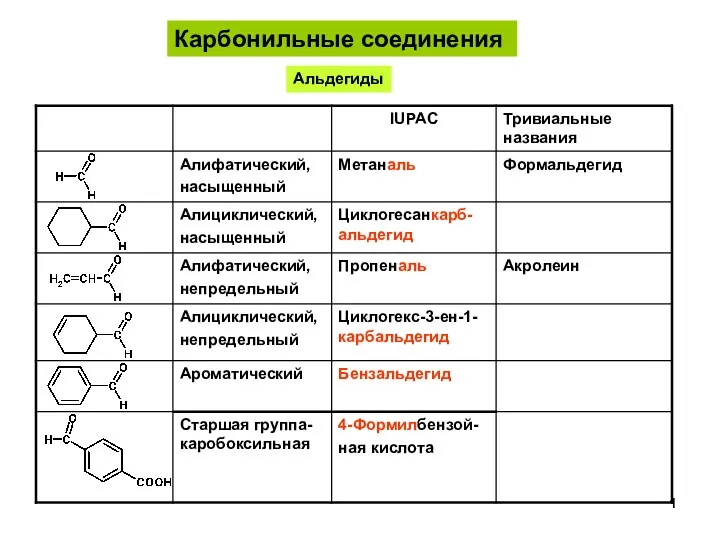 АльдегидыКетоны-1
АльдегидыКетоны-1 Ферменты в пищевой промышленности
Ферменты в пищевой промышленности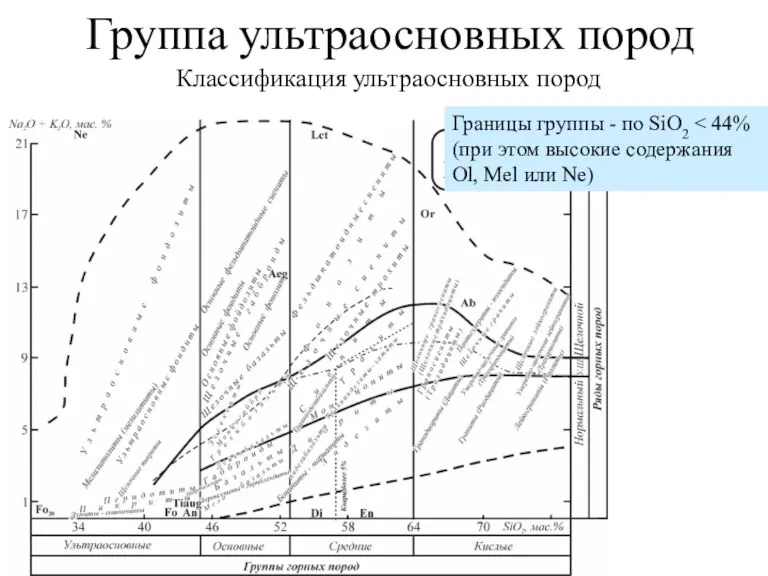 Группа ультраосновных пород
Группа ультраосновных пород Подгруппа азота. 9 класс
Подгруппа азота. 9 класс Алкани
Алкани Оксиды неметаллов
Оксиды неметаллов Век пластмасс
Век пластмасс