Содержание
- 2. Теория химической связи Бертоле: в основе химической связи лежит чисто гравитационное притяжение атомов 1748-1822 Теория химической
- 3. Современная теория химической связи ( Г. Льюис, 1916) Возникновение химической связи обусловле-но стремлением атомов элементов к
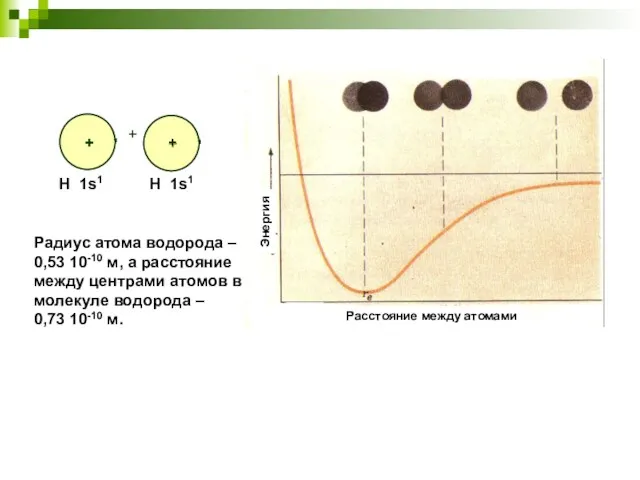
- 4. Радиус атома водорода – 0,53 10-10 м, а расстояние между центрами атомов в молекуле водорода –
- 5. Современная теория химической связи базируется на трех основных методах: метод валентных связей описывает химическую связь чисто
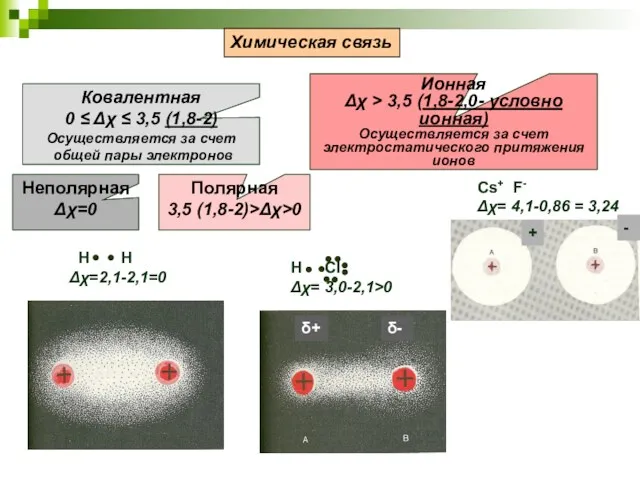
- 6. 4.2. Типы химических связей Тип химической связи определяется характером распре-деления делокализованной электронной плотности меж-ду центрами образующих
- 7. Cs+ F- Δχ= 4,1-0,86 = 3,24 Химическая связь Ковалентная 0 ≤ Δχ ≤ 3,5 (1,8-2) Осуществляется
- 8. Электроны, принимающие участие в образовании связи называются валентными. Na 1s22s22p63s1 Mg 1s22s22p6 3s2 O 1s22s22p4 As
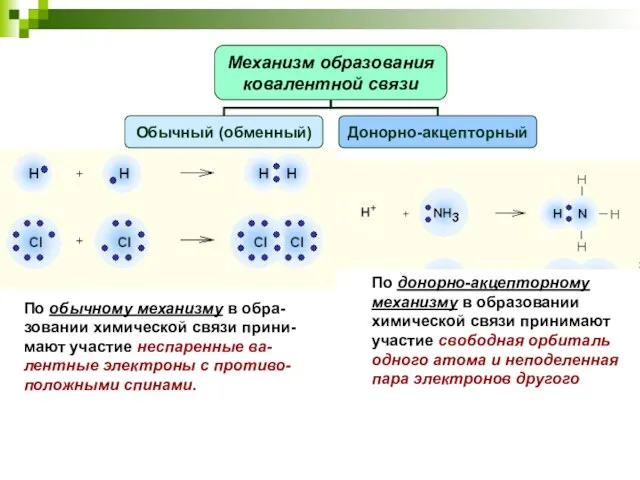
- 9. По обычному механизму в обра-зовании химической связи прини-мают участие неспаренные ва-лентные электроны с противо-положными спинами. По
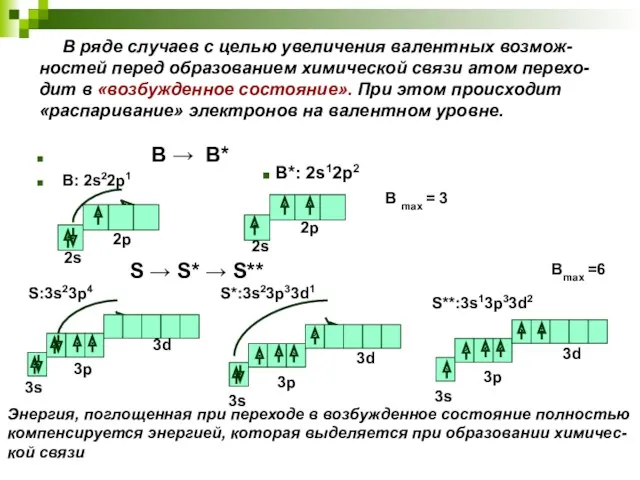
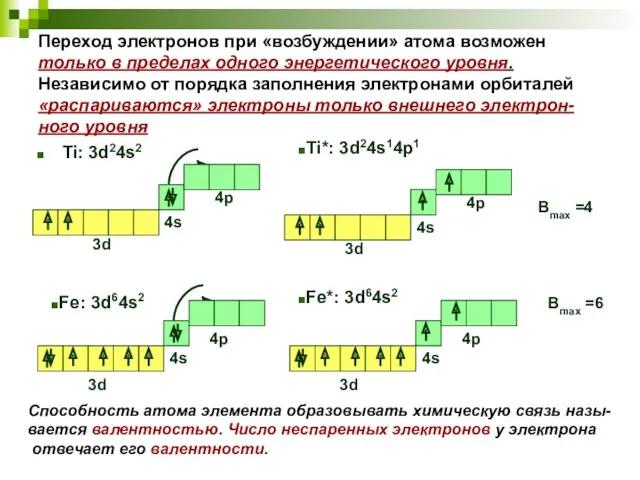
- 10. В ряде случаев с целью увеличения валентных возмож-ностей перед образованием химической связи атом перехо-дит в «возбужденное
- 11. Переход электронов при «возбуждении» атома возможен только в пределах одного энергетического уровня. Независимо от порядка заполнения
- 12. Степень окисления – это условный заряд, который приоб-рел бы атом, если бы валентная пара электронов полнос-тью
- 13. 4.4. Параметры и свойства ковалентной связи Основные параметры ковалентной связи: 1. Длина связи l – это
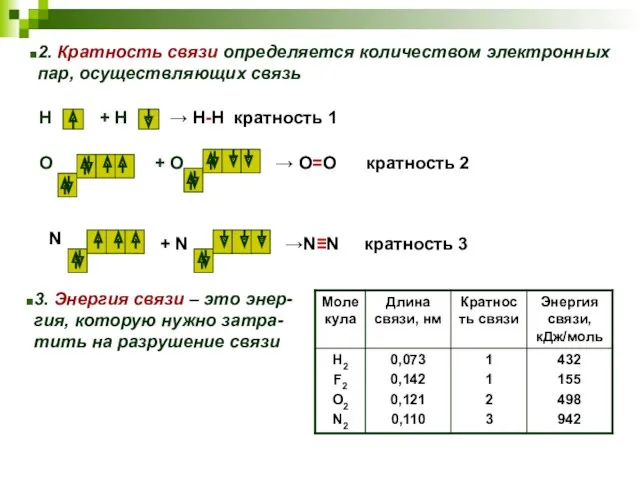
- 14. 2. Кратность связи определяется количеством электронных пар, осуществляющих связь 3. Энергия связи – это энер- гия,
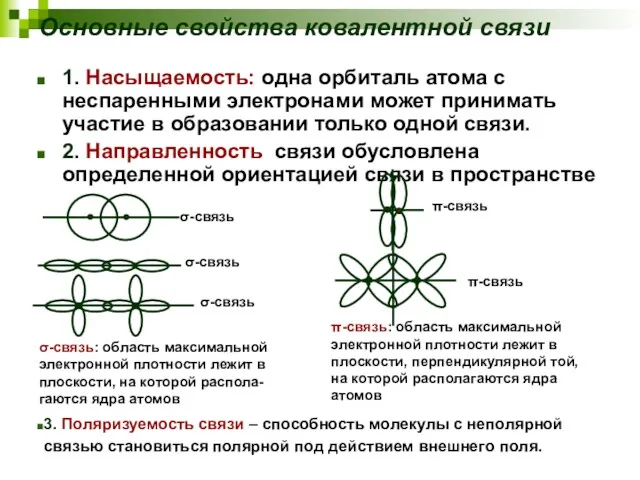
- 15. Основные свойства ковалентной связи 1. Насыщаемость: одна орбиталь атома с неспаренными электронами может принимать участие в
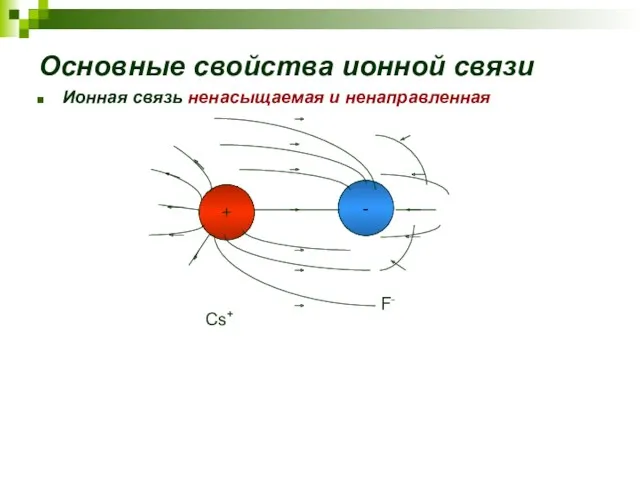
- 16. Основные свойства ионной связи Ионная связь ненасыщаемая и ненаправленная Cs+ F-
- 17. 4.5. Гибридизация орбиталей. Геометрическая форма молекул В молекуле все связи, независимо от того, каким электронами они
- 18. При гибридизации происходит перераспределение электронной плотности, которое требует затрат энергии. В результате гибридизации электронное облако вытягивается
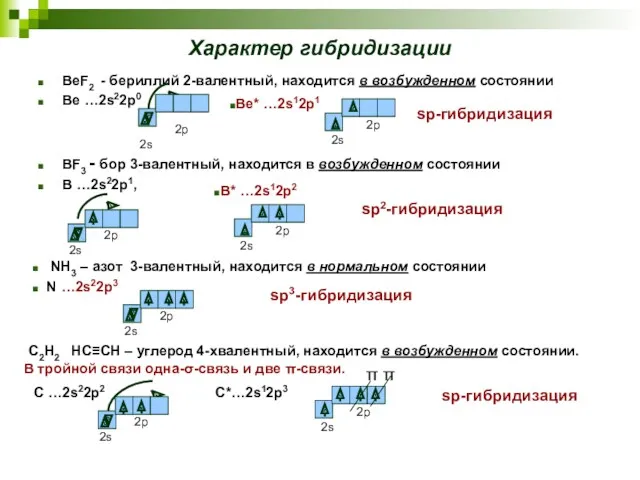
- 19. Характер гибридизации BeF2 - бериллий 2-валентный, находится в возбужденном состоянии Be …2s22p0 BF3 - бор 3-валентный,
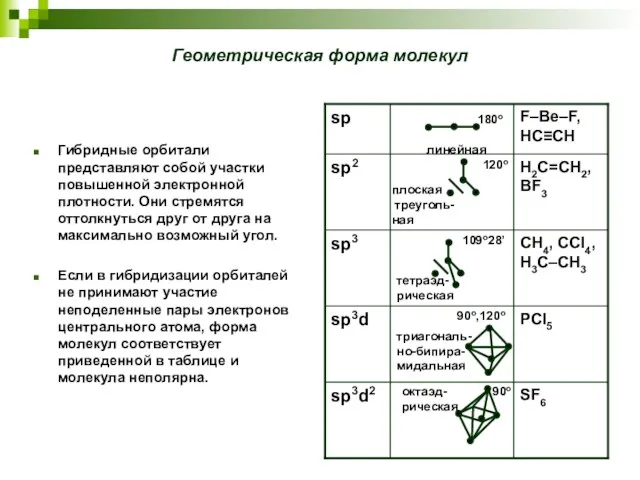
- 20. Геометрическая форма молекул Гибридные орбитали представляют собой участки повышенной электронной плотности. Они стремятся оттолкнуться друг от
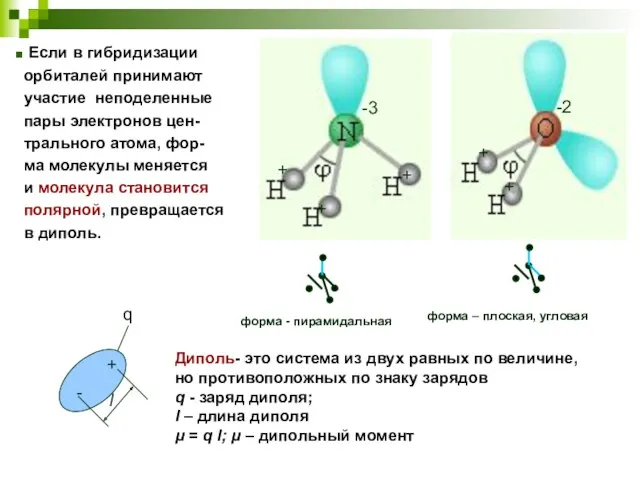
- 21. форма - пирамидальная форма – плоская, угловая Диполь- это система из двух равных по величине, но
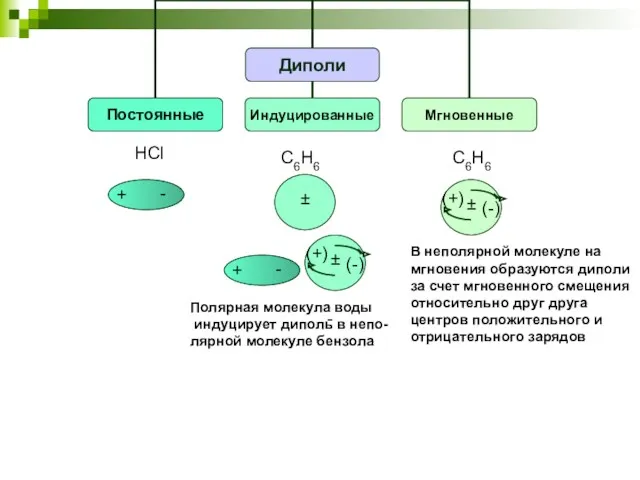
- 22. HCl C6H6 - Полярная молекула воды индуцирует диполь в непо- лярной молекуле бензола C6H6 В неполярной
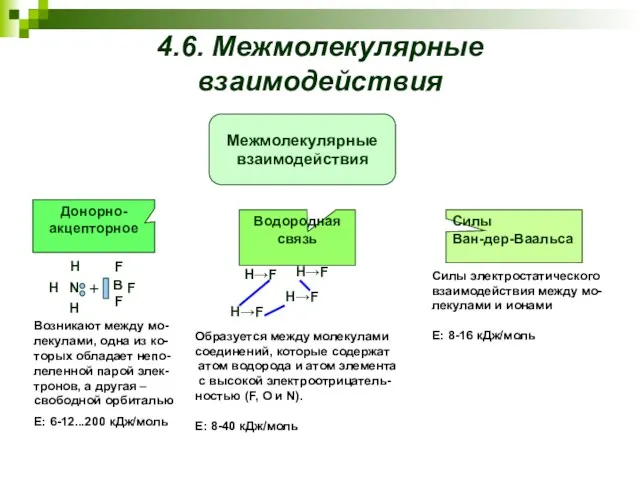
- 23. 4.6. Межмолекулярные взаимодействия Возникают между мо-лекулами, одна из ко-торых обладает непо-леленной парой элек-тронов, а другая –
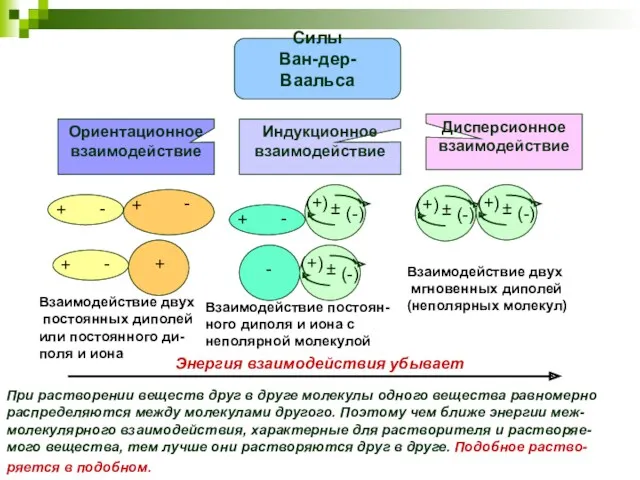
- 24. Взаимодействие двух постоянных диполей или постоянного ди- поля и иона Взаимодействие постоян- ного диполя и иона
- 25. Практическое использование вопросов, связанных с межмолекулярными взаимодействиями при добыче нефти и газа. 1. Осушка природного газа
- 27. Скачать презентацию










 Дендример, или арборол
Дендример, или арборол Липиды и обмен липидов
Липиды и обмен липидов Произведение растворимости. Строение комплексных соединений
Произведение растворимости. Строение комплексных соединений Алканы: физические и химические свойства, получение
Алканы: физические и химические свойства, получение Галогени. Знаходження в природі
Галогени. Знаходження в природі Реакции ионного обмена
Реакции ионного обмена Алкодиены или диеновые углеводороды
Алкодиены или диеновые углеводороды Теплота горения
Теплота горения Строение электронных оболочек атомов химических элементов
Строение электронных оболочек атомов химических элементов Основные положения теории растворов электролитов, используемых в аналитической химии. (Лекция 3)
Основные положения теории растворов электролитов, используемых в аналитической химии. (Лекция 3) Кислоты. Серная кислота-H₂SO₄
Кислоты. Серная кислота-H₂SO₄ Фосфор. 9 класс
Фосфор. 9 класс Нитраттарды қолдану
Нитраттарды қолдану Магний (Mg)
Магний (Mg) Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали
Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали Химическое кафе Кислоты
Химическое кафе Кислоты Соединения углерода
Соединения углерода Жиры и мыло
Жиры и мыло топ през
топ през Мир кристаллов. Изучение теоретического материала по теме Кристалл
Мир кристаллов. Изучение теоретического материала по теме Кристалл Знакомство с образцами химических средств санитарии и гигиены
Знакомство с образцами химических средств санитарии и гигиены Закономерности химических реакций. (Лекция 3)
Закономерности химических реакций. (Лекция 3) Механизмы органических реакций
Механизмы органических реакций Количество вещества. 8 класс
Количество вещества. 8 класс Гомологический ряд алканов. Изомерия и номенклатура
Гомологический ряд алканов. Изомерия и номенклатура Химические реакторы. Гетерогенно-каталитические химические процессы. Лекция №15
Химические реакторы. Гетерогенно-каталитические химические процессы. Лекция №15 Катализаторы. Ферменты
Катализаторы. Ферменты Пластмаси, синтетичні каучуки, гума, штучні й синтетичні
Пластмаси, синтетичні каучуки, гума, штучні й синтетичні