Содержание
- 2. Актуализация знаний. Чему равно общее количество электронов в атоме? Что такое энергетический уровень? Как определить число
- 3. Расшифруйте ребусы, укажите их положение в ПСХЭ, определите число электронов в атомах этих химических элементов.
- 4. Ответы: 1. Никель ( 4 период ( большой), VIII группа ( побочная подгруппа) , порядковый №
- 5. Ответы 7. Мышьяк( 4 период ( большой), V группа( главная подгруппа) , порядковый № 33; электронов
- 6. ТЕМА УРОКА «Строение электронных оболочек атомов химических элементов №1-20».
- 7. Цель урока: научиться составлять электронные формулы атомов элементов первых трех периодов ПСХЭ; объяснять зависимость и закономерные
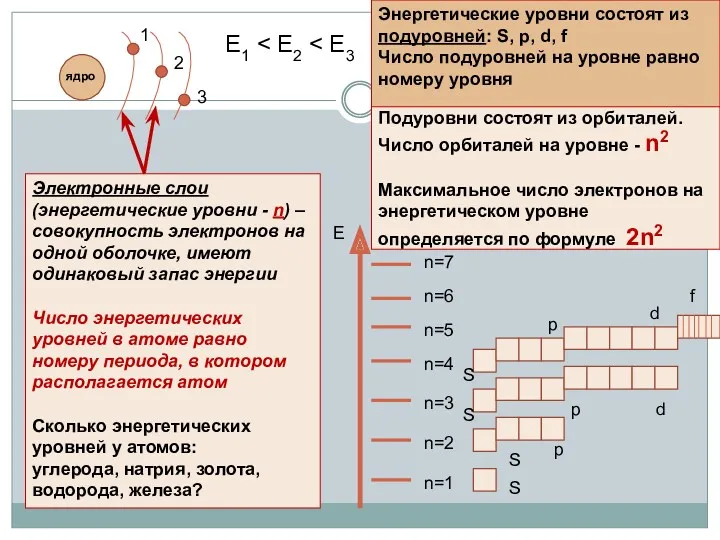
- 8. Электронная оболочка Совокупность всех электронов в атоме, окружающих ядро Каждый электрон имеет свою траекторию движения и
- 9. Подуровни состоят из орбиталей. Число орбиталей на уровне - n2 Максимальное число электронов на энергетическом уровне
- 10. Энергетические уровни, содержащие максимальное число электронов, называются завершенными. Они обладают повышенной устойчивостью и стабильностью Энергетические уровни,
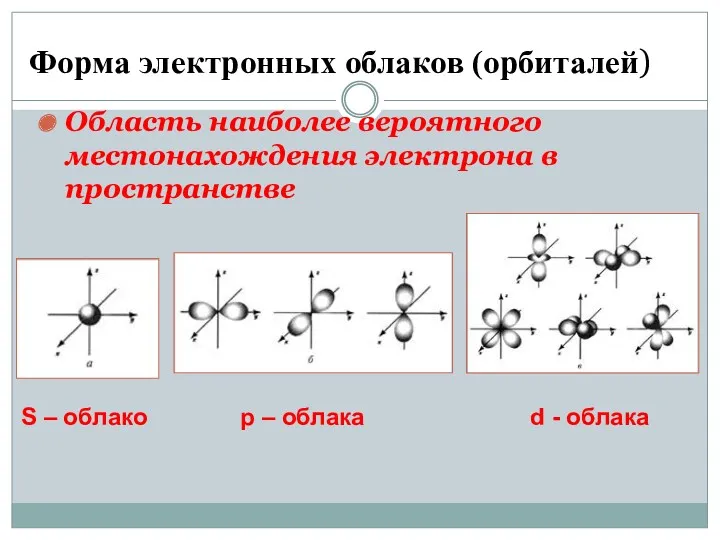
- 11. Форма электронных облаков (орбиталей) Область наиболее вероятного местонахождения электрона в пространстве S – облако р –
- 12. Выводы: Электроны, двигаясь вокруг ядра атома, образуют электронную оболочку. Электронная оболочка состоит из электронных слоев. Каждый
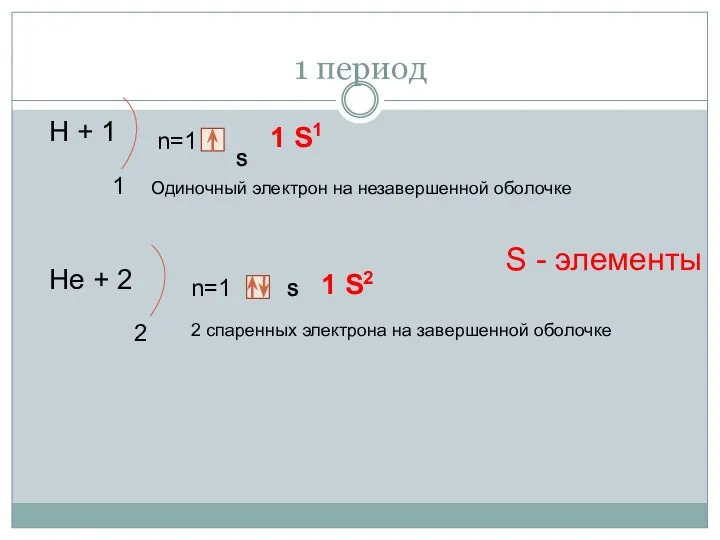
- 13. 1 период Н + 1 1 n=1 S 1 S1 Нe + 2 2 n=1 S
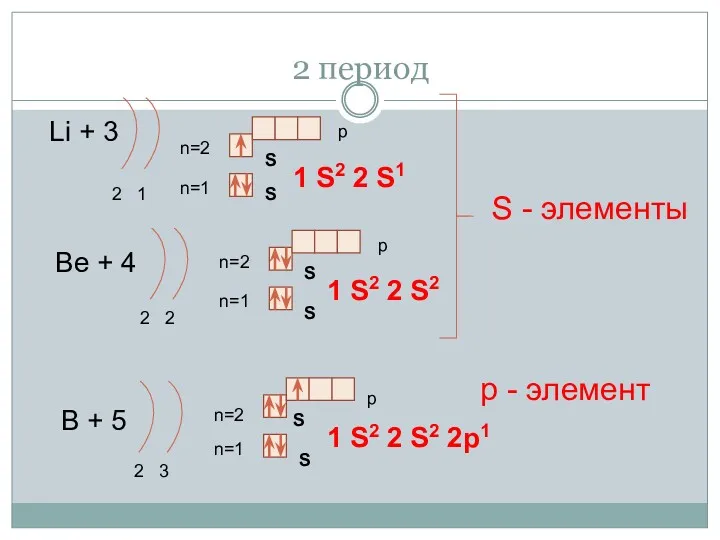
- 14. 2 период Li + 3 2 1 n=1 n=2 1 S2 2 S1 Be + 4
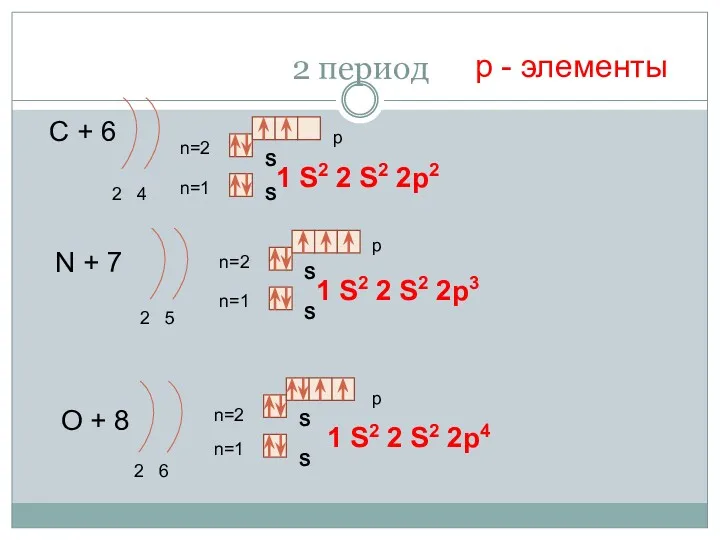
- 15. 2 период С + 6 2 4 n=1 n=2 N + 7 2 5 n=1 n=2
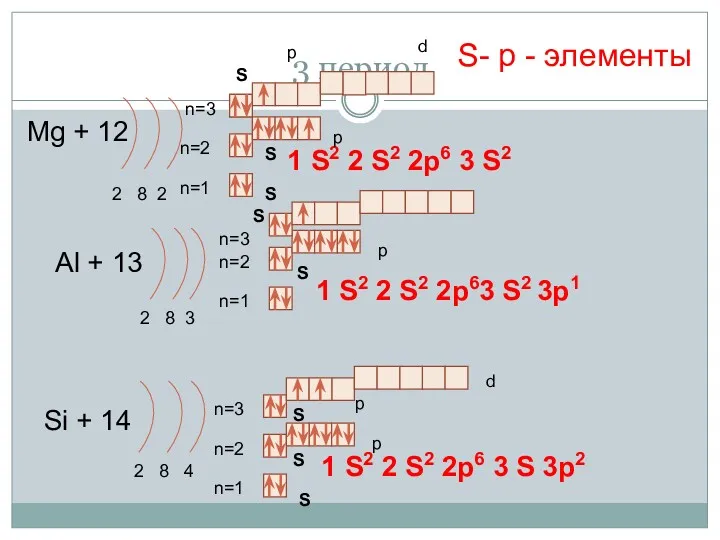
- 16. 3 период Mg + 12 2 8 2 n=1 n=2 Al + 13 2 8 3
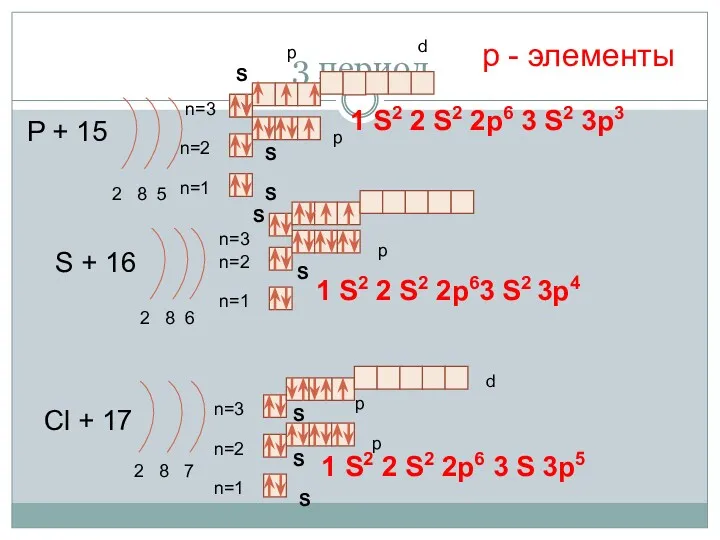
- 17. 3 период P + 15 2 8 5 n=1 n=2 S + 16 2 8 6
- 18. Игра в «Крестики- нолики» выигрышный путь составляют : А)элементы одного периода
- 19. Игра в «Крестики- нолики» выигрышный путь составляют : Б)элементы одной главной подгруппы
- 20. Игра в «Крестики- нолики» выигрышный путь составляют : В)элементы, расположенные рядом в ПСХЭ
- 21. Рефлексия Я все понял, могу объяснить другому По данной теме у меня остались вопросы Недостаточно понял
- 23. Скачать презентацию












 Химические свойства неорганических соединений
Химические свойства неорганических соединений Пробоотбор других ООС. Лекция 3
Пробоотбор других ООС. Лекция 3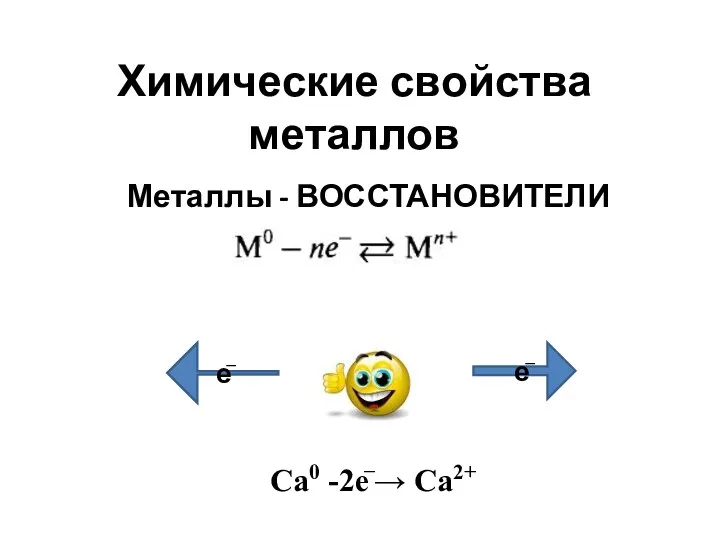 Химические свойства металлов
Химические свойства металлов Железоуглеродистые сплавы
Железоуглеродистые сплавы Химические свойства металлов. Урок химии в 9 классе
Химические свойства металлов. Урок химии в 9 классе Соединения химических элементов. Валентность и степень окисления элементов
Соединения химических элементов. Валентность и степень окисления элементов Темір және оның маңызды қосылыстары
Темір және оның маңызды қосылыстары Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Общая характеристика твердого, жидкого и газообразного видов топлива
Общая характеристика твердого, жидкого и газообразного видов топлива Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Сурьма. Положение в периодической системе химических элементов Менделеева
Сурьма. Положение в периодической системе химических элементов Менделеева Предмет и задачи химии. Вещества и их свойства (продолжение)
Предмет и задачи химии. Вещества и их свойства (продолжение) Типы кристаллических решеток. Повторение: виды химической связи
Типы кристаллических решеток. Повторение: виды химической связи Жиры
Жиры Алюминий на кухне - опасный враг или верный помощник
Алюминий на кухне - опасный враг или верный помощник Субстраты и продукты биохимических реакций
Субстраты и продукты биохимических реакций Качественные реакции на анионы
Качественные реакции на анионы Химическая термодинамика
Химическая термодинамика Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки. Складання формули сполуки
Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки. Складання формули сполуки Фізичні та хімічні явища (гра)
Фізичні та хімічні явища (гра) Ионоселективные электроды
Ионоселективные электроды Этанол (эти́ловый спирт)
Этанол (эти́ловый спирт) Негізгі топша элементтерінің химиясы
Негізгі топша элементтерінің химиясы Строение и свойства циклоалканов
Строение и свойства циклоалканов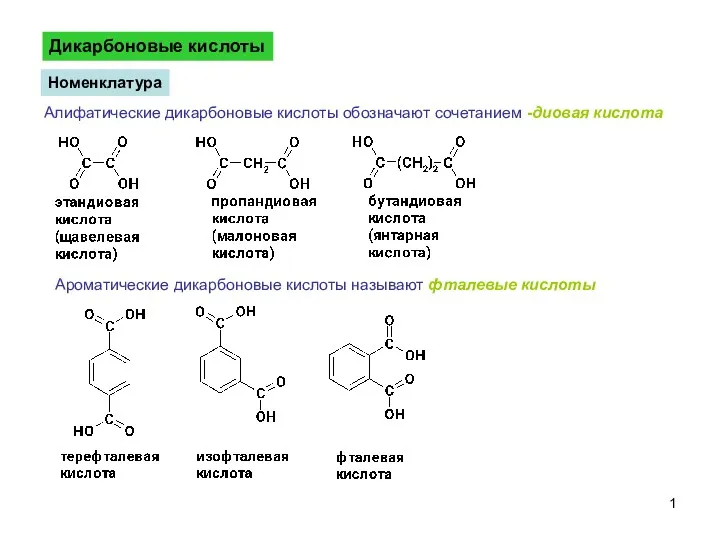 ДикарбоновыеКислоты-1
ДикарбоновыеКислоты-1 Металлическая связь. Агрегатные состояния вещества
Металлическая связь. Агрегатные состояния вещества Химическая кинетика и катализ
Химическая кинетика и катализ Кристаллические решетки. Кристаллические вещества
Кристаллические решетки. Кристаллические вещества