Содержание
- 2. «Мощь и сила науки – во множестве фактов, цель – в обобщении этого множества». Д.И. Менделеев
- 3. Тип урока: изучение нового материала Цели урока: Образовательные: сформировать понятия об общих химических свойствах металлов; Развивающие:
- 4. Какой металл самый – самый…? 1. Самый легкий металл – … 2. Самый тяжелый металл –
- 5. Тест «Металлы». Инструкция: выберите 1 правильный ответ, время выполнения 5 минут. Вариант 1. 1. Выберите группу
- 6. Тест «Металлы». Инструкция: выберите 1 правильный ответ, время выполнения 5 минут. Вариант 2. 1. Выберите группу
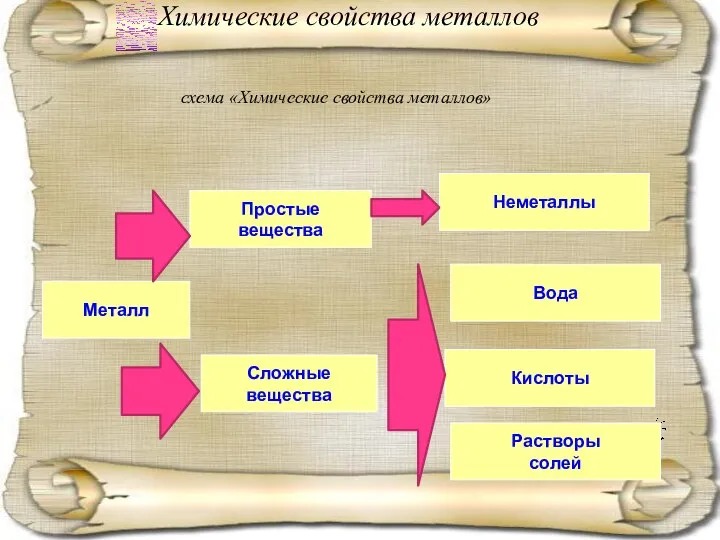
- 7. Химические свойства металлов Предположите химические свойства металлов. С какими веществами могут они взаимодействовать. Заполнить схему «Химические
- 8. Химические свойства металлов схема «Химические свойства металлов» Металл Простые вещества Сложные вещества Неметаллы Вода Кислоты Растворы
- 9. Взаимодействие с неметаллами Вступают в реакцию с неметаллами 2Mg + O2 = 2MgO 2Al + 3I2
- 10. Химические свойства металлов Взаимодействуют с водой a) Щелочные и щелочночноземельные металлы
- 11. . Поместите в каждую из 3 пробирок металлы: алюминий цинк и медь прилейте соляную кислоту. Что
- 12. . Взаимодействие с растворами кислот Вывод: 1. Металлы (до Н в ряду активности) реагируют с кислотами
- 13. . Взаимодействие с растворами солей Лабораторный опыт: взаимодействие металлов с солями. Налейте в пробирку раствор медного
- 14. . Выводы : . Вступают в реакцию с кислотами с учетом правил по положению металлов в
- 15. . Какие реакции практически осуществимы?
- 16. . Самопроверка
- 17. . Дополнительные задания. 1. Составьте уравнения реакций взаимодействия: а) натрия с серой; б) железа с раствором
- 18. Викторина Страница: Металлы. 1.Какой металл широко используется в электротехнике? 2.Какой металл используется для защиты стальных изделий
- 20. Скачать презентацию
















 Effect of anodizing parameters on growth of selfordering TiO2
Effect of anodizing parameters on growth of selfordering TiO2 Мұнайды өңдеудің химиялық процестерінің теориялық негіздері
Мұнайды өңдеудің химиялық процестерінің теориялық негіздері Аминокислоты
Аминокислоты Открытие Периодического закона
Открытие Периодического закона Химические свойства алкенов. Получение
Химические свойства алкенов. Получение Видалення забруднень органічного походження з поверхні тканини
Видалення забруднень органічного походження з поверхні тканини Строение атома, изотопы
Строение атома, изотопы 20230306_vodorod_ego_fizicheskie_svoystva
20230306_vodorod_ego_fizicheskie_svoystva Токсическое действие диоксинов и диоксиноподоных соединений
Токсическое действие диоксинов и диоксиноподоных соединений Analytical methods in modern research. Chromatography
Analytical methods in modern research. Chromatography Аномальные свойства воды – основа жизни на Земле
Аномальные свойства воды – основа жизни на Земле Алюміній. Загальна характеристика, властивості. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній. Загальна характеристика, властивості. Алюміній оксид, алюміній гідроксид, їх амфотерність Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги
Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги Железо, его физические и химические свойства
Железо, его физические и химические свойства Неомыляемые липиды. Изопреноиды
Неомыляемые липиды. Изопреноиды Тепловой эффект химических реакций
Тепловой эффект химических реакций Спирти. Феноли. Етери
Спирти. Феноли. Етери Химия переходных элементов IV – V группы
Химия переходных элементов IV – V группы Инструментальные методы исследования органических веществ
Инструментальные методы исследования органических веществ Зародження періодичної системи елементів Менделєєва
Зародження періодичної системи елементів Менделєєва Свойства воды
Свойства воды Коллигативные свойства растворов
Коллигативные свойства растворов Валентность и степень окисления
Валентность и степень окисления Спирты, фенолы, тиолы
Спирты, фенолы, тиолы Каталитический риформинг бензинов
Каталитический риформинг бензинов Вплив хімічних сполук на довкілля
Вплив хімічних сполук на довкілля Понятия про синтетические лекарственные средства
Понятия про синтетические лекарственные средства Волшебница - вода
Волшебница - вода