Содержание
- 2. Прогноз реакционной способности алкенов – наличие двойной связи позволяет отнести алкены к ненасыщенным соединениям. Превращение их
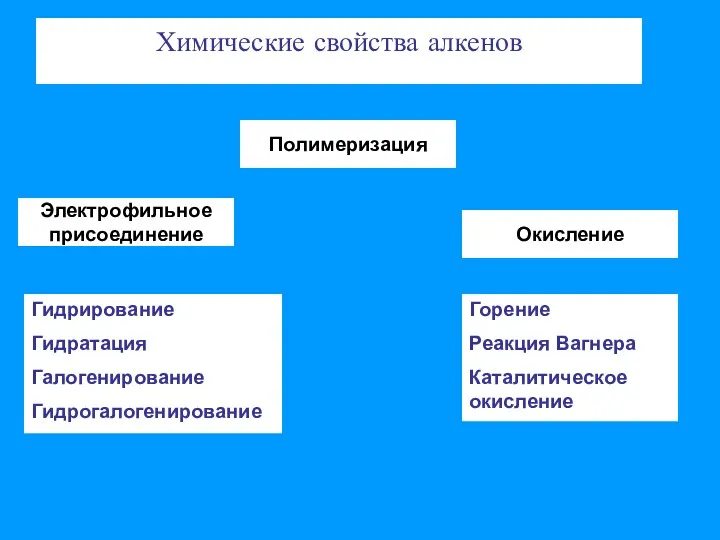
- 3. Химические свойства алкенов Электрофильное присоединение Полимеризация Окисление Гидрирование Гидратация Галогенирование Гидрогалогенирование Горение Реакция Вагнера Каталитическое окисление
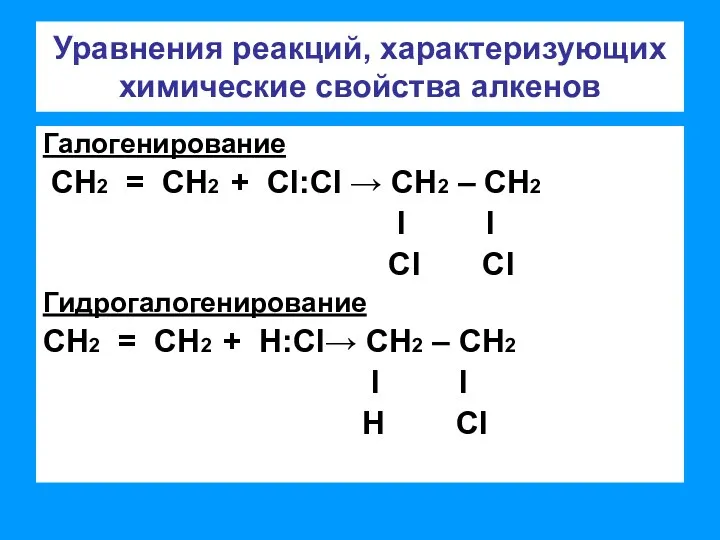
- 5. Уравнения реакций, характеризующих химические свойства алкенов Галогенирование СН2 = СН2 + CI:CI → СН2 – СН2
- 6. Качественная реакция на непредельные углеводороды (в т.ч. алкены) СН2 = СН2 + Br2 → СН2 –
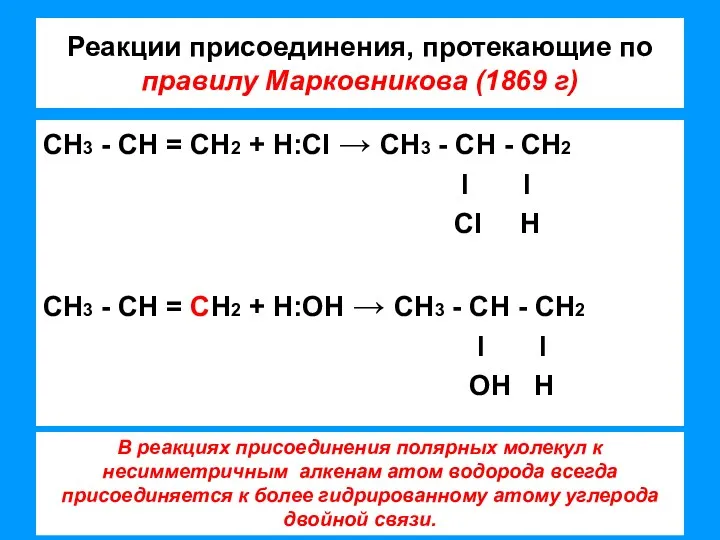
- 7. Реакции присоединения, протекающие по правилу Марковникова (1869 г) СН3 - СН = СН2 + Н:CI →
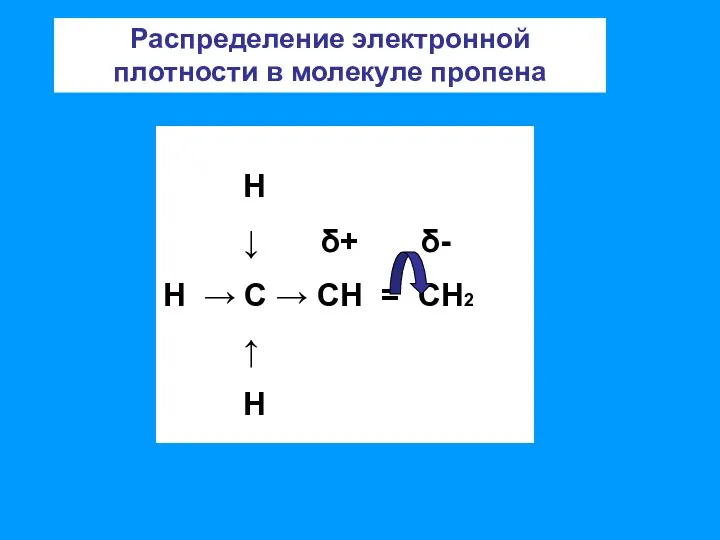
- 8. Н ↓ δ+ δ- Н → С → СН = СН2 ↑ Н Распределение электронной плотности
- 9. Уравнения реакций, характеризующих химические свойства алкенов Окисление Реакция Вагнера 3СН2 = СН2 + 4Н2О + 2KMnO4
- 10. Уравнения реакций, характеризующих химические свойства алкенов Каталитическое окисление В присутствии хлоридов меди и палладия: 2СН2 =
- 11. Уравнения реакций, характеризующих химические свойства алкенов Реакция полимеризации n(СН2 = СН2) → (- СН2 – СН2
- 12. Получение алкенов Промышленные способы 1. Крекинг алканов С8Н18 → С4Н8 + С4Н10 2. Дегидрирование алканов СН3-СН2-СН2-СН3
- 13. Получение алкенов Лабораторные способы Дегалогенирование галогенпроизводных алканов Дегидрогалогенирование галогенпроизводных алканов Дегидратация спиртов
- 15. Скачать презентацию








 Химические свойства алкенов
Химические свойства алкенов Фосфор и его соединения. 11 класс
Фосфор и его соединения. 11 класс Химиялық реакциялардың жылдамдығы
Химиялық реакциялардың жылдамдығы Химический дискуссионный клуб. Викторина
Химический дискуссионный клуб. Викторина Кислотность и основность органических соединений. (Лекция 3)
Кислотность и основность органических соединений. (Лекция 3) Супрамолекулярная химия - молекулярная социология
Супрамолекулярная химия - молекулярная социология Курс биохимии. Биохимия крови
Курс биохимии. Биохимия крови Карбонаты и гидрокарбонаты. Тест – экспресс
Карбонаты и гидрокарбонаты. Тест – экспресс Металдар арасындағы беттік керіліс
Металдар арасындағы беттік керіліс Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Кислород
Кислород Химия в повседневной жизни человека
Химия в повседневной жизни человека Дефекты в твердых телах
Дефекты в твердых телах Ауыр түсті металдар
Ауыр түсті металдар Катализ и катализаторы. (Лекция 10)
Катализ и катализаторы. (Лекция 10) Значение периодического закона и периодической системы Д.И. Менделеева
Значение периодического закона и периодической системы Д.И. Менделеева Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Реакции ионного обмена
Реакции ионного обмена В мире криссталлов
В мире криссталлов Жескость воды
Жескость воды Кристаллические решетки
Кристаллические решетки Простые вещества - неметаллы. 8 класс
Простые вещества - неметаллы. 8 класс Геохимия гранитоидов, зоны гипергенеза, осадочного процесса
Геохимия гранитоидов, зоны гипергенеза, осадочного процесса Комплексные соединения
Комплексные соединения Основные понятия, классификация, структура и свойства полимеров. (Лекция 1)
Основные понятия, классификация, структура и свойства полимеров. (Лекция 1) Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Франций (Francium)
Франций (Francium) Алкадиены: строение, номенклатура, гомологи, изомерия
Алкадиены: строение, номенклатура, гомологи, изомерия