Содержание
- 2. [Cu(NH3)4]SO4 Комплексными соединениями, или просто комплексами, мы будем называть и комплексные ионы, и комплексные молекулы. Комплексным
- 3. Наиболее удачно строение и свойства таких соединений объясняет координационная теория. Предложена в 1893 г. швейцарским химиком,
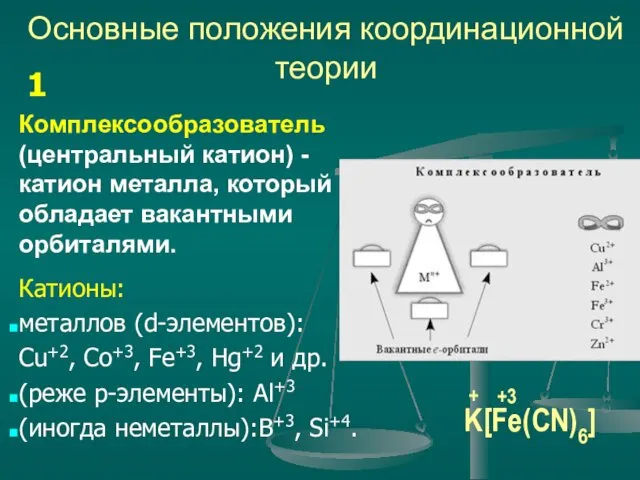
- 4. Основные положения координационной теории Комплексообразователь (центральный катион) - катион металла, который обладает вакантными орбиталями. Катионы: металлов
- 5. Вокруг комплексообразователя расположены лиганды – частицы, обладающие неподеленными электронными парами. Основные положения координационной теории 2. Молекулы:
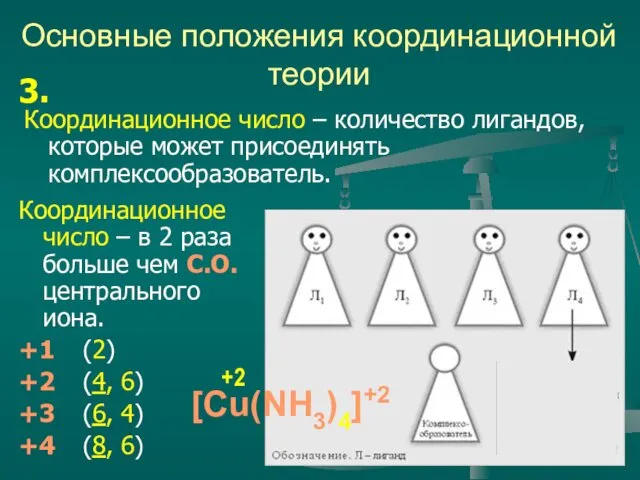
- 6. Основные положения координационной теории Координационное число – количество лигандов, которые может присоединять комплексообразователь. 3. Координационное число
- 7. Основные положения координационной теории Комплексообразователь и лиганды составляют внутреннюю сферу комплекса. 4. [Cu(NH3)4]+2 Как определить суммарный
- 8. РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na3[AlF6] Ответ: Na+3[Al+3F-6] K[MgCl3] Na[Al(OH)4] Na4[Fe(CN)6] Na3[Al(OH)6] [Cu(NH3)4]Cl2 Ответ: Na+[Al+3(OH)-4] Ответ:
- 9. СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Cu Cl +2 - [ [ [Cu(NH3)4]Cl2 КОМПЛЕКСООБРАЗОВАТЕЛЬ ЛИГАНДЫ КООРДИНАЦИОННОЕ ЧИСЛО - 4
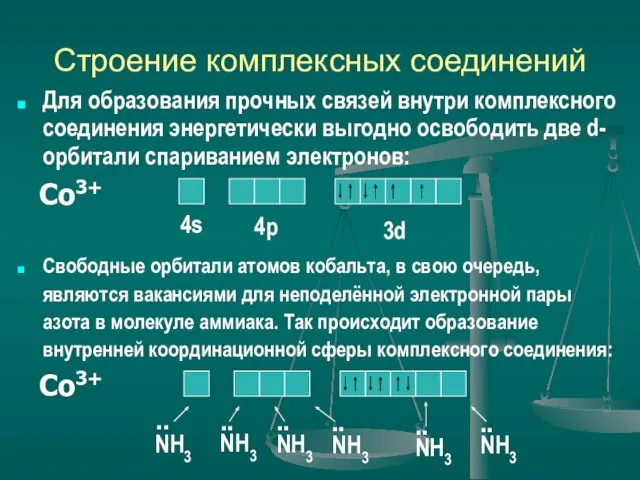
- 10. Строение комплексных соединений Координационные соединения образованы металлами побочных подгрупп, имеющими, как правило, незавершенный d - уровень.
- 11. Строение комплексных соединений Для образования прочных связей внутри комплексного соединения энергетически выгодно освободить две d-орбитали спариванием
- 12. Классификация комплексных соединений по заряду комплекса по виду лигандов по составу внешней сферы
- 13. Классификация По заряду комплекса [Cr(H2O)4]3+Cl3 [PtCl4(NH3)2] K2[PtCl6]2- [Cu(NH3)4]2+[PtCl4]2-
- 14. Классификация По составу внешней сферы H2[PtCl6] Na3[AlF6] [Pt(NH3)2Cl2] [Ag(NH3)2]OH
- 15. Классификация По виду лигандов [Fe(H2O)6]SO4 K[Au(CN)4] [Zn(NH3)4]Cl2 [CoCl(NH3)3(H2O)2](NO3)2
- 16. Комплексные соединения 11 класс естественнонаучный
- 17. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 2- 4- 3- 5- 6- ди- три- тетра- пента- гекса- ЧИСЛИТЕЛЬНЫЕ: НАЗВАНИЯ ЛИГАНДОВ:
- 18. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ НАЗВАНИЯ КОМПЛЕКСНЫХ АНИОНОВ: Fe - феррат Cu - купрат Ag - аргентат Au
- 19. тетра гидроксо цинкат НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2 4] (OH)- [Zn+2 натрия [Cr+3 (H2O)0 6] Cl-3 хлорид
- 20. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na3[AlF6] Na[Al(OH)4] K4[Fe(CN)6] Гексафтороалюминат натрия Тетрагидроксоалюминат натрия Гексационоферрат (II) калия
- 21. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH3)4]SO4 Сульфат тетраамминмеди (II) [Ag(NH3)2]Cl Хлорид диамминсеребра Хлорид гексааквахрома (III) [Cr(H2O)6]Cl3
- 22. Ответ: K2[PtCl6] Гексахлороплатинат (IV) калия Нитрат хлоронитротетраамминкобальта (III) Гексагидроксохромат (III) натрия СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ Ответ: [Co(NH3)4(NO2)Cl]NO3
- 23. Получение и свойства комплексных соединений Оборудование и посуда: пробирки планшет Реактивы: HCl, CuSO4, NH4OH, K3[Fe(CN)6], FeSO4,
- 24. Опыт № 1 ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Получение гидроксида тетраамминмеди (II) CuSO4+ NH4OH → Cu(OH)2 + 4NH3
- 25. [Cu(NH3)4](OH)2 CuSO4+NH4OH → Cu(OH)2↓+(NH4)2SO4 Cu(OH)2 + 4NH3 → Подсказка
- 26. Опыт №2. ХИМИЧЕСКИЕ СВОЙСТВА 1. Реакции по внешней сфере FeSO4+K3[Fe(CN)6]→ 2. Реакции с участием лигандов [Cu(NH3)4]SO4+
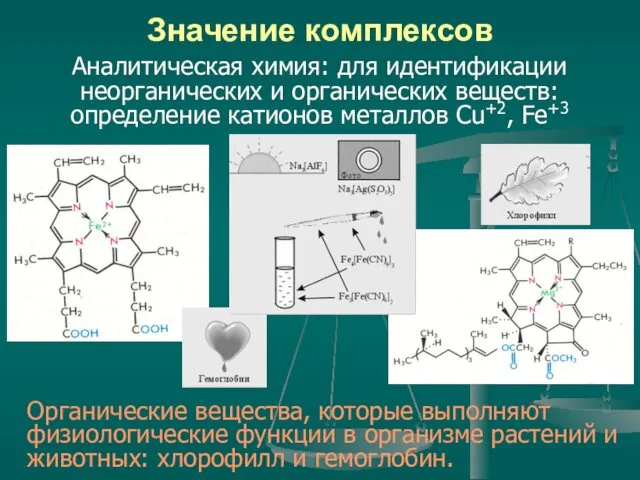
- 27. Значение комплексов Аналитическая химия: для идентификации неорганических и органических веществ: определение катионов металлов Cu+2, Fe+3 Органические
- 29. Скачать презентацию
![[Cu(NH3)4]SO4 Комплексными соединениями, или просто комплексами, мы будем называть и](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115678/slide-1.jpg)



![РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na3[AlF6] Ответ: Na+3[Al+3F-6] K[MgCl3] Na[Al(OH)4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115678/slide-7.jpg)
![СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Cu Cl +2 - [ [ [Cu(NH3)4]Cl2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115678/slide-8.jpg)


![Классификация По заряду комплекса [Cr(H2O)4]3+Cl3 [PtCl4(NH3)2] K2[PtCl6]2- [Cu(NH3)4]2+[PtCl4]2-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115678/slide-12.jpg)
![Классификация По составу внешней сферы H2[PtCl6] Na3[AlF6] [Pt(NH3)2Cl2] [Ag(NH3)2]OH](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115678/slide-13.jpg)
![Классификация По виду лигандов [Fe(H2O)6]SO4 K[Au(CN)4] [Zn(NH3)4]Cl2 [CoCl(NH3)3(H2O)2](NO3)2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115678/slide-14.jpg)


![тетра гидроксо цинкат НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2 4] (OH)- [Zn+2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115678/slide-18.jpg)
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na3[AlF6] Na[Al(OH)4] K4[Fe(CN)6] Гексафтороалюминат натрия Тетрагидроксоалюминат натрия Гексационоферрат (II) калия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115678/slide-19.jpg)
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH3)4]SO4 Сульфат тетраамминмеди (II) [Ag(NH3)2]Cl Хлорид диамминсеребра Хлорид гексааквахрома (III) [Cr(H2O)6]Cl3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115678/slide-20.jpg)
![Ответ: K2[PtCl6] Гексахлороплатинат (IV) калия Нитрат хлоронитротетраамминкобальта (III) Гексагидроксохромат (III)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115678/slide-21.jpg)


2 CuSO4+NH4OH → Cu(OH)2↓+(NH4)2SO4 Cu(OH)2 + 4NH3 → Подсказка](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115678/slide-24.jpg)
![Опыт №2. ХИМИЧЕСКИЕ СВОЙСТВА 1. Реакции по внешней сфере FeSO4+K3[Fe(CN)6]→](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115678/slide-25.jpg)
 Подгруппа серы и ее соединения
Подгруппа серы и ее соединения Галогены. Фтор, хлор, бром, йод, астат
Галогены. Фтор, хлор, бром, йод, астат Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD
Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD Строение и электрический заряд коллоидных частиц. Электрокинетические явления
Строение и электрический заряд коллоидных частиц. Электрокинетические явления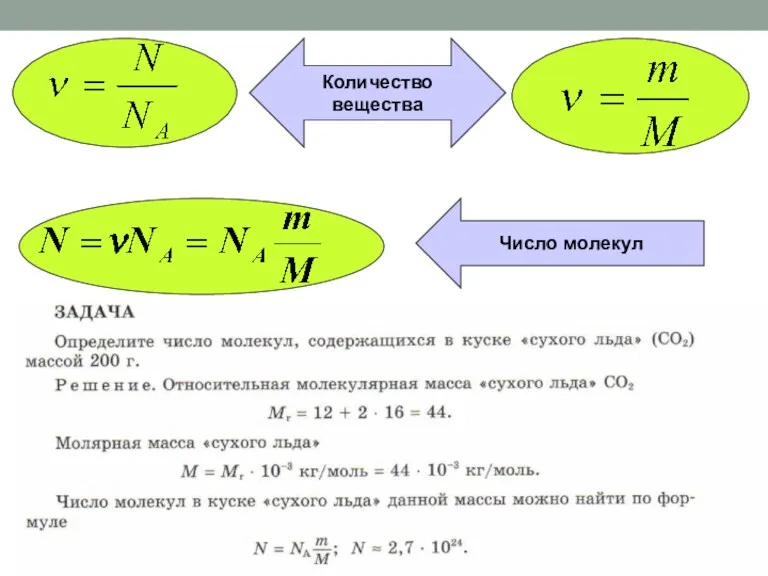 Количество вещества
Количество вещества Физические методы стабилизации масел
Физические методы стабилизации масел Химический элемент кремний
Химический элемент кремний Поверхностные явления. Типы поверхностных явлений
Поверхностные явления. Типы поверхностных явлений Нанотехнологии и Наноматериалы
Нанотехнологии и Наноматериалы Правила по технике безопасности в химической лаборатории
Правила по технике безопасности в химической лаборатории Железо, его физические и химические свойства. Урок химии в 9 классе
Железо, его физические и химические свойства. Урок химии в 9 классе Влияние газированных напитков на организм человека
Влияние газированных напитков на организм человека ПРИРОДНЫЕ ИСТОЧНИКИ УГЛЕВОДОРОДОВ
ПРИРОДНЫЕ ИСТОЧНИКИ УГЛЕВОДОРОДОВ Химический факультет
Химический факультет Химиялық элемент оттегі
Химиялық элемент оттегі Сплавы железа с углеродом: стали и чугуны
Сплавы железа с углеродом: стали и чугуны Ауыр металлдар
Ауыр металлдар ООО Ангарский Азотно-туковый завод. Основы производства аммиака
ООО Ангарский Азотно-туковый завод. Основы производства аммиака Основания. Номенклатура оснований
Основания. Номенклатура оснований Железо. Соединения железа
Железо. Соединения железа Біріншілік алкилсульфаттар және алкилэтоксисульфаттар немесе біріншілік спирттегі сульфоэфирдің тұздары. 4 Лекция
Біріншілік алкилсульфаттар және алкилэтоксисульфаттар немесе біріншілік спирттегі сульфоэфирдің тұздары. 4 Лекция Воздух и его состав
Воздух и его состав Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции
Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции Химия в повседневной жизни человека
Химия в повседневной жизни человека Главная подгруппа IV группы
Главная подгруппа IV группы Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Кинетика химических реакций. Химическое равновесие
Кинетика химических реакций. Химическое равновесие Свойства и биологическая роль карбонильных соединений
Свойства и биологическая роль карбонильных соединений