Содержание
- 2. [Cu(NH3)4]SO4 Комплексными соединениями, или просто комплексами, мы будем называть и комплексные ионы, и комплексные молекулы. Комплексным
- 3. [Co(NH3)6]3+ - комплекс [Co(NH3)6]Cl3 – комплексное соединение. Комплекс - центральный атом или ион (чаще всего металла),
- 4. Теорию комплексных соединений –(координационную теорию), разработал в 1893 г. швейцарский химик Альфред Вернер, который в 1913
- 5. Положения координационной теории Вернера в центре комплексного соединения находится центральный ион – комплексообразователь. Ионами –коплексообразователями являются
- 6. ОСНОВНЫЕ ПОЛОЖЕНИЯ КООРДИНАЦИОННОЙ ТЕОРИИ Комплексообразователь (центральный катион) - катион металла, который обладает вакантными орбиталями. Катионы: металлов
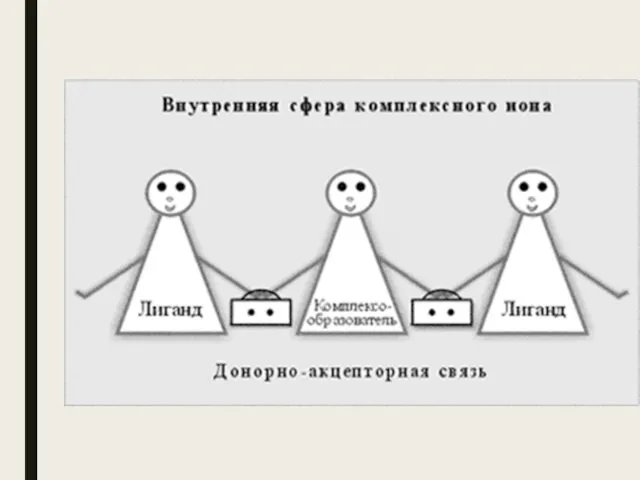
- 7. Вокруг центрального атома (иона-комплексообразователя) находятся противоположно заряженные ионы или нейтральные молекулы, которые называются лигандами (от латинского
- 8. Основные положения координационной теории Вокруг комплексообразователя расположены лиганды – частицы, обладающие неподеленными электронными парами. 2. Молекулы:
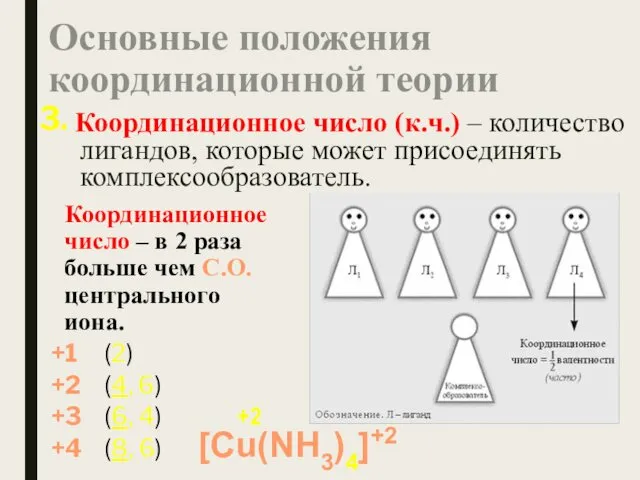
- 9. Основные положения координационной теории Координационное число (к.ч.) – количество лигандов, которые может присоединять комплексообразователь. 3. Координационное
- 11. Природа химической связи в комплексных соединениях Во внутренней сфере между комплексообразователем и лигандами существуют ковалентные связи,
- 12. Электронное строение атома бериллия Be Электронное строение атома Be в возбужденном состоянии Электронное строение атома Be
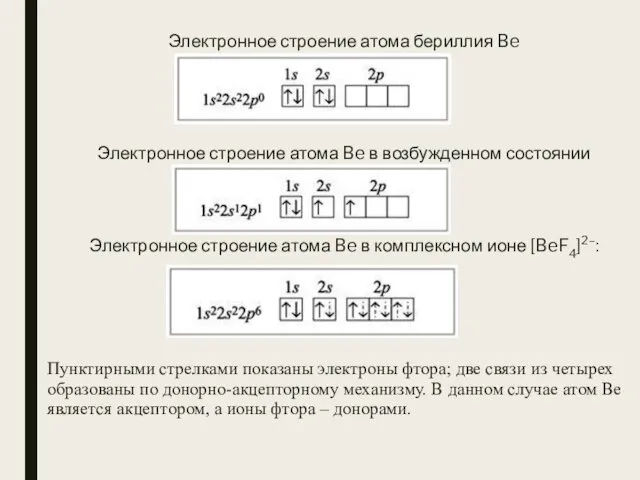
- 13. Донорно-акцепторный механизм: лиганд предоставляет электронную пару (основание Льюиса), а центральный атом вакантную орбиталь (кислота Льюиса). Координационные
- 14. Строение комплексных соединений. K3[Fe(CN)6] Ион- Комплексо- образователь Лиганды Координационное число Внутренняя сфера Внешняя сфера [Cu(NH3)4]Cl2 Внутренняя
- 15. Заряд комплексного иона равен алгебраической сумме зарядов иона-комплексообразователя и лигандов. 2+ 0 2+ 2- [Cu(NH3)4] SO4
- 16. ЦЕНТРАЛЬНЫЙ АТОМ (ц. а.) (ион-комплексообразователь) Чаще всего центральными атомами являются ионы металлов d-элементов: Cu, Ag, Pt,
- 17. Координационное число (к. ч.) Координационное число (к. ч.) не является неизменной величиной. Даже для одних и
- 18. Заряд центрального иона является основным фактором, влияющим на координационное число
- 19. чаще всего кч устойчивого комплекса в два раза больше степени окисления ц.а. КЧ = 2Z Эмпирическое
- 20. ЛИГАНДЫ Лигандами могут быть: нейтральные молекулы H2O, NH3, CO, карбамида (NH2)2CO, этилендиамина NH2CH2CH2NH2, α-аминоуксусной кислоты NH2CH2COOH,
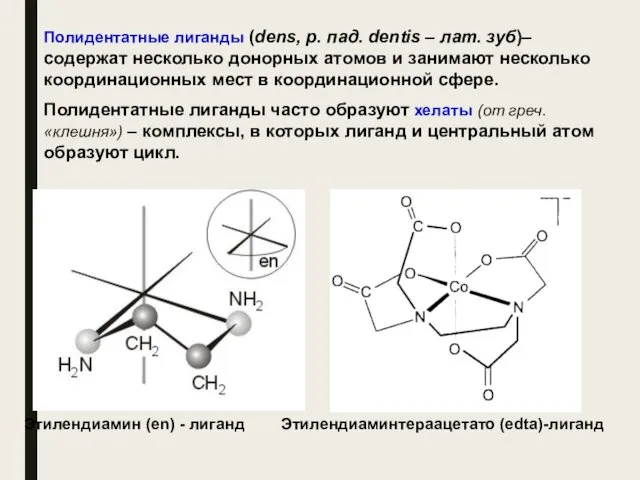
- 21. Дентатность лиганда определяется числом координационных мест, занимаемых лигандом в координационной сфере комплексообразователя. Различают монодентатные лиганды, занимающие
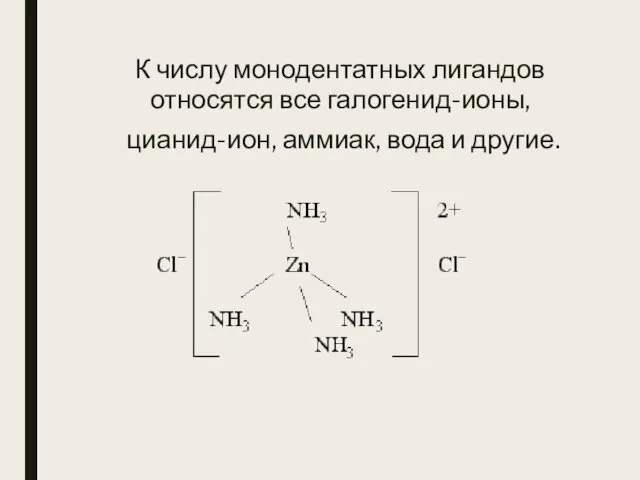
- 22. К числу монодентатных лигандов относятся все галогенид-ионы, цианид-ион, аммиак, вода и другие.
- 23. -монодентатные лиганды, содержат 1 донорный атом (H2 O, NH3, OH-, Cl-, Br-) Лат. dentalus – имеющий
- 24. Полидентатные лиганды (dens, р. пад. dentis – лат. зуб)– содержат несколько донорных атомов и занимают несколько
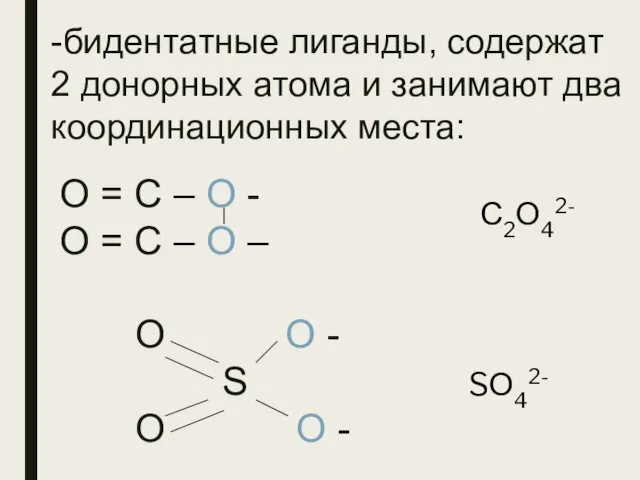
- 25. -бидентатные лиганды, содержат 2 донорных атома и занимают два координационных места: О = С – О
- 26. Существует целый ряд лигандов, которые в комплексах являются практически всегда бидентатными. Это этилендиамин, карбонат-ион, оксалат-ион и
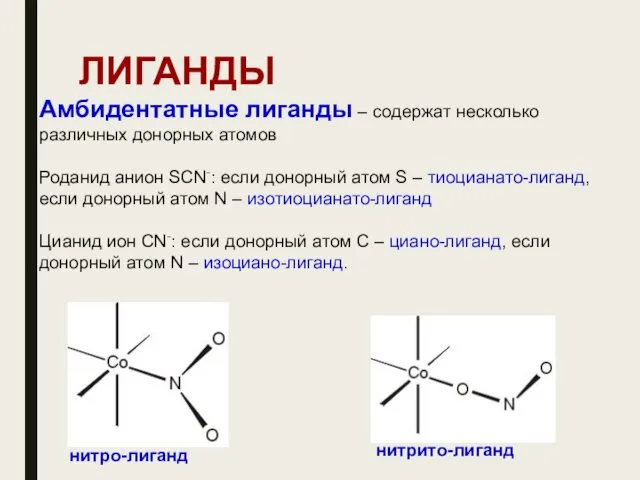
- 27. ЛИГАНДЫ Амбидентатные лиганды – содержат несколько различных донорных атомов Роданид анион SCN-: если донорный атом S
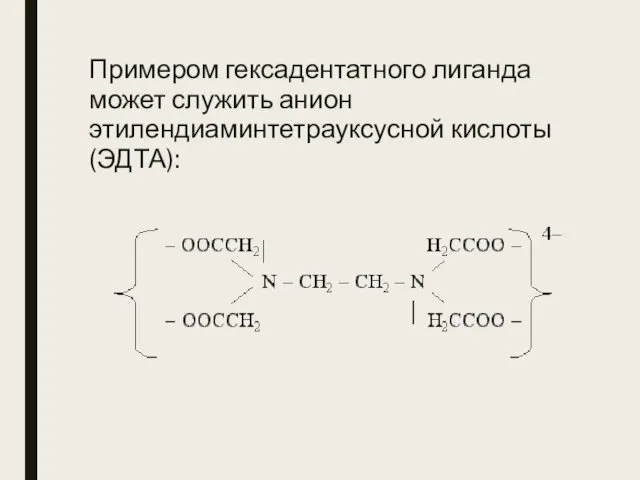
- 28. Примером гексадентатного лиганда может служить анион этилендиаминтетрауксусной кислоты (ЭДТА):
- 29. Номенклатура Основы современной номенклатуры комплексных соединений были заложены Альфредом Вернером. До его работ в этой области
- 30. Классификация и номенклатура комплексных соединений По характеру заряда внутренней сферы различают катионные, анионные и нейтральные комплексы.
- 31. Число лигандов – греч. числит. 1 – (моно) 2 – ди 3 – три 4 –
- 32. I. Номенклатура катионных комплексов Греческим числительным называют число лигандов: 1-моно, 2-ди, 3-три, 4-тетра, 5-пента, 6-гекса Называют
- 33. Примеры: [Cu(NH3)4]Cl2 Хлорид тетраамминмеди(II) I I H2O – аква NH3 – аммин Cl- – хлоро- NO2-
- 34. Примеры: [AgI(NH3)2]OH – гидроксид диамминсеребра(I); [CoIII(NH3)6]Cl3 – хлорид гексаамминкобальта(III); [Cr2III(OH)(NH3)2]Cl4 – хлорид нонаамминдигидроксодихрома(III).
- 35. II. Номенклатура анионных комплексов Греческим числительным называют число лигандов. Называют лиганды. Называют комплексообразователь латинским наименованием с
- 36. Примеры: K3[Fe(CN)6] Гексацианоферрат(III) калия III H2O – аква NH3 – аммин Cl- – хлоро- NO2- –
- 37. Ag – аргент- Au – аур- Cu – купр- Fe – ферр- Hg – меркур- Mn
- 38. III. Номенклатура нейтральных комплексов Греческим числительным называют число лигандов. Называют лиганды. Называют комплексообразователь русским наименованием. Валентность
- 39. Примеры: [Ni(CO)4] – тетракарбонилникель; [Co2(CO)8] – октакарбонилдикобальт; [Al2Cl6] – гексахлородиалюминий; [CoIIICl3(NH3)3] – триамминтрихлорокобальт; [CoII (NO2)2(H2O)4] –
- 40. По природе лиганда 1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3,
- 41. Аммиакаты (амины)
- 42. Аквакомплексы
- 43. 4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. K2[PtCl4], H2[CoCl4], H2[SiF6]. 5) Гидроксокомплексы —
- 44. Ацидо- и гидридокомплексы
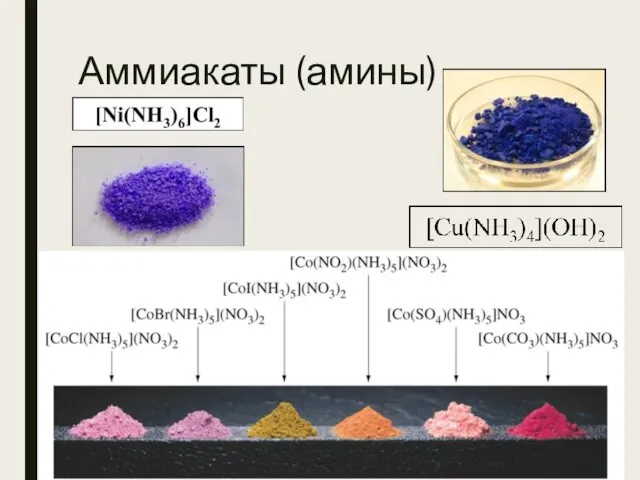
- 45. 7) Циклические (хелатные) комплексы содержат полидентантный лиганд, который захватывает центральный ион подобно клешням, образуя цикл. Между
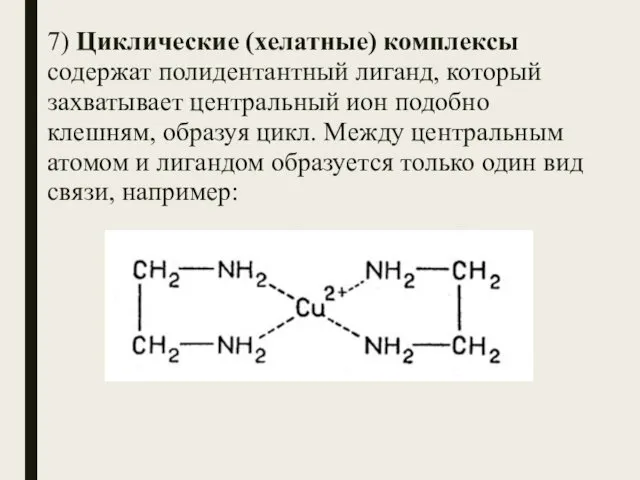
- 46. 8) Внутрикомплексные соединения – комплексы, в которых полидентантный лиганд образует с центральным атомом циклическое соединение за
- 47. Упражнение 1 дайте название комплексному соединению Первое основание Рейзе [Pt(NH3)4](OH)2 Соль Чугаева [Pt(NH3)5Cl]Cl3 Соль Цейзе K[PtCl3C2H4]
- 48. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ В РАСТВОРАХ
- 49. Химические свойства Комплексные соединения можно условно разделить на две большие группы: электролиты и неэлектролиты. К неэлектролитам
- 50. Комплексные соединения в растворах Первичная диссоциация комплексных соединений K3[Fe(CN)6] = 3K+ + [Fe(CN)6]3- [Cu(NH3)4]SO4 = [Cu(NH3)4]2+
- 51. Если во внешней сфере комплексного соединения находятся гидроксид-ионы, то это соединение – сильное основание (диссоциация идет
- 52. 2. Обратимая диссоциация комплексов. Комплексные ионы подвергаются обратимой электролитической диссоциации как слабые электролиты. [Ag(NH3)2]Cl → [Ag(NH3)2]+
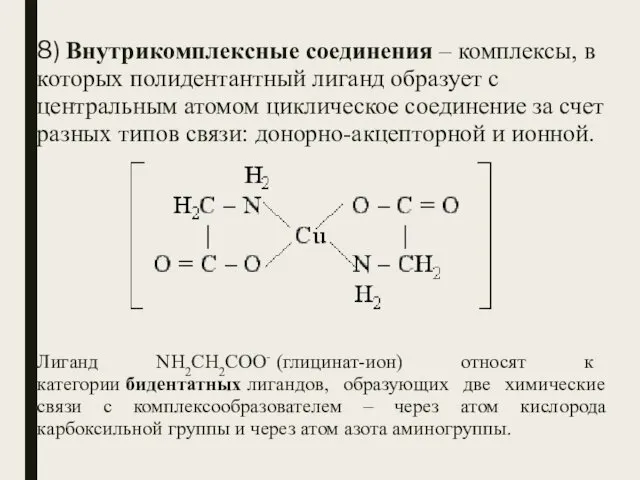
- 53. Применение Комплексные соединения играют большую роль в жизнедеятельности организмов, например, гемоглобин, хлорофилл являются комплексными соединениями.
- 54. Комплексные соединения используются для извлечения металлов из руд. Например, для отделения золота от породы руду обрабатывают
- 55. Для получения чистых железа, никеля, кобальта используют термическое разложение карбонилов металлов. Эти соединения - летучие жидкости,
- 56. K4[Fe(CN)6] - желтая кровяная соль, содержащий ион железа Fe2+, является реактивом на ионы железа Fe3+ в
- 57. K3[Fe(CN)6] - красная кровяная соль является реактивом на обнаружение ионов Fe2+ в растворе: 3Fe2+ + 2[Fe(CN)6]3-
- 58. Комплексные цианиды серебра K[Ag(CN)2] применяют для гальванического серебрения, так как при электролизе растворов обычных солей серебра
- 59. Таким образом, с использованием комплексных соединений связана возможность получения многообразных химических продуктов: лаков, красок, металлов, фотоматериалов,
- 60. Раздел дополнительных заданий
- 61. [Ag(NH3)2]OH – гидроксид диамминсеребра (I) [Ag(NH3)2]OH → [Ag(NH3)2]+ + OH– [Ag(NH3)2]+ ↔ Ag+ + 2 NH3
- 62. Na[Al(OH)4] – тетрагидроксоалюминат натрия Na[Al(OH)4] →Na+ + [Al(OH)4]– [Al(OH)4]– ↔ Al 3+ + 4 OH–
- 64. Скачать презентацию
![[Cu(NH3)4]SO4 Комплексными соединениями, или просто комплексами, мы будем называть и](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115679/slide-1.jpg)
![[Co(NH3)6]3+ - комплекс [Co(NH3)6]Cl3 – комплексное соединение. Комплекс - центральный](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115679/slide-2.jpg)







![Строение комплексных соединений. K3[Fe(CN)6] Ион- Комплексо- образователь Лиганды Координационное число](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115679/slide-13.jpg)













![Примеры: [Cu(NH3)4]Cl2 Хлорид тетраамминмеди(II) I I H2O – аква NH3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115679/slide-32.jpg)
![Примеры: [AgI(NH3)2]OH – гидроксид диамминсеребра(I); [CoIII(NH3)6]Cl3 – хлорид гексаамминкобальта(III); [Cr2III(OH)(NH3)2]Cl4 – хлорид нонаамминдигидроксодихрома(III).](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115679/slide-33.jpg)

![Примеры: K3[Fe(CN)6] Гексацианоферрат(III) калия III H2O – аква NH3 –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115679/slide-35.jpg)


![Примеры: [Ni(CO)4] – тетракарбонилникель; [Co2(CO)8] – октакарбонилдикобальт; [Al2Cl6] – гексахлородиалюминий;](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115679/slide-38.jpg)




2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115679/slide-46.jpg)


![Комплексные соединения в растворах Первичная диссоциация комплексных соединений K3[Fe(CN)6] =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115679/slide-49.jpg)




![K4[Fe(CN)6] - желтая кровяная соль, содержащий ион железа Fe2+, является](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115679/slide-55.jpg)
![K3[Fe(CN)6] - красная кровяная соль является реактивом на обнаружение ионов](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115679/slide-56.jpg)
![Комплексные цианиды серебра K[Ag(CN)2] применяют для гальванического серебрения, так как](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115679/slide-57.jpg)


![[Ag(NH3)2]OH – гидроксид диамминсеребра (I) [Ag(NH3)2]OH → [Ag(NH3)2]+ + OH– [Ag(NH3)2]+ ↔ Ag+ + 2 NH3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115679/slide-60.jpg)
![Na[Al(OH)4] – тетрагидроксоалюминат натрия Na[Al(OH)4] →Na+ + [Al(OH)4]– [Al(OH)4]– ↔ Al 3+ + 4 OH–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115679/slide-61.jpg)
 Kарбонові кислоти. Гетерофункціональні похідні карбонових кислот
Kарбонові кислоти. Гетерофункціональні похідні карбонових кислот Хімічні властивості карбонових кислот
Хімічні властивості карбонових кислот Железоуглеродистые сплавы
Железоуглеродистые сплавы Введение в общеобразовательную научную дисциплину Химия
Введение в общеобразовательную научную дисциплину Химия Классификация минералов в соответствии с систематикой, утвержденной IMA
Классификация минералов в соответствии с систематикой, утвержденной IMA Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения
Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения Автомобильные бензины
Автомобильные бензины Фенол и его свойства. (10 класс)
Фенол и его свойства. (10 класс) Классификация химических реакций
Классификация химических реакций Обмен липидов. Классификация липидов
Обмен липидов. Классификация липидов Калій. Знаходження в періодичній системі і основні характеристики
Калій. Знаходження в періодичній системі і основні характеристики Жидкое и растворимое стекло
Жидкое и растворимое стекло Химическая связь
Химическая связь Геохимия магматического процесса
Геохимия магматического процесса Кристаллография и основы кристаллохимии. Лекция 8
Кристаллография и основы кристаллохимии. Лекция 8 Кремний в природе. Использование кремнезема для производства стекла. 9 класс
Кремний в природе. Использование кремнезема для производства стекла. 9 класс Электролитическая диссоциация. Гидролиз
Электролитическая диссоциация. Гидролиз Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы
Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы Стереоизомерия. Изомерия. Пространственная (стереоизомерия) углеродного скелета
Стереоизомерия. Изомерия. Пространственная (стереоизомерия) углеродного скелета Cromatografie de lichide de inalta performanta cuplata cu spectrometrie de masă
Cromatografie de lichide de inalta performanta cuplata cu spectrometrie de masă Получение и применение альдегидов
Получение и применение альдегидов Аминокислоты. Химические свойства
Аминокислоты. Химические свойства Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Оксиды. Химические свойства. Способы получения
Оксиды. Химические свойства. Способы получения Типы химических реакций. Опыты
Типы химических реакций. Опыты Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Буферное кислотно - основное взаимодействие
Буферное кислотно - основное взаимодействие