Содержание
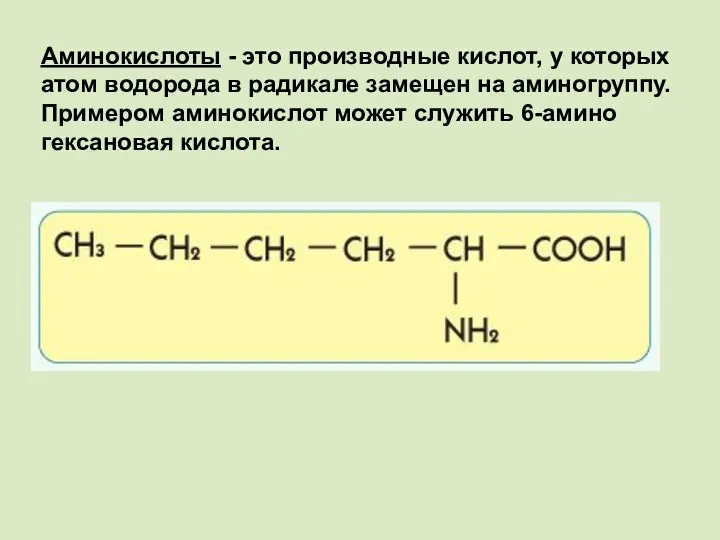
- 2. Аминокислоты - это производные кислот, у которых атом водорода в радикале замещен на аминогруппу. Примером аминокислот
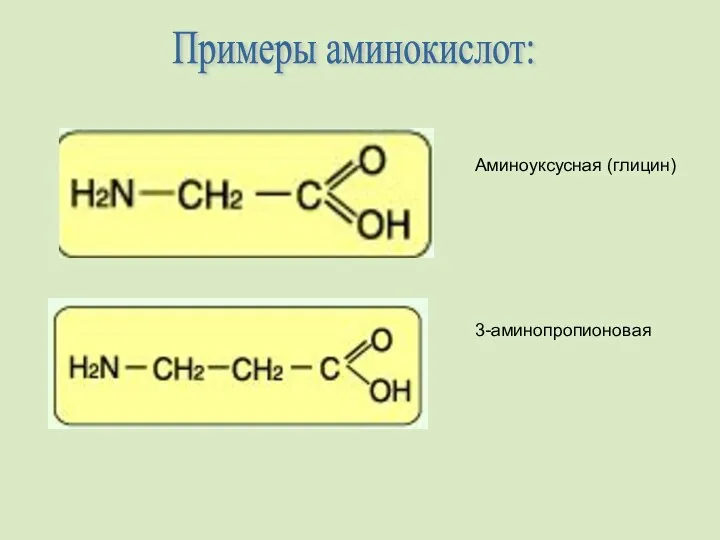
- 3. Примеры аминокислот: Аминоуксусная (глицин) 3-аминопропионовая
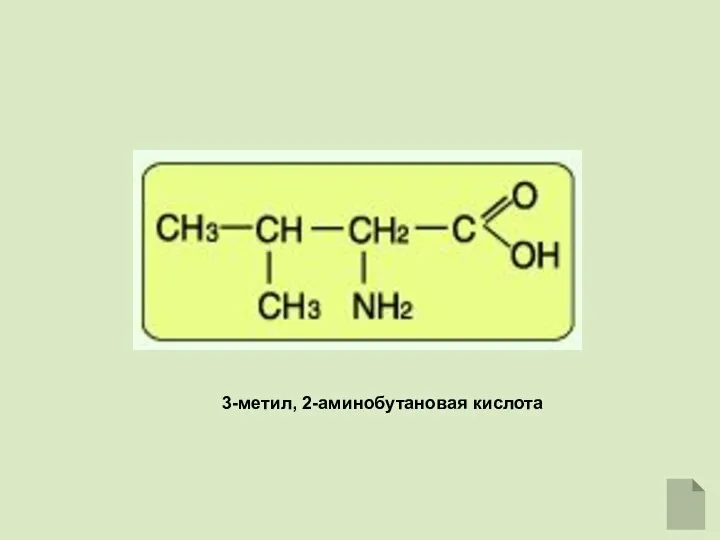
- 4. 3-метил, 2-аминобутановая кислота
- 5. Изомерия углеродного скелета: CH3 ⏐ CH3 ⎯ CH2 ⎯CH ⎯COOH CH3 ⎯ C ⎯COOH ⏐ ⏐
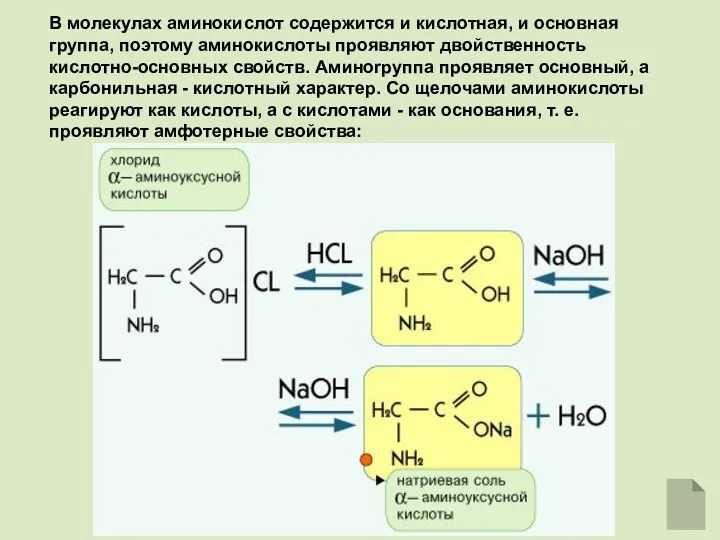
- 6. В молекулах аминокислот содержится и кислотная, и основная группа, поэтому аминокислоты проявляют двойственность кислотно-основных свойств. Аминоrpyппa
- 7. Аминокислоты проявляют свойства оснований за счет аминогруппы и свойства кислот за счет карбоксильной группы, т.е. являются
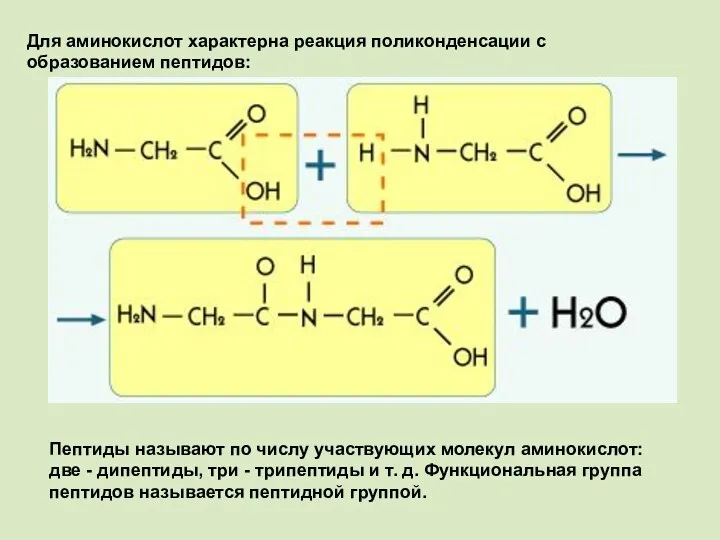
- 8. Для аминокислот характерна реакция поликонденсации с образованием пептидов: Пептиды называют по числу участвующих молекул аминокислот: две
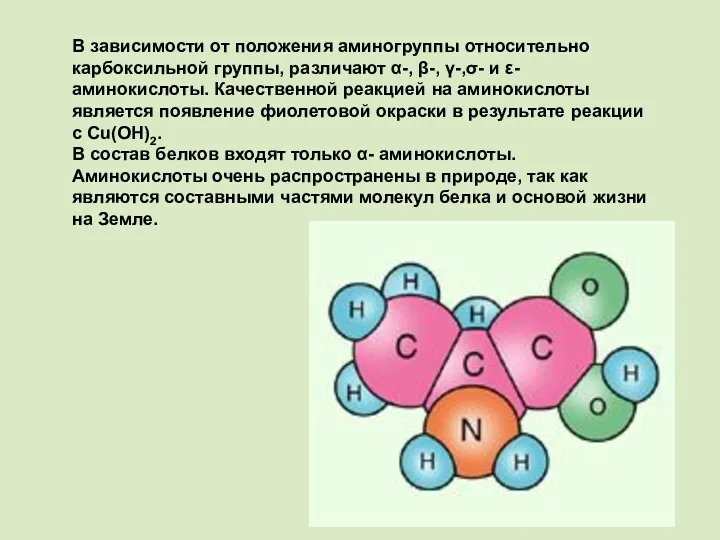
- 9. В зависимости от положения аминогруппы относительно карбоксильной группы, различают α-, β-, γ-,σ- и ε-аминокислоты. Качественной реакцией
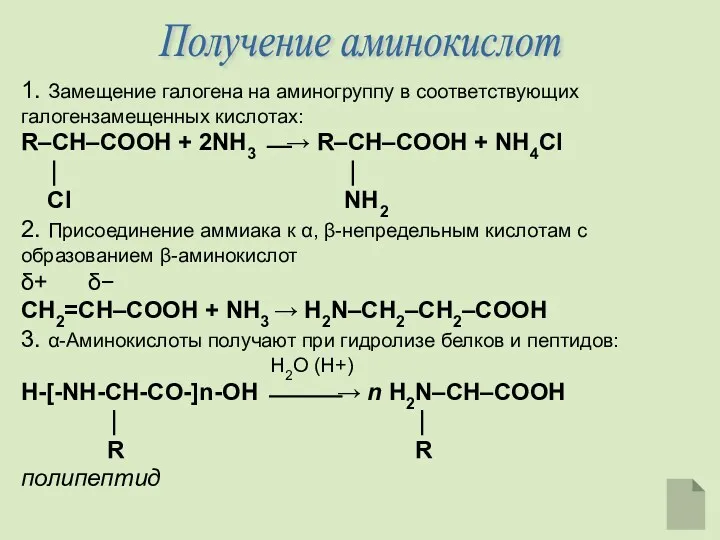
- 10. Получение аминокислот 1. Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах: R–CH–COOH + 2NH3 ⎯→ R–CH–COOH
- 11. ТЕСТ Вопросы для проверки знаний Какие вещества относят к аминокислотам? Какие виды изомерии есть у аминокислот?
- 13. Скачать презентацию



 Медико-биологическое значение неметаллов. Йод
Медико-биологическое значение неметаллов. Йод Побочная подгруппа 6 и 7 групп
Побочная подгруппа 6 и 7 групп Биохимия и молекулярная биология. Биосинтез мембранных липидов. Лекция 9
Биохимия и молекулярная биология. Биосинтез мембранных липидов. Лекция 9 Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу
Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Классификация химических реакций в неорганической химии
Классификация химических реакций в неорганической химии Алюминий и его сплавы
Алюминий и его сплавы Азотистые гетероциклические соединения
Азотистые гетероциклические соединения От алхимии к химии
От алхимии к химии Витамины молока и молочных продуктов. Жирорастворимые витамины
Витамины молока и молочных продуктов. Жирорастворимые витамины Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Алюминий. Группы элементов
Алюминий. Группы элементов Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Сера и ее важнейшие соединения
Сера и ее важнейшие соединения Разделение неоднородных систем
Разделение неоднородных систем Carbohydrate metabolism
Carbohydrate metabolism Окислительновосстановительные реакции (ОВР)
Окислительновосстановительные реакции (ОВР) Номенклатура органических соединений
Номенклатура органических соединений Железо, его физические и химические свойства. Урок химии в 9 классе
Железо, его физические и химические свойства. Урок химии в 9 классе Урок + презентация Азот. 9 класс.
Урок + презентация Азот. 9 класс. Регуляция и патология липидного обмена
Регуляция и патология липидного обмена Класифікація та властивості оксидів
Класифікація та властивості оксидів Взрывоопасные грузы
Взрывоопасные грузы Кремний. Основные минералы кремния
Кремний. Основные минералы кремния Исследование процесса диффузии на примере движения частиц в жидкостях и газах
Исследование процесса диффузии на примере движения частиц в жидкостях и газах Непредельные углеводороды: этилен
Непредельные углеводороды: этилен Перегонка с водяным паром
Перегонка с водяным паром Благородные газы
Благородные газы