Содержание
- 2. Очень древний я металл, Счёт столетьям потерял. Был нескромным я не в меру, Тысячи лет до
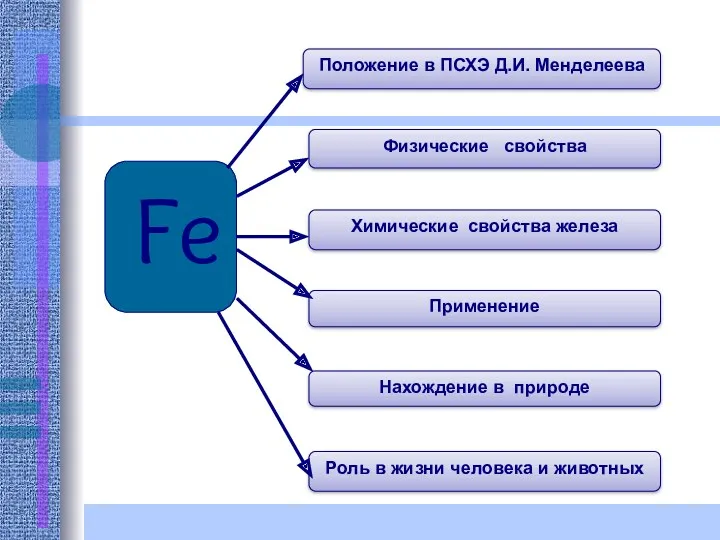
- 3. Fe Нахождение в природе Роль в жизни человека и животных Положение в ПСХЭ Д.И. Менделеева Физические
- 4. Железо, его физические и химические свойства
- 5. Положение элемента – железа в периодической системе Д.И. Менделеева. Порядковый номер Период Группа Подгруппа 26 Четвертый
- 6. Строение атома железа Число протонов 26 Число нейтронов 30 Число электронов 26 Расположение электронов по энергетическим
- 7. 1s2 2s2 2р6 3s2 3р6 3d6 4s2 Какие электроны для элементов главных подгрупп являются валентными? А
- 8. Почему из такого количества металлов побочных подгрупп для изучения выбрали один- именно железо ? Наиболее широко
- 9. Физические свойства железа: Цвет Блеск Пластичность Магнитные свойства Температура плавления Твердость Серебристо-белый Блестящий Очень пластичный, легко
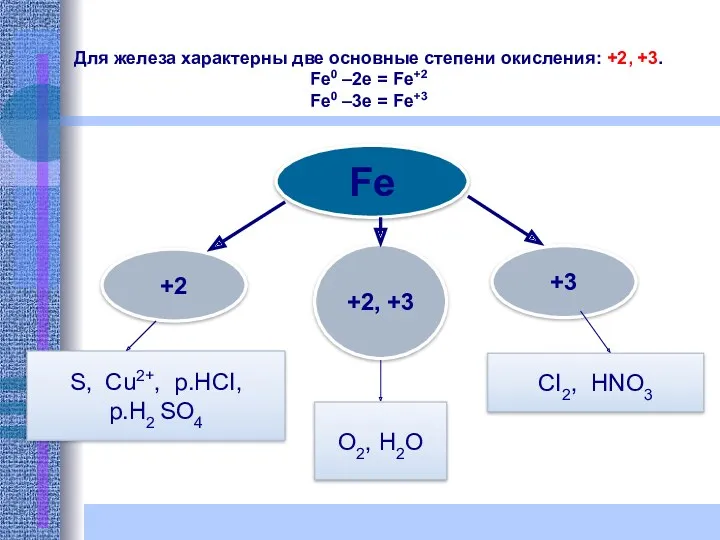
- 10. Fe +3 +2 +2, +3 O2, H2O CI2, HNO3 S, Cu2+, p.HCI, p.H2 SO4 Для железа
- 11. Химические свойства железа Взаимодействие с простыми веществами -неметаллами 1) С кислородом. 0 0 +2, +3 -2
- 13. Химические свойства железа Взаимодействие с простыми веществами - неметаллами. 2) С серой и хлором. Запишите уравнение
- 15. Химические свойства железа Взаимодействие со сложными веществами 1) с водой. +2, +3 3Fe0 + 4H2O —>
- 16. Лабораторные опыты «Взаимодействие железа с растворами кислот и солей» Оборудование: Fe, раствор HCl, раствор CuSO4, штатив,
- 17. Химические свойства железа 2) с кислотами. ОПЫТ: осуществите реакцию между железом и соляной кислотой. В каком
- 18. Fe + 2HCl —>FeCl2 + H2 Металлы взаимодействуют с кислотами если: 1. Металл находится в ряду
- 19. Химические свойства железа 3) С солями. ОПЫТ: осуществите реакцию между железом и раствором хлорида меди (II).
- 20. Fe + CuCl2 —> FeCl2 + Cu Металлы взаимодействуют с растворами солей если: 1. Каждый металл
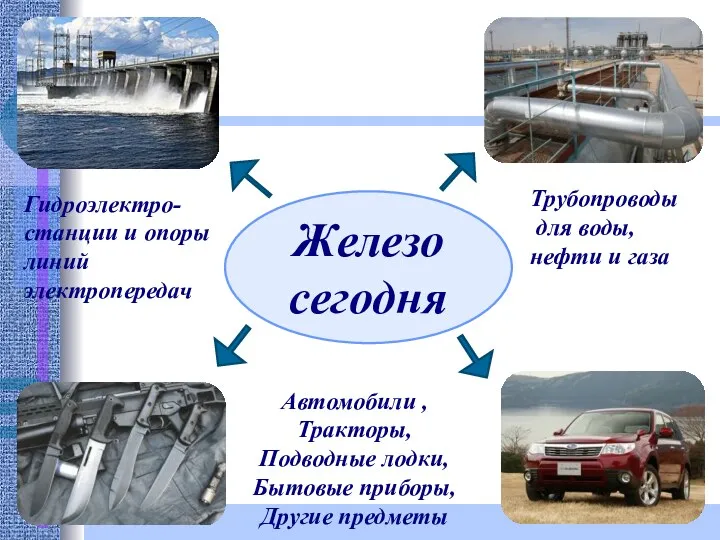
- 21. Железо сегодня Гидроэлектро- станции и опоры линий электропередач Трубопроводы для воды, нефти и газа Автомобили ,
- 22. Лабораторные опыты «Ознакомление с образцами природных соединений железа» Оборудование: природные образцы, вода, стакан, стеклянная палочка.
- 23. Природные соединения железа: Fe3O4 – магнитный железняк Fe2O3 – красный железняк (гематит) 2Fe2O3 * 3H2O –
- 24. Способы получения железа восстановление железа из его оксида оксидом углерода или водородом; Fe2O3 + 3CO →
- 26. ЖЕЛЕЗО В ОРГАНИЗМЕ Железо в виде ионов присутствует в организмах всех животных и, конечно же, человека.
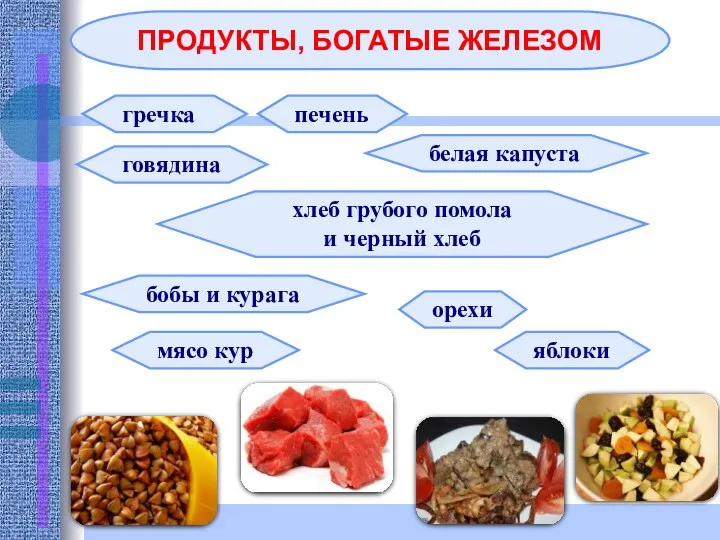
- 27. гречка говядина печень белая капуста хлеб грубого помола и черный хлеб бобы и курага орехи мясо
- 28. При анемии, для приготовления пищи, рекомендуется использовать чугунную посуду. Как показали эксперименты, приготовление и кипячение соуса
- 30. Скачать презентацию























 Фосфор и его соединения
Фосфор и его соединения Химиялық байланыс және заттардың құрылымдық түрлі сатылары
Химиялық байланыс және заттардың құрылымдық түрлі сатылары Дистилляция и ректификация
Дистилляция и ректификация Металлы и их соединения
Металлы и их соединения Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение
Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение Кислородосодержащие производные углеводородов. Спирты. Фенолы. Простые эфиры
Кислородосодержащие производные углеводородов. Спирты. Фенолы. Простые эфиры Углеводы
Углеводы Металлическая связь
Металлическая связь Карбоновые кислоты. (Лекция 6.3)
Карбоновые кислоты. (Лекция 6.3) Стирка по научному
Стирка по научному Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов)
Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов) Спирты. Классификация, номенклатура, изомерия спиртов
Спирты. Классификация, номенклатура, изомерия спиртов Строение атома
Строение атома Углеводы, монозы, биозы. Лекция 15
Углеводы, монозы, биозы. Лекция 15 Атом – сложная частица
Атом – сложная частица Элементы пятой-А группы. Азот и фосфор
Элементы пятой-А группы. Азот и фосфор Идеальные и реальные кристаллы
Идеальные и реальные кристаллы Электрохимические процессы
Электрохимические процессы Ядерное топливо
Ядерное топливо Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность Палладий. История открытия химических веществ
Палладий. История открытия химических веществ Качественные реакции
Качественные реакции 20230219_prezentatsiya_k_uroku_neft
20230219_prezentatsiya_k_uroku_neft Аминокислоты, как структурные компоненты белков
Аминокислоты, как структурные компоненты белков Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Основи. Фізичні властивості основ
Основи. Фізичні властивості основ Внеклассное мероприятие по химии. 9 класс
Внеклассное мероприятие по химии. 9 класс Водород. Характеристика положения водорода в ПСХЭ, строение атома и молекулы (8 класс)
Водород. Характеристика положения водорода в ПСХЭ, строение атома и молекулы (8 класс)