Содержание
- 2. Углеводы – органические соединения, содержащие в молекулах карбонильную (альдегидную или кето-) группу и 1 или несколько
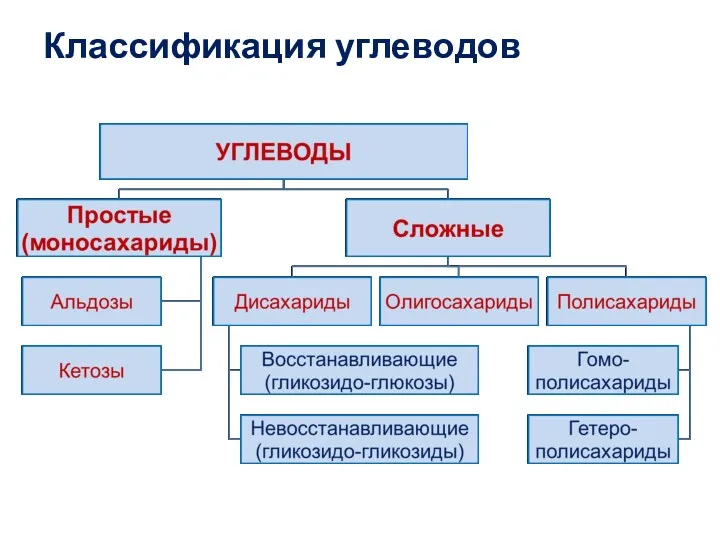
- 3. Классификация углеводов
- 4. Моносахариды
- 5. Классификация моносахаридов По природе карбонильной группы Полигидроксиальдегиды – альдозы Полигидроксикетоны – кетозы По длине углеродной цепи
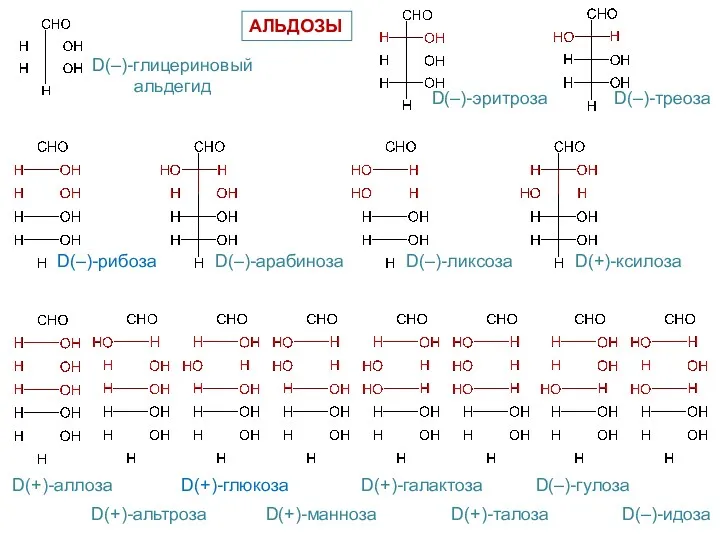
- 6. D(–)-глицериновый альдегид D(–)-эритроза D(–)-треоза D(–)-рибоза D(–)-арабиноза D(–)-ликсоза D(+)-ксилоза D(+)-аллоза D(+)-альтроза D(+)-глюкоза D(+)-манноза D(+)-галактоза D(+)-талоза D(–)-гулоза D(–)-идоза
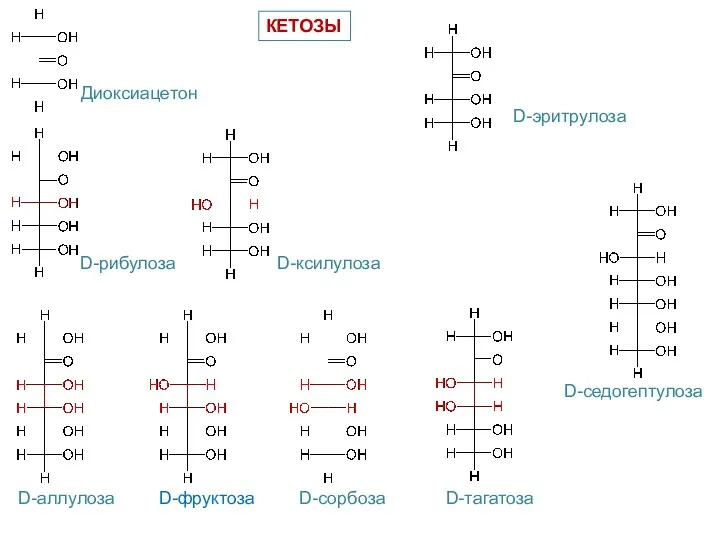
- 7. Диоксиацетон D-эритрулоза КЕТОЗЫ D-рибулоза D-ксилулоза D-аллулоза D-фруктоза D-сорбоза D-тагатоза D-седогептулоза
- 8. Стереоизомерия моносахаридов Несколько центров хиральности ⇒ большое число стереоизомеров НОСН2(*СНОН)4СНО – 24 (16) стереоизомеров, т. е.
- 9. Диастереомеры имеют одинаковое химическое строение, но отличаются конфигурацией одного или нескольких асимметрических атомов С Диастереомеры, различающиеся
- 10. Циклические формы А. А. Колли (1870), Б. Толленс (1883) По химической природе – циклические полуацетали Прохиральный
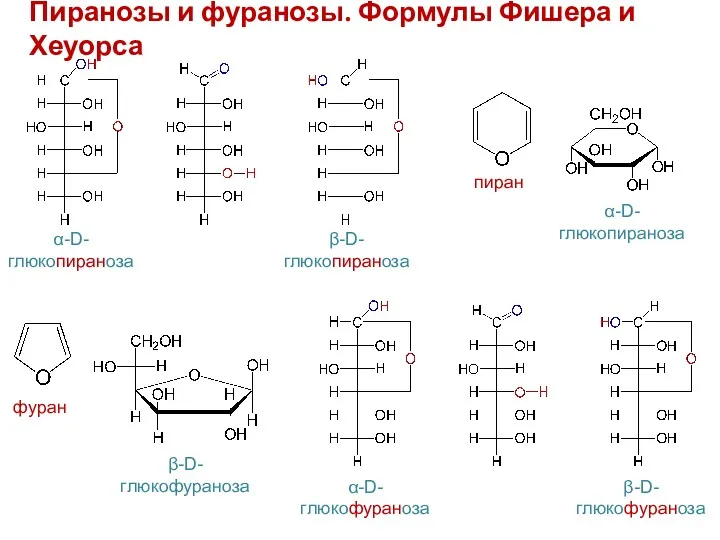
- 11. Пиранозы и фуранозы. Формулы Фишера и Хеуорса α-D- глюкопираноза β-D- глюкопираноза α-D- глюкофураноза β-D- глюкофураноза пиран
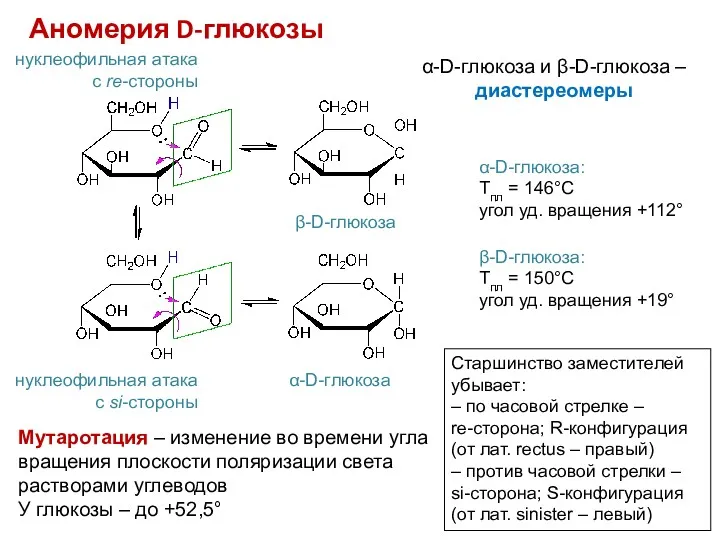
- 12. Аномерия D-глюкозы нуклеофильная атака с re-стороны нуклеофильная атака с si-стороны α-D-глюкоза β-D-глюкоза Старшинство заместителей убывает: –
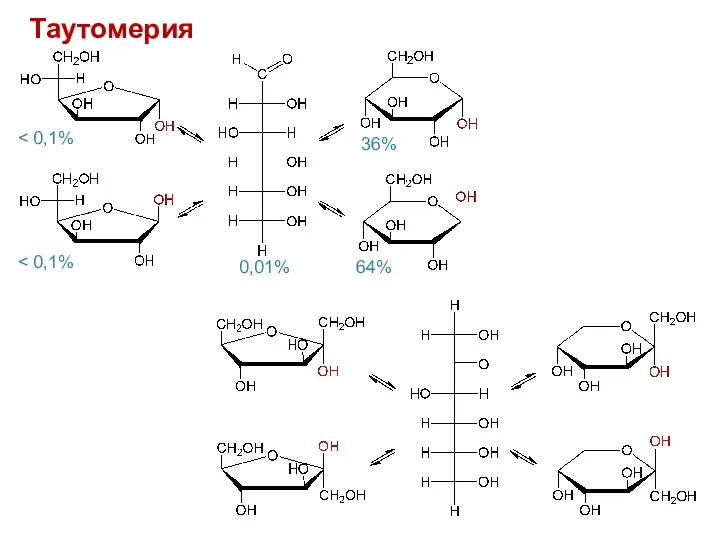
- 13. Таутомерия 0,01% 36% 64%
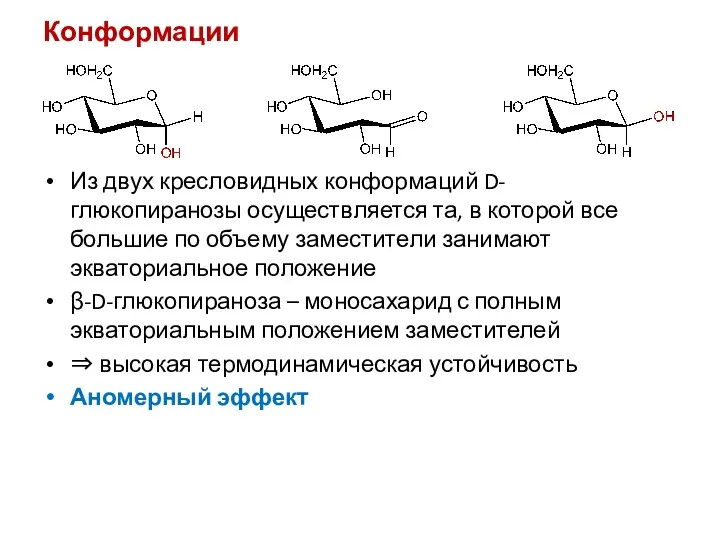
- 14. Конформации Из двух кресловидных конформаций D-глюкопиранозы осуществляется та, в которой все большие по объему заместители занимают
- 15. Методы получения Из природных соединений Фотосинтез nCO2 + mH2O → (CH2O)n + pO2 Гидролиз природных полисахаридов
- 16. Свойства Твердые вещества Легко растворимы в воде, плохо – в спирте, нерастворимы в эфире Водные растворы
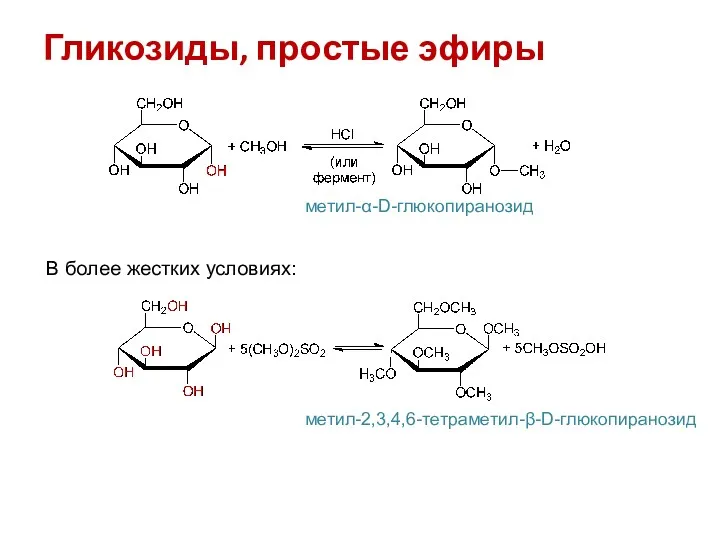
- 17. Гликозиды, простые эфиры метил-α-D-глюкопиранозид В более жестких условиях: метил-2,3,4,6-тетраметил-β-D-глюкопиранозид
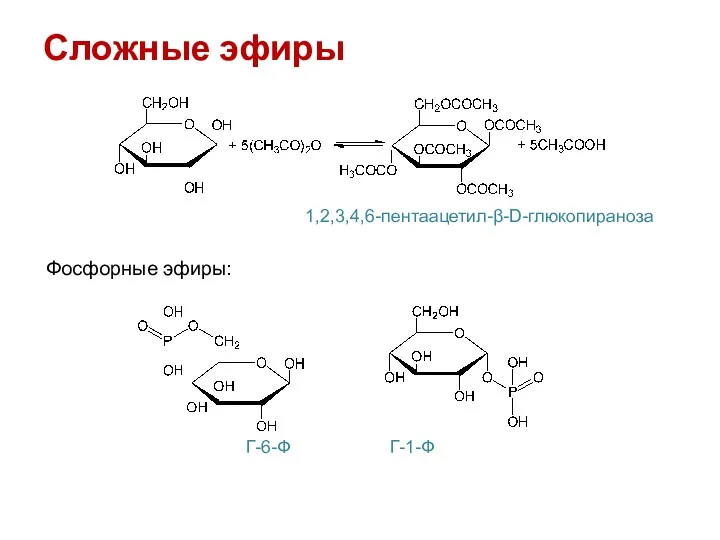
- 18. Сложные эфиры 1,2,3,4,6-пентаацетил-β-D-глюкопираноза Фосфорные эфиры: Г-6-Ф Г-1-Ф
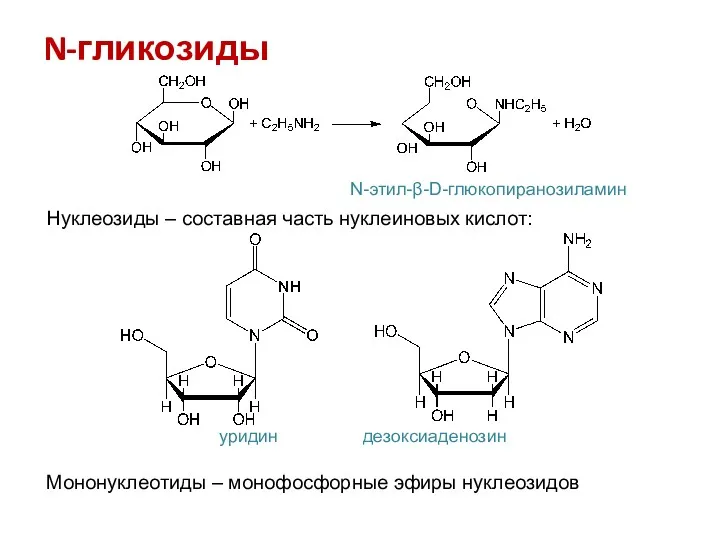
- 19. N-гликозиды N-этил-β-D-глюкопиранозиламин Нуклеозиды – составная часть нуклеиновых кислот: уридин дезоксиаденозин Мононуклеотиды – монофосфорные эфиры нуклеозидов
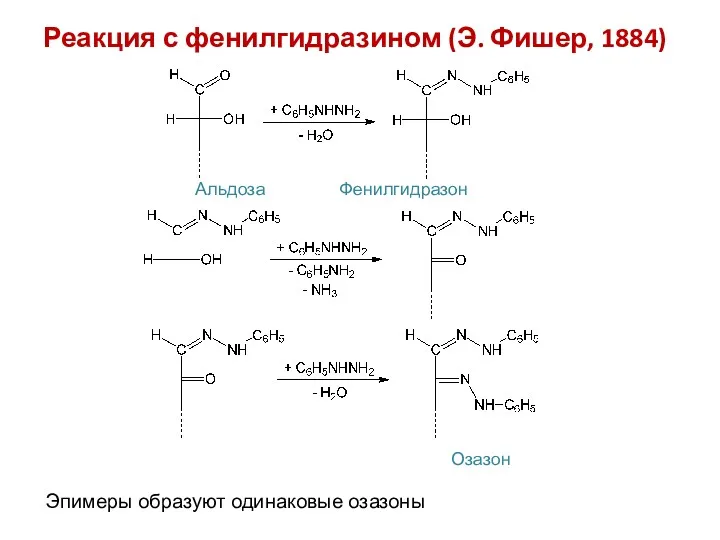
- 20. Реакция с фенилгидразином (Э. Фишер, 1884) Альдоза Фенилгидразон Эпимеры образуют одинаковые озазоны Озазон
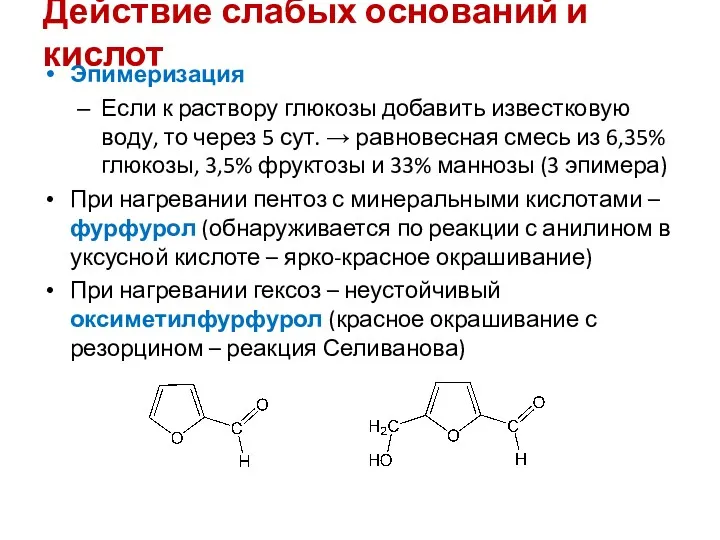
- 21. Действие слабых оснований и кислот Эпимеризация Если к раствору глюкозы добавить известковую воду, то через 5
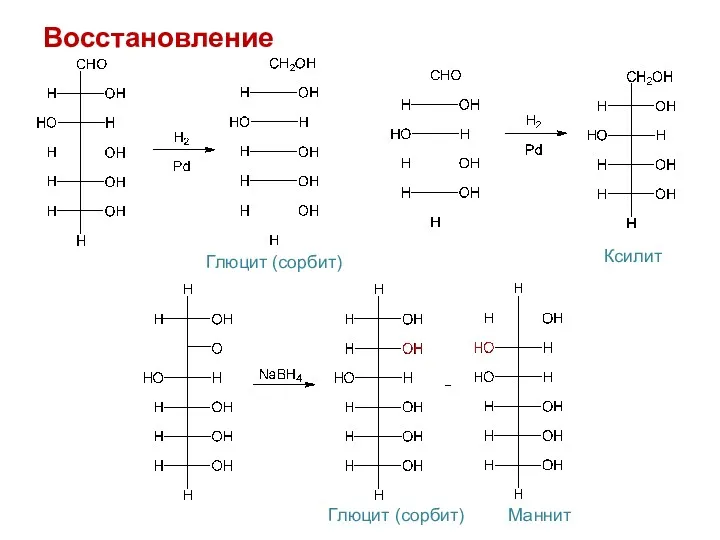
- 22. Восстановление Глюцит (сорбит) Ксилит Глюцит (сорбит) Маннит
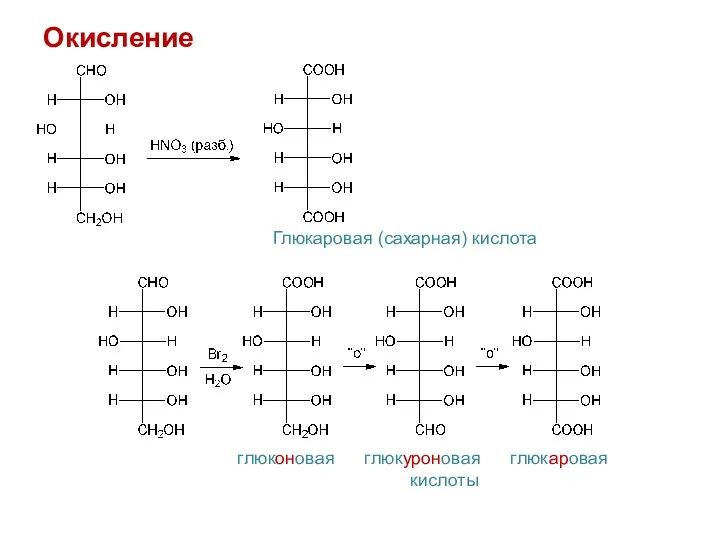
- 23. Окисление В щелочной среде Реакция "серебряного зеркала" с реактивом Толленса ([Ag(NH3)2]OH) Окисление реактивом Бенедикта или реактивом
- 24. Окисление Глюкаровая (сахарная) кислота глюконовая глюкуроновая глюкаровая кислоты
- 25. Восстанавливающие дисахариды (гликозидо-глюкозы)
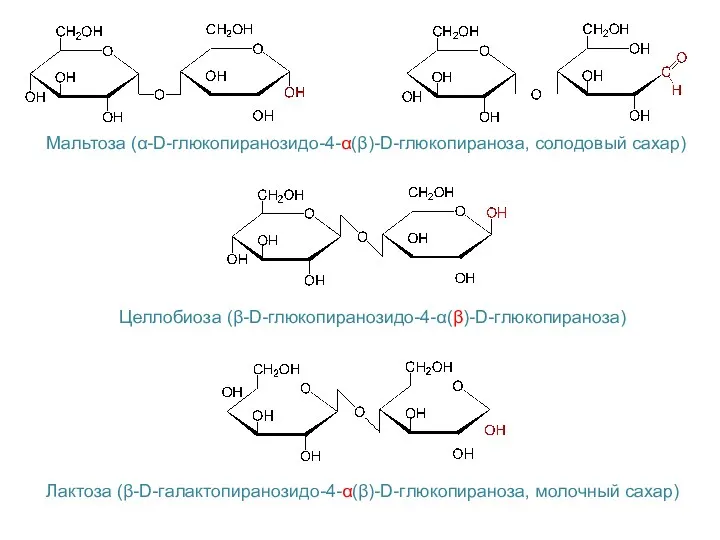
- 26. Мальтоза (α-D-глюкопиранозидо-4-α(β)-D-глюкопираноза, солодовый сахар) Целлобиоза (β-D-глюкопиранозидо-4-α(β)-D-глюкопираноза) Лактоза (β-D-галактопиранозидо-4-α(β)-D-глюкопираноза, молочный сахар)
- 27. Свойства восстанавливающих дисахаридов Реакции, характерные для альдегидной группы Реакции окисления – образуются бионовые кислоты Реакции восстановления
- 28. Невосстанавливающие дисахариды (гликозидо-гликозиды)
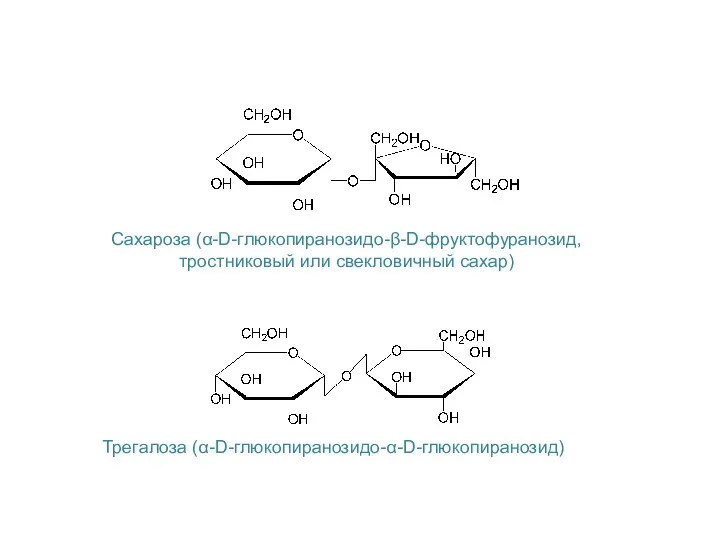
- 29. Сахароза (α-D-глюкопиранозидо-β-D-фруктофуранозид, тростниковый или свекловичный сахар) Трегалоза (α-D-глюкопиранозидо-α-D-глюкопиранозид)
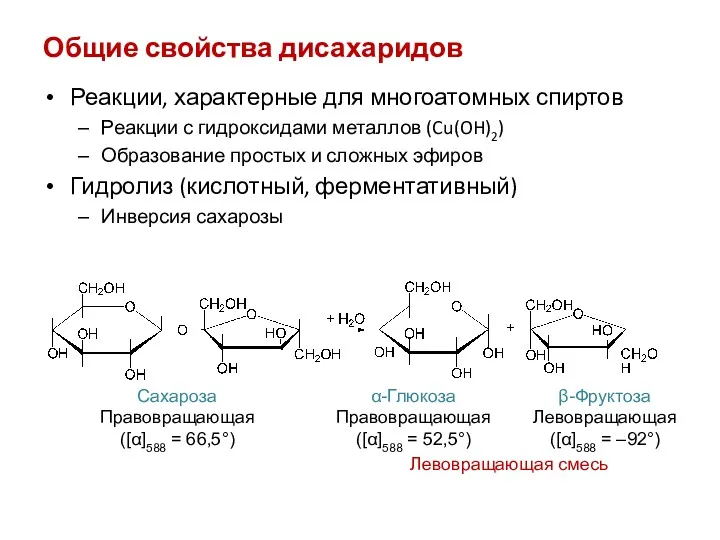
- 30. Общие свойства дисахаридов Реакции, характерные для многоатомных спиртов Реакции с гидроксидами металлов (Cu(OH)2) Образование простых и
- 31. Гомополисахариды
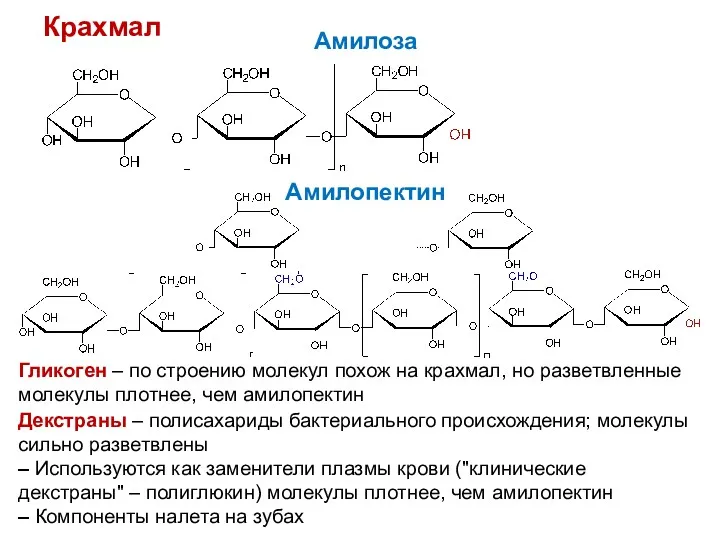
- 32. Крахмал Амилоза Амилопектин Гликоген – по строению молекул похож на крахмал, но разветвленные молекулы плотнее, чем
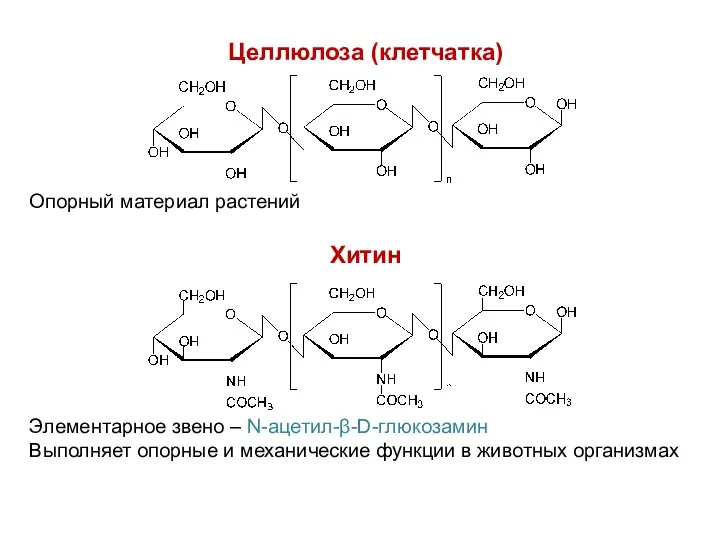
- 33. Целлюлоза (клетчатка) Хитин Элементарное звено – N-ацетил-β-D-глюкозамин Выполняет опорные и механические функции в животных организмах Опорный
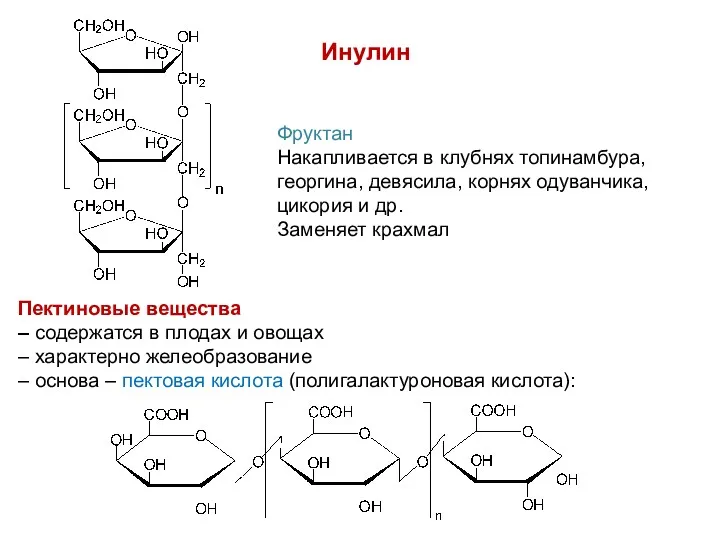
- 34. Инулин Фруктан Накапливается в клубнях топинамбура, георгина, девясила, корнях одуванчика, цикория и др. Заменяет крахмал Пектиновые
- 35. Свойства полисахаридов Реакции, характерные для многоатомных спиртов Образование простых и сложных эфиров Тринитроцеллюлоза (пироксилин) – бездымный
- 36. Гетерополисахариды
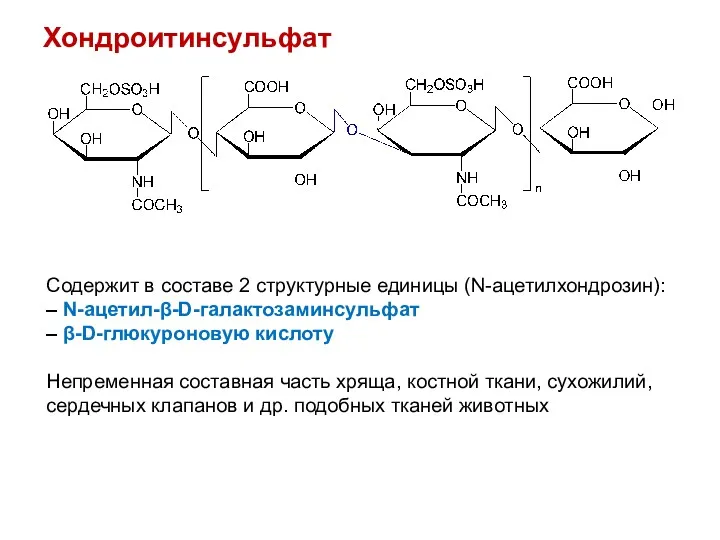
- 37. Хондроитинсульфат Содержит в составе 2 структурные единицы (N-ацетилхондрозин): – N-ацетил-β-D-галактозаминсульфат – β-D-глюкуроновую кислоту Непременная составная часть
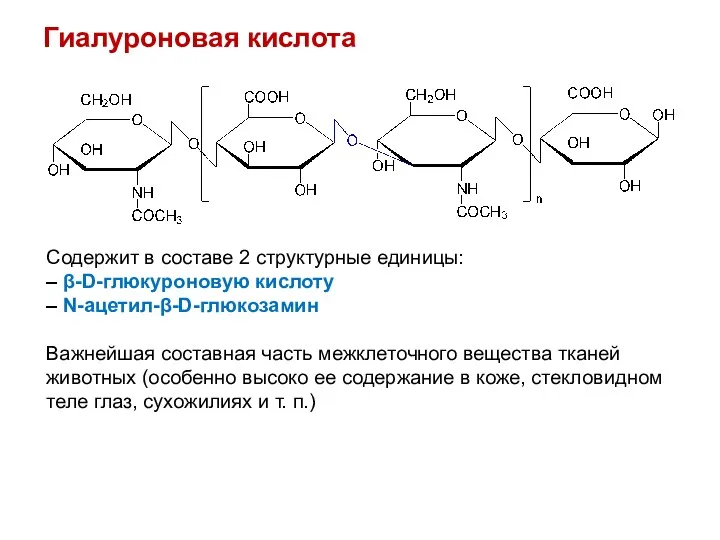
- 38. Гиалуроновая кислота Содержит в составе 2 структурные единицы: – β-D-глюкуроновую кислоту – N-ацетил-β-D-глюкозамин Важнейшая составная часть
- 40. Скачать презентацию















 Соли. Классификация. Физические и химические свойства. Получение и применение солей
Соли. Классификация. Физические и химические свойства. Получение и применение солей Амины
Амины Физико-химические основы дезодорации растительных масел
Физико-химические основы дезодорации растительных масел Кислоты в свете ТЭД
Кислоты в свете ТЭД Электрохимия. Электродные потенциалы. Электродвижущие силы. Электролиз
Электрохимия. Электродные потенциалы. Электродвижущие силы. Электролиз Кремний и его соединения. Силикатная промышленность
Кремний и его соединения. Силикатная промышленность Хлор
Хлор Геология полезных ископаемых
Геология полезных ископаемых Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості Обмен липидов
Обмен липидов Классы органических соединений
Классы органических соединений Непредельные углеводороды
Непредельные углеводороды Жер қыртысының заттық және химиялық құрамы
Жер қыртысының заттық және химиялық құрамы Шампуни: классификация по составу и назначению
Шампуни: классификация по составу и назначению Нефть, её производство, авиационное и дизельное топливо
Нефть, её производство, авиационное и дизельное топливо Орбитали и связи
Орбитали и связи Ионные уравнения
Ионные уравнения Строение атома и периодическая система Д.И. Менделеева
Строение атома и периодическая система Д.И. Менделеева Металдар арасындағы беттік керіліс
Металдар арасындағы беттік керіліс Облагораживание тяжелых нефтей и природных битумов
Облагораживание тяжелых нефтей и природных битумов Классификация сталей
Классификация сталей Химическая связь. Ковалентная связь
Химическая связь. Ковалентная связь Азот қышқылын өндіру
Азот қышқылын өндіру Галогени. Хімічні властивості
Галогени. Хімічні властивості Биологическая роль макро и микроэлементов. (Лекция 17)
Биологическая роль макро и микроэлементов. (Лекция 17) 20230204_ekzo_i_endo2_0
20230204_ekzo_i_endo2_0 Азот қышқылы
Азот қышқылы Пластмассы
Пластмассы