Содержание
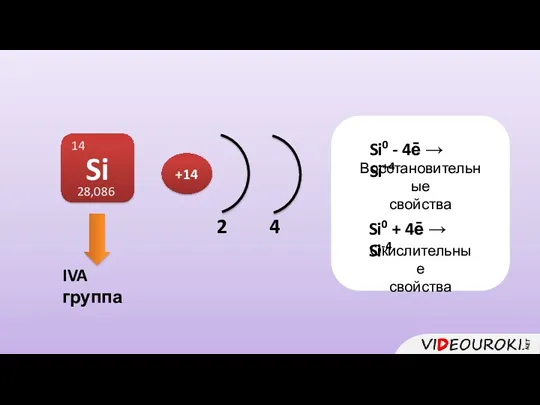
- 2. IVA группа Si 14 28,086 2 4 +14 Si0 - 4ē → Si+4 Восстановительные свойства Si0
- 3. SiO2 оксид кремния (IV) кремнезём горный хрусталь аметист агат топаз опал яшма халцедон сердолик
- 4. Природные силикаты – сложные вещества. Алюмосиликаты – силикаты, в состав которых входит алюминий. каолинит Al2O3 ·
- 5. Асбест используется для изготовления огнеупорных тканей.
- 6. Из разновидностей минералов на основе оксида кремния (IV) первобытные люди изготавливали орудия труда.
- 7. Оксид кремния (IV) у растений и животных
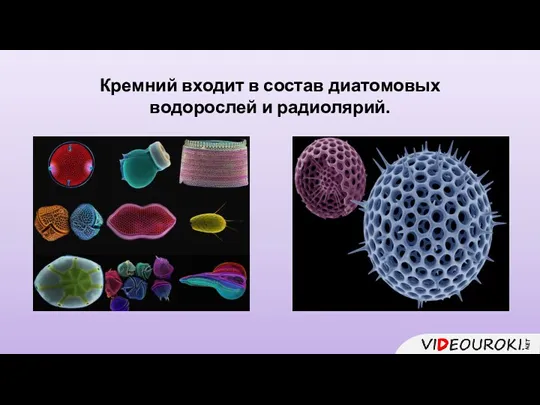
- 8. Кремний входит в состав диатомовых водорослей и радиолярий.
- 9. Получение SiO2 + 2C = Si + 2CO t 3SiO2 + 4Al = 3Si + 2Al2O3
- 10. Аллотропные модификации кремния Это бурый порошок. Аморфный кремний Твёрдое вещество тёмно-серого цвета с металлическим блеском. Он
- 11. Кремний является полупроводником. С повышением температуры его электропроводность увеличивается.
- 12. Реакция с кислородом Химические свойства кремния Si + O2 = SiO2 t оксид кремния (IV) 0
- 13. Реакции с металлами Химические свойства кремния t силицид магния 0 0 +2 -4 Реакция силицида с
- 14. Горение силана SiH4 + 2O2 = SiO2 + 2H2O t оксид кремния (IV) вода Реакция кремния
- 15. Получение кремния SiO2 + 2Mg = 2MgO + Si t SiO2 + 2С = Si +
- 16. Оксид кремния (IV), кремнезём SiO2 Это твёрдое, очень тугоплавкое вещество. Он нерастворим в воде. Имеет атомную
- 17. Химические свойства оксида кремния (IV) Реакции со щелочами Оксид кремния (IV) не растворяется в воде: SiO2
- 18. Химические свойства оксида кремния (IV) Реакции с карбонатами SiO2 + Na2CO3 = Na2SiO3 + CO2↑ t
- 19. Химические свойства кремниевой кислоты H2SiO3 Студенистое, нерастворимое в воде вещество. Она относится к очень слабым кислотам.
- 20. Качественная реакция на силикат-ион Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓ SiO32- + 2H+ = H2SiO3↓
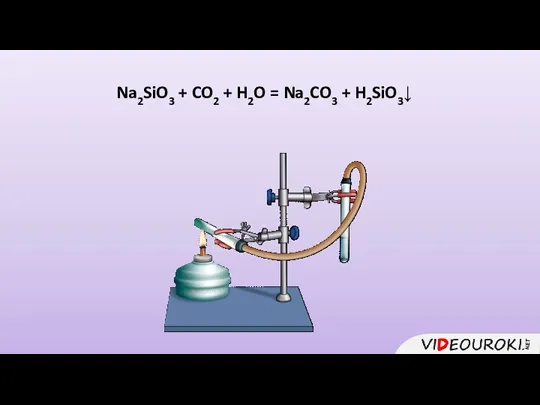
- 21. Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓
- 22. H2SiO3 + 2NaOH = Na2SiO3 + 2H2O t
- 23. Применение кремния и его соединений 1 1 - получения полупроводниковых материалов и кислотоупорных сплавов 2 2
- 25. Производство стекла Na2O · CaO · 6SiO2 Сода + известняк + песок = оконное стекло
- 26. Оксид калия Богемское стекло Оксид свинца (II) Хрустальное стекло Оксид хрома (III) Зелёное стекло Оксид кобальта
- 27. Закалка стекла Стекло особого состава нагревают до температуры около 600 0С, а затем резко охлаждают.
- 28. Стекло человеку известно давно, уже 3-4 тыс. лет назад производство стекла было в Египте, Сирии, Финикии,
- 29. Оконное стекло Бутылочное стекло Ламповое стекло Зеркальное стекло Оптическое стекло
- 30. Основным сырьём в производстве керамических изделий является глина. При смешивании глины с водой образуется тестообразная масса.
- 31. Цемент получают спеканием глины и известняка. Если смешать порошок цемента с водой, то образуется так называемый
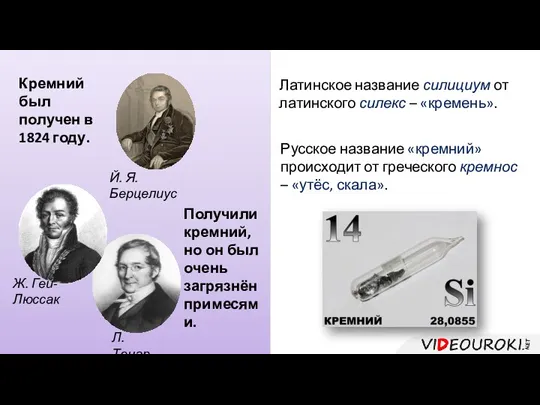
- 32. Кремний был получен в 1824 году. Й. Я. Берцелиус Получили кремний, но он был очень загрязнён
- 33. Кремний – элемент IVA группы. В соединениях для него характерны степени окисления +4 и -4. В
- 35. Скачать презентацию




























 Вода – растворитель. Растворы. Значение воды
Вода – растворитель. Растворы. Значение воды Альдегиды и кетоны
Альдегиды и кетоны Кислоты. Яблочная кислота
Кислоты. Яблочная кислота Закономерности химических элементов ряда Фибоначчи
Закономерности химических элементов ряда Фибоначчи 20230316_otkrytyy_urok_v_8_kl_geneticheskaya_svyaz.docx
20230316_otkrytyy_urok_v_8_kl_geneticheskaya_svyaz.docx Көмірсулар. Моносахаридтер
Көмірсулар. Моносахаридтер Виділення з суміші речовин. Прості речовини
Виділення з суміші речовин. Прості речовини Твердое состояние вещества. Кристаллические и аморфные тела
Твердое состояние вещества. Кристаллические и аморфные тела Аминокислоты
Аминокислоты Паровые зоны в гидротермальных системах
Паровые зоны в гидротермальных системах Сплав золота и серебра - электрум
Сплав золота и серебра - электрум Химические свойства алкенов
Химические свойства алкенов Plastic is one of the challenges of the 21st century
Plastic is one of the challenges of the 21st century Кислород
Кислород Hydrophilization and hydrophobization of the surface of solids with the help of SAA
Hydrophilization and hydrophobization of the surface of solids with the help of SAA Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока
Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока Железо и его свойства
Железо и его свойства Мыльное чудо своими руками. История мыловарения. Изготовление мыла в домашних условиях
Мыльное чудо своими руками. История мыловарения. Изготовление мыла в домашних условиях Галогенопроизводные. Растворимость, общие закономерности
Галогенопроизводные. Растворимость, общие закономерности Тема 6-Альдегиды и кетоны
Тема 6-Альдегиды и кетоны Углеводороды. Предельные (насыщенные) углеводороды
Углеводороды. Предельные (насыщенные) углеводороды Химические формулы
Химические формулы Понятие биогенности химических элементов
Понятие биогенности химических элементов Приборы радиационной и химической разведки
Приборы радиационной и химической разведки Сложные эфиры. Жиры и масла
Сложные эфиры. Жиры и масла Гидролиз солей
Гидролиз солей Научные основы и технологии зеленой химии
Научные основы и технологии зеленой химии Дослідження швидкості росту кристалів від концентрації розчину
Дослідження швидкості росту кристалів від концентрації розчину