Содержание
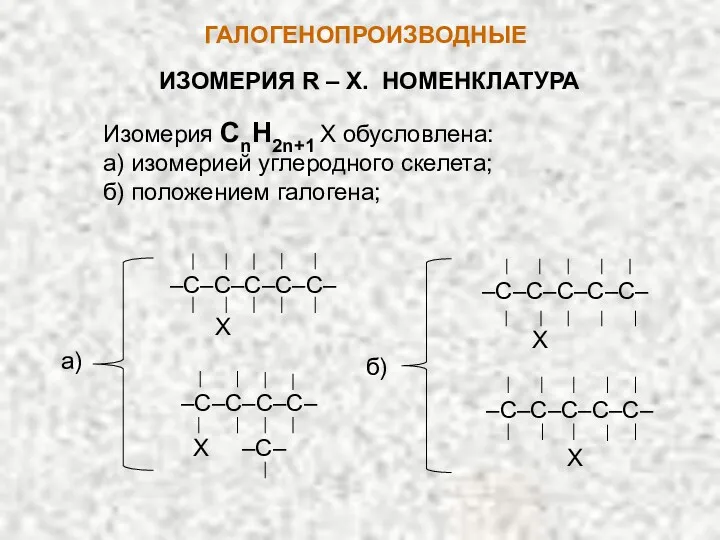
- 2. ГАЛОГЕНОПРОИЗВОДНЫЕ ИЗОМЕРИЯ R – X. НОМЕНКЛАТУРА Изомерия CnH2n+1 X обусловлена: а) изомерией углеродного скелета; б) положением
- 3. ГАЛОГЕНОПРОИЗВОДНЫЕ НОМЕНКЛАТУРА R – X Причем название X ставится либо перед, либо после названия радикала:
- 4. ГАЛОГЕНОПРОИЗВОДНЫЕ 2. Заместительная номенклатура:
- 5. ГАЛОГЕНОПРОИЗВОДНЫЕ АРИЛГАЛОГЕНИДЫ Общая формула Ar – X; в этих соединениях галоген непосредственно связан с атомом углерода
- 6. ГАЛОГЕНОПРОИЗВОДНЫЕ МЕТОДЫ СИНТЕЗА R – X (звездочкой (*) отмечены методы, используемые также в промышленности). 1. Из
- 7. ГАЛОГЕНОПРОИЗВОДНЫЕ МЕТОДЫ СИНТЕЗА R – X. ПРИМЕРЫ: СН3СН2OН СН3СН2Br конц. НBr, t °C или (NaBr +
- 8. ГАЛОГЕНОПРОИЗВОДНЫЕ 3*. Присоединение галогеноводородов к алкенам: 4*. Присоединение галогенов к алкенам и алкинам: Х2 Х Х
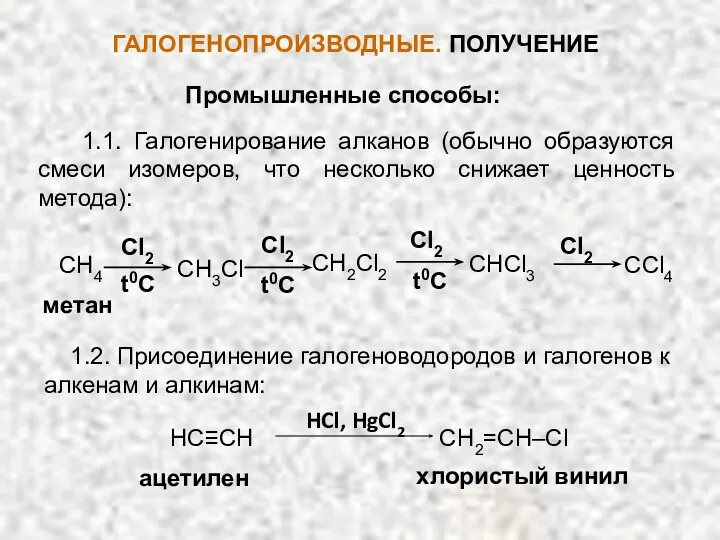
- 9. ГАЛОГЕНОПРОИЗВОДНЫЕ. ПОЛУЧЕНИЕ Промышленные способы: 1.1. Галогенирование алканов (обычно образуются смеси изомеров, что несколько снижает ценность метода):
- 10. Cl2 500°C хлористый винил этилен СН2=СН–Сl СН2 = СН2 СН2 – СН2 Сl Сl ГАЛОГЕНОПРОИЗВОДНЫЕ. ПОЛУЧЕНИЕ
- 11. ГАЛОГЕНОПРОИЗВОДНЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА R – X Температура плавления и кипения R – X Температура плавления и
- 12. ГАЛОГЕНОПРОИЗВОДНЫЕ РАСТВОРИМОСТЬ: ОБЩИЕ ЗАКОНОМЕРНОСТИ Компонент А Компонент В Старинное правило: «ПОДОБНОЕ РАСТВОРЯЕТСЯ В ПОДОБНОМ» (Растворяемое вещество)
- 13. ГАЛОГЕНОПРОИЗВОДНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА R – X Характерной чертой RX является наличие группировки: : .. .. δ-
- 14. ГАЛОГЕНОПРОИЗВОДНЫЕ «S» - от слова «substitution» - замещение; «N» - от слова «nucleophilic». В SN –
- 15. ПРИМЕРЫ НУКЛЕОФИЛОВ: а) Анионы: НО– (гидроксил-анион) RO– (алкоголят-ионы) RCOO– (ионы органических кислот) СN– (цианид-ион)
- 16. ГАЛОГЕНОПРОИЗВОДНЫЕ С2H5Cl + KOH C2H5OH + KCl CH3CH2Cl + H2O CH3CH2OH + HCl этилхлорид этанол НУКЛЕОФИЛЬНОЕ
- 17. ОБШАЯ СХЕМА: R:X + :Nu R:Nu + :X– 1. R:X + :ОН– R:OH + :X– спирт
- 18. 4. R:X + –:С ≡ СR′ R:C ≡ CR′ + :X– алкин 5. R:X + Na:R′
- 19. 9. R:X+ :NH3 [R:NH3]+:X– R–NH2 амин 10. R:X + :NH2R′ [R:NH2R′]+X– RNHR′ + НX алкилбензол реакция
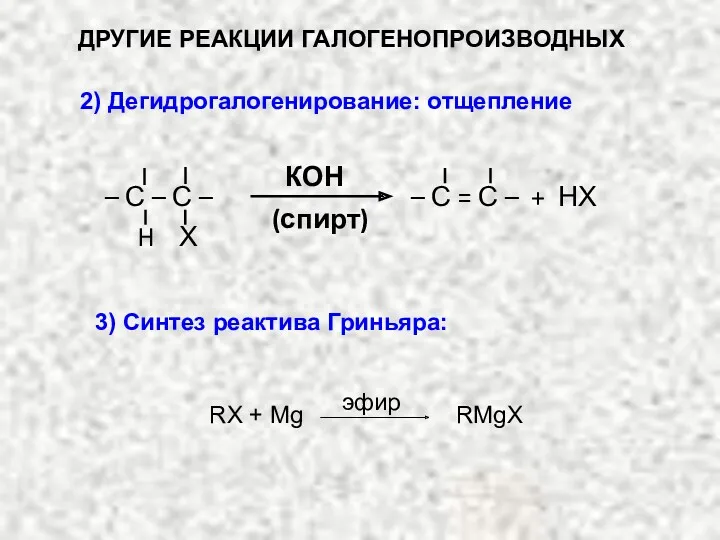
- 20. ДРУГИЕ РЕАКЦИИ ГАЛОГЕНОПРОИЗВОДНЫХ 2) Дегидрогалогенирование: отщепление КОН (спирт) – С = С – + НХ Х
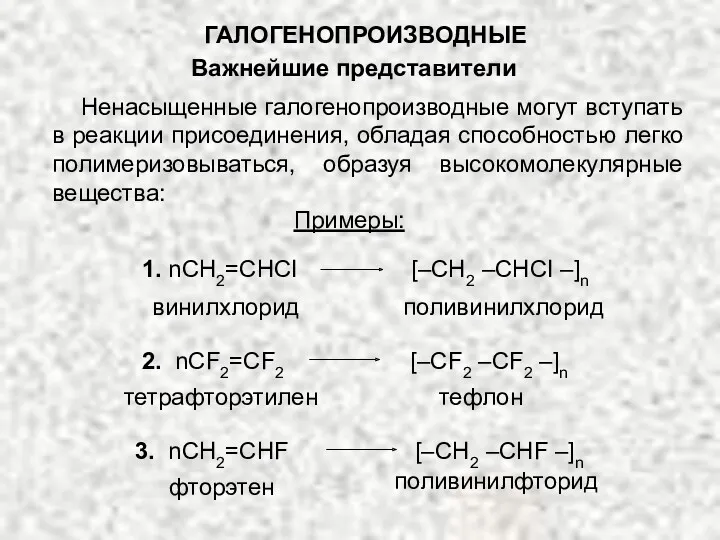
- 21. ГАЛОГЕНОПРОИЗВОДНЫЕ Важнейшие представители Ненасыщенные галогенопроизводные могут вступать в реакции присоединения, обладая способностью легко полимеризовываться, образуя высокомолекулярные
- 23. Скачать презентацию















![9. R:X+ :NH3 [R:NH3]+:X– R–NH2 амин 10. R:X + :NH2R′](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/232818/slide-18.jpg)
 Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Соединения щелочных металлов
Соединения щелочных металлов Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ
Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ Відносна молекулярна маса речовини, її обчислення за хімічною формулою
Відносна молекулярна маса речовини, її обчислення за хімічною формулою Алканы
Алканы Химические свойства основных классов неорганических веществ
Химические свойства основных классов неорганических веществ Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек
Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Предельные углеводороды
Предельные углеводороды Комплесные соединения
Комплесные соединения Мұнай. Мұнайдың шығу тарихы
Мұнай. Мұнайдың шығу тарихы Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты
Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер
Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер Неметаллические материалы, используемые в машино- и приборостроении
Неметаллические материалы, используемые в машино- и приборостроении Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Алюминий и его соединения
Алюминий и его соединения Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Азотистые гетероциклические соединения
Азотистые гетероциклические соединения Формы минералов и их агрегатов
Формы минералов и их агрегатов Химические свойства металлов
Химические свойства металлов Що ховається за цифрами? Харчові домішки
Що ховається за цифрами? Харчові домішки Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі
Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі Угарный газ
Угарный газ Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Ферум та його сполуки
Ферум та його сполуки Аминокислоты. Белки
Аминокислоты. Белки