Содержание
- 2. Электролиты сильные: NaOH, KOH, H2SO4, HNO3, HClO4, HCl, HMnO4, HI, HBr; слабые: , NH4OH, Cu(OH)2, Zn(OH)2,
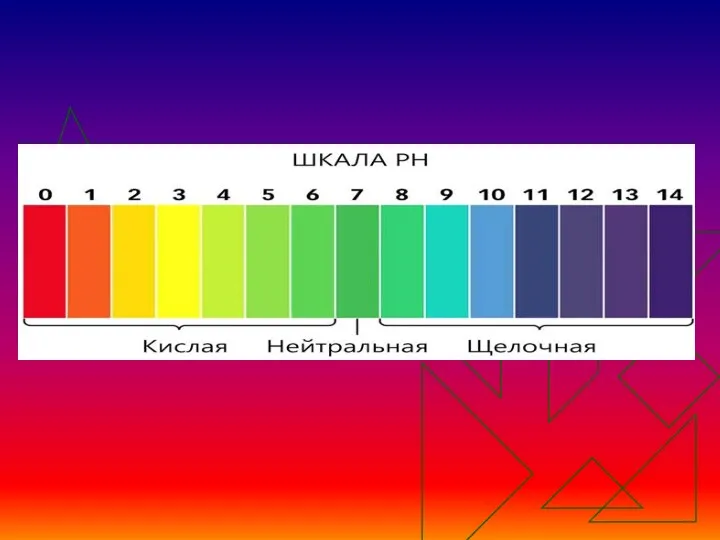
- 3. Изменение цвета различных индикаторов при действии растворов кислот и щелочей
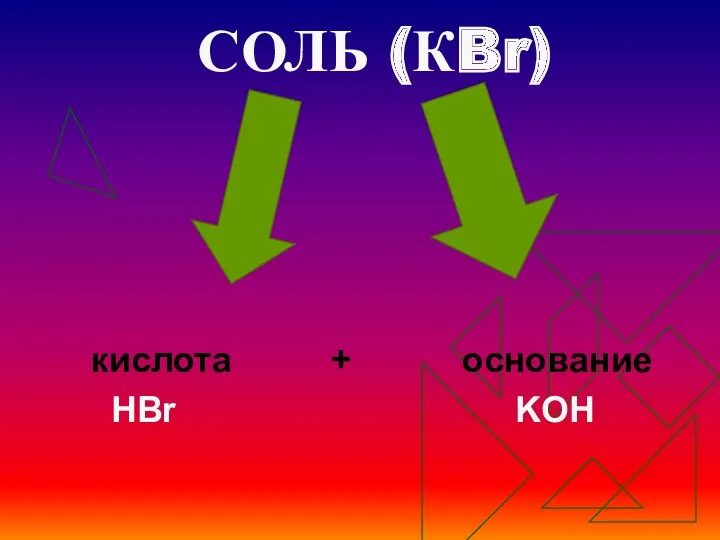
- 5. СОЛЬ (КBr) кислота + основание HBr KOH
- 6. Любую соль можно представить как продукт взаимодействия основания с кислотой. В зависимости от силы основания и
- 7. 1.Соли, образованные сильной кислотой и слабым основанием (AlCl3, FeSO4, Mn(NO3)2.) 2. Соли, образованные сильным основанием и
- 8. Гидролизом называется взаимодействие веществ с водой, при котором составные части вещества соединяются с составными частями воды.
- 9. Алгоритм составления ионного и молекулярного уравнения гидролиза соли 1. Составляем уравнение электролитической диссоциации соли. 2. Определяем
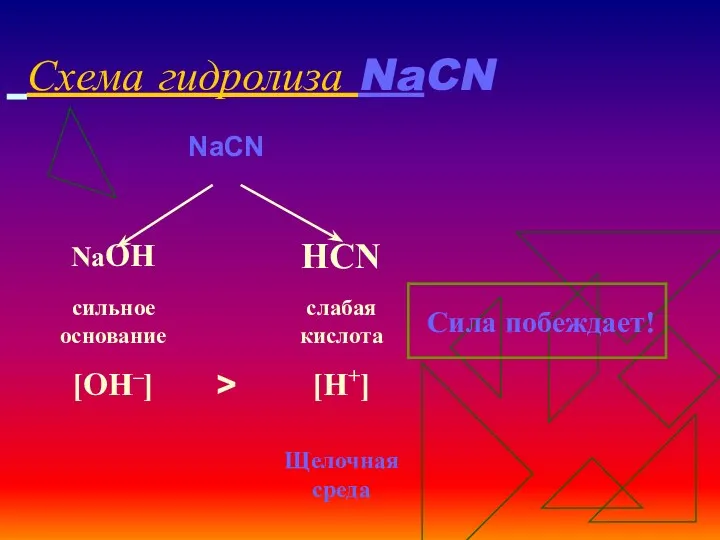
- 10. Схема гидролиза NaCN
- 11. Уравнения гидролиза NaCN NaCN ↔Na+ + CN‾ Н2О ↔ OH ‾ + H+ ____________________________ Полное ионное
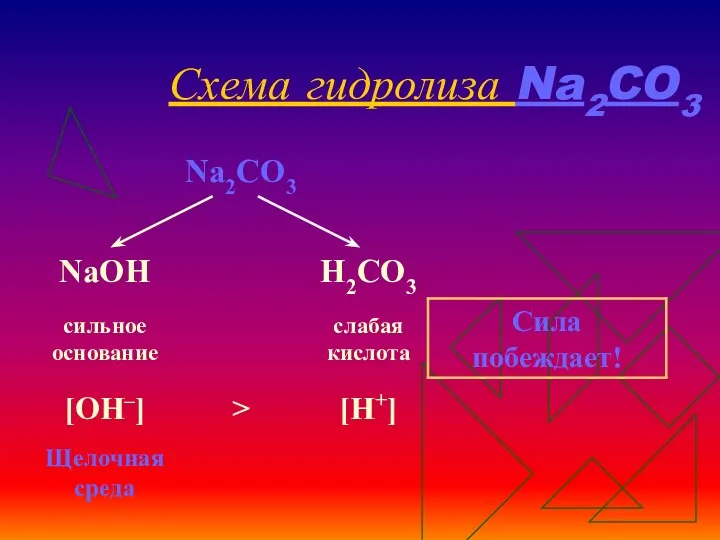
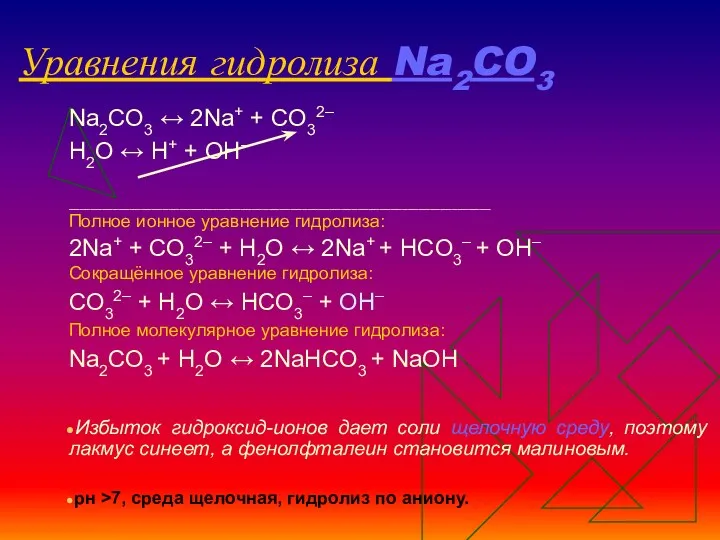
- 12. Схема гидролиза Na2CO3
- 13. Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ Полное ионное
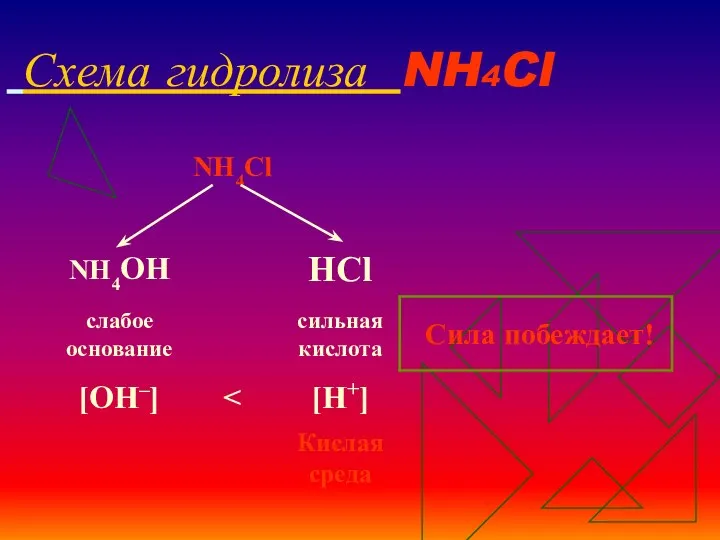
- 14. Схема гидролиза NH4Cl
- 15. Уравнения гидролиза NH4Cl NH4Cl ↔ NH4+ + Сl– Н2O ↔ Н+ + ОН– _________________________________________ Полное ионное
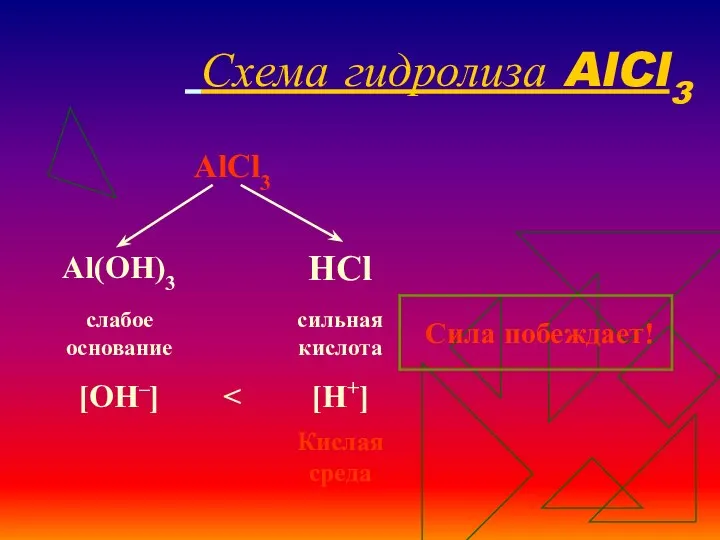
- 16. Схема гидролиза AlCl3
- 17. Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– ______________________________________ Полное ионное
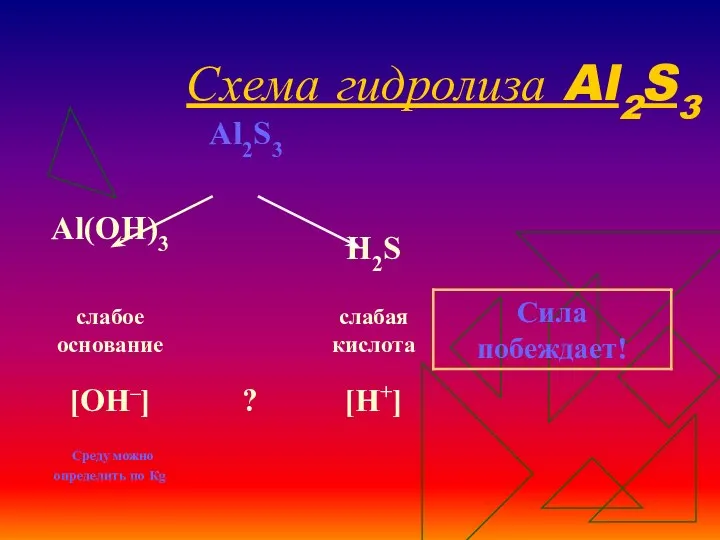
- 18. Схема гидролиза Al2S3
- 19. Уравнения гидролиза Al2S3 Al2S3 + 6H2O-->2Al(OH)3 + 3H2S Гидролиз по катиону и аниону.
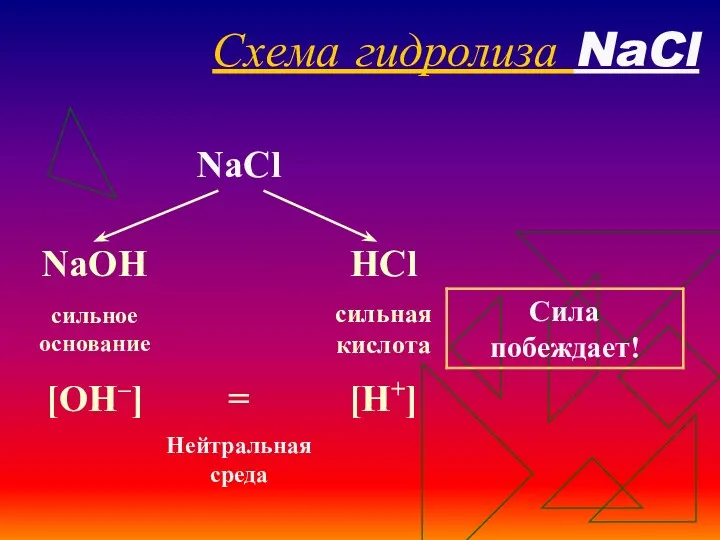
- 20. Схема гидролиза NaCl
- 22. Скачать презентацию










 Rhodium
Rhodium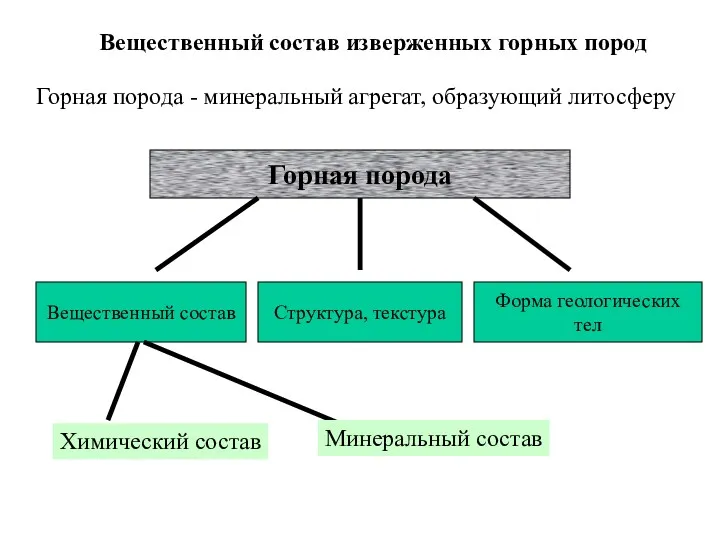 Вещественный состав изверженных горных пород
Вещественный состав изверженных горных пород Химический факультет
Химический факультет Жорсткість води і методи її усунення. 11 клас
Жорсткість води і методи її усунення. 11 клас Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Сплавы металлов. 11 класс
Сплавы металлов. 11 класс Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Камни и Телец
Камни и Телец Основы кристаллографии
Основы кристаллографии Мир кристаллов
Мир кристаллов Значение периодического закона
Значение периодического закона Кремний. Применение кремния
Кремний. Применение кремния Циклические углеводороды. Циклоалканы
Циклические углеводороды. Циклоалканы Биологически активные вещества и их содержание в лекарственных растениях
Биологически активные вещества и их содержание в лекарственных растениях Закономерность изменений в строении электронных оболочек атома
Закономерность изменений в строении электронных оболочек атома Основания. 8 класс
Основания. 8 класс Железо и его соединения
Железо и его соединения Кинетическое уравнение математическая запись закона действующих масс
Кинетическое уравнение математическая запись закона действующих масс Катионная полимеризация (Лекция 6)
Катионная полимеризация (Лекция 6) Циклоалканы. 10 класс
Циклоалканы. 10 класс Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Строение атома
Строение атома Роль химии в жизни человека
Роль химии в жизни человека Палладий. История открытия химических веществ
Палладий. История открытия химических веществ Геология полезных ископаемых
Геология полезных ископаемых Типы химических реакций
Типы химических реакций Криминалистическое исследование нефтепродуктов, горючесмазочных материалов, спиртосодержащих жидкостей,
Криминалистическое исследование нефтепродуктов, горючесмазочных материалов, спиртосодержащих жидкостей, Химические реакции
Химические реакции