Содержание
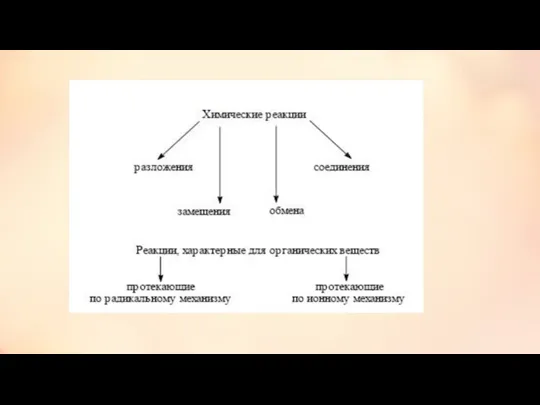
- 2. Классификация химических реакций Реакции соединения, разложения, замещения, обмена. Химические реакции – это явления, при которых одни
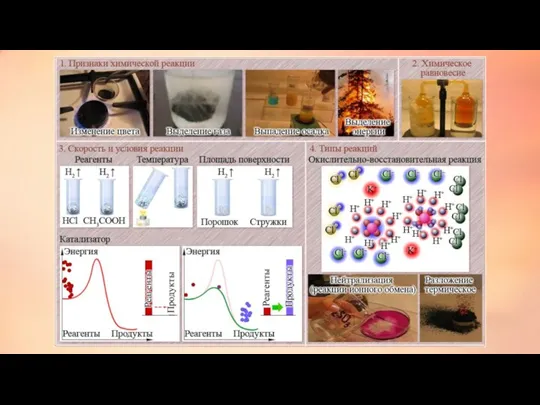
- 5. Реакции соединения - это реакции, в результате которых образуется из одного или нескольких простых или сложных
- 6. Реакции разложения – это химические реакции, в которых из одного, более сложного вещества образуются два или
- 7. Реакции замещения – это реакции между простым и сложным веществом, в результате которой образуются другие простое
- 8. Реакции обмена – это реакции между двумя сложными веществами, которые обмениваются своими составными частями.
- 10. Каталитические реакции - это химические реакции, протекающие с участием катализатора. В зависимости от положительного или отрицательного
- 11. Примеры
- 12. Реакции, которые протекают одновременно в противоположных направлениях, называются обратимыми. Такие реакции обозначаются противоположно направленными стрелками. Реакцию,
- 13. Обратимая реакция, протекающая в растворе электролита, может быть выражена общим уравнением: Например: 3H2 + N2 ⇔
- 14. Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные
- 15. Гомогенные реакции(от греч. «homogenes» — однородный) - это химические реакции между веществами, находящимися в одной фазе.
- 16. Гетерогенные реакции – это химические реакции с участием веществ, находящихся в различных фазах и составляющих в
- 17. Экзотермическая реакция — это химическая реакция, сопровождающаяся выделением теплоты. Многие окислительно-восстановительные реакции являются экзотермическими. Одна из
- 18. Эндотерми́ческие реа́кции (от др.-греч. ἔνδον — внутри и θέρμη — тепло) — химические реакции, сопровождающиеся поглощением
- 19. Тепловой эффект химической реакции Тепловой эффект - количество теплоты, выделившееся или поглощенное химической системой при протекании
- 20. В ходе реакции происходит разрыв связей в исходных веществах и образование новых связей в продуктах реакции.
- 21. Термохимические уравнения Термохимические уравнения реакций - это уравнения, в которых около символов химических соединений указываются агрегатные
- 22. Окислительно-восстановительные реакции (ОВР) (реакции окисления-восстановления) происходят с изменением степени окисления атомов, входящих в состав реагирующих веществ.
- 23. Метод электронного баланса для составления уравнений окислительно-восстановительных реакций Метод электронного баланса — один из методов уравнивания
- 24. Теперь рассмотрим конкретный пример Дана реакция: Li + N2 = Li3N 1. Находим окислитель и восстановитель:
- 25. Скорость химических реакций Понятие о скорости химических реакций Скорость химической реакции - это величина, показывающая как
- 27. Для гетерогенной реакции, скорость реакции определяется числом молей веществ, вступивших в или образующихся в результате реакции
- 28. Зависимость скорости химических реакций от различных факторов: природы реагирующих веществ, их концентрации, температуры, поверхности соприкосновения и
- 29. Зависимость скорости реакций от природы реагирующих веществ. Чем выше химическое сродство реагирующих веществ, тем энергичнее и
- 31. Скачать презентацию


























 Материаловедение. Силикатные материалы
Материаловедение. Силикатные материалы Алканы: физические и химические свойства, получение
Алканы: физические и химические свойства, получение Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Строительное материаловедение. (Лекции 1-2)
Строительное материаловедение. (Лекции 1-2) Щелочные металлы. (9 класс)
Щелочные металлы. (9 класс) Сахароза
Сахароза Электролит және бейэлектролит ерітінділердің коллигативті қасие
Электролит және бейэлектролит ерітінділердің коллигативті қасие Химия аминокислот. Лекция № 4
Химия аминокислот. Лекция № 4 Physiology lab
Physiology lab Коррозия и защита материалов
Коррозия и защита материалов Жёсткость воды
Жёсткость воды fosfor_и его соед
fosfor_и его соед Plastics слайды
Plastics слайды Ртуть и цинк
Ртуть и цинк Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Полимерные материалы
Полимерные материалы Биологическая химия (введение)
Биологическая химия (введение) Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу БАЗ синтездеудің химиялық технологиясы Синтетикалық түсінік
БАЗ синтездеудің химиялық технологиясы Синтетикалық түсінік Характеристика металу Алюміній
Характеристика металу Алюміній Electrolysis
Electrolysis Квест с Гарри Поттером
Квест с Гарри Поттером Методы комплексонометрии. Количественный анализ
Методы комплексонометрии. Количественный анализ Метаболизм кетоновых тел. Метаболизм холестерина
Метаболизм кетоновых тел. Метаболизм холестерина Правила ДСС
Правила ДСС кислоты
кислоты Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Химия. Лекция 1. Растворы
Химия. Лекция 1. Растворы