Содержание
- 2. ВОПРОСЫ ЛЕКЦИИ ФОСФОР, АЛЛОТРОПИЯ ФОСФОРА, ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА. ОКСИДЫ ФОСФОРА И ИХ СВОЙСТВА. ФОСФОРНАЯ КИСЛОТА,
- 3. ИСТОРИЯ ОТКРЫТИЯ Считается, что фосфор открыл в 1669 году алхимик из Гамбурга Хеннинг Бранд. Он был
- 4. ИСТОРИЯ ОТКРЫТИЯ Он собрал около тонны мочи из солдатских казарм и выпаривал ее до образования сиропообразной
- 5. ДАЙТЕ ХАРАКТЕРИСТИКУ ЭЛЕМЕНТУ ПО ПЛАНУ 1. ПОЛОЖЕНИЕ В П.С.Х.Э. Д. И. МЕНДЕЛЕЕВА 2. СТРОЕНИЕ АТОМА: А)
- 6. ПРИРОДНЫЕ СОЕДИНЕНИЯ Из-за большой химической активности встречается в природе только в виде соединений. Важнейшими минералами фосфора
- 7. ПРИРОДНЫЕ СОЕДИНЕНИЯ Крупнейшее месторождение апатитов находится на Кольском полуострове, в районе Хибинских гор. Залежи фосфоритов находятся
- 8. НАХОЖДЕНИЕ В ПРИРОДЕ Фосфор входит в состав всех живых организмов. А именно он встречается в соединениях:
- 9. ПОЛУЧЕНИЕ Фосфор производят в электрических печах, восстанавливая апатит углем в присутствии кремнезема: Ca3(PO4)2+ SiO2+C→ CaSiO3+ CO+
- 10. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ ФОСФОРА
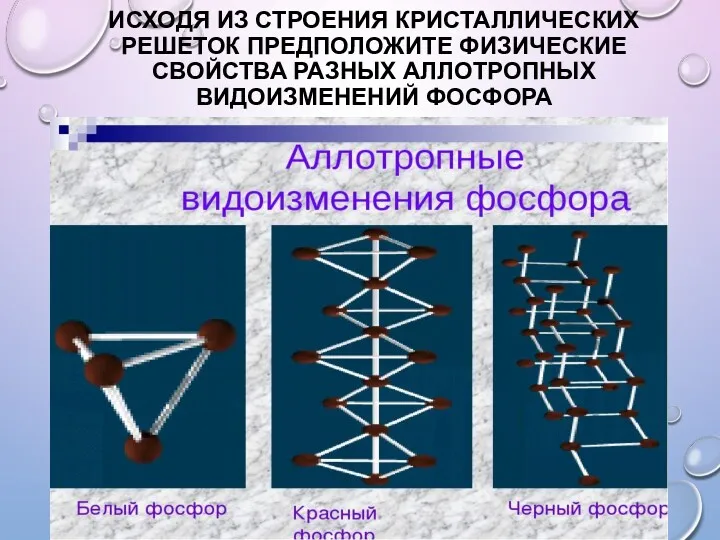
- 11. ИСХОДЯ ИЗ СТРОЕНИЯ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК ПРЕДПОЛОЖИТЕ ФИЗИЧЕСКИЕ СВОЙСТВА РАЗНЫХ АЛЛОТРОПНЫХ ВИДОИЗМЕНЕНИЙ ФОСФОРА
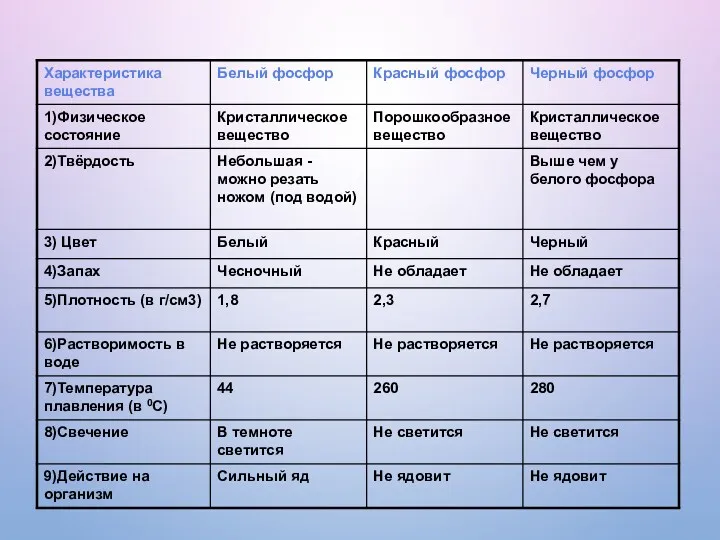
- 14. ФИЗИЧЕСКИЕ СВОЙСТВА Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических модификаций; вопрос аллотропии фосфора
- 15. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ Горение белого фосфора Белый фосфор окисляется кислородом уже при обычных условиях, а в тонкоизмельченном
- 16. ХИМИЧЕСКИЕ СВОЙСТВА В химических реакциях проявляет окислительно-восстановительную двойственность. Как окислитель взаимодействует со многими металлами, образуя фосфиды.
- 17. ХИМИЧЕСКИЕ СВОЙСТВА КАК НЕМЕ ФОСФОР РЕАГИРУЕТ С МЕ ( ЗАПИШИТЕ УРАВНЕНИЯ РЕАКЦИЙ ФОСФОРА С КАЛИЕМ, КАЛЬЦИЕМ)
- 18. ХИМИЧЕСКИЕ СВОЙСТВА ПРИ ДЛИТЕЛЬНОМ НАГРЕВАНИИ БЕЛОГО ФОСФОРА БЕЗ ДОСТУПА ВОЗДУХА ОН ЖЕЛТЕЕТ И ПОСТЕПЕННО ПРЕВРАЩАЕТСЯ В
- 19. ВАЖНЕЙШИЕ СОЕДИНЕНИЯ Н3РО4 ФОСФОРНАЯ КИСЛОТА Р2О5 ОКСИД ФОСФОРА (V)
- 20. ОКСИД ФОСФОРА (V) Р2О5 – белый порошок, очень гигроскопичен (самый эффективный осушитель). Является типичным кислотным оксидом.
- 21. ФИЗИЧЕСКИЕ СВОЙСТВА P2O5 БЕЛЫЙ, РЫХЛЫЙ ПОРОШОК, ГИГРОСКОПИЧНЫЙ. ХРАНЯТ В ГЕРМЕТИЧЕСКИ ЗАКРЫТЫХ СОСУДАХ.
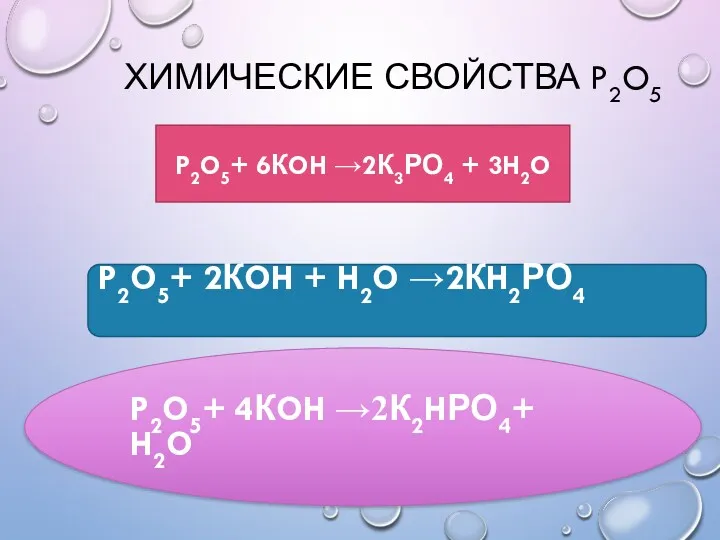
- 22. ХИМИЧЕСКИЕ СВОЙСТВА P2O5 ПРОЯВЛЯЕТ СВОЙСТВА КИСЛОТНОГО ОКСИДА. 1) РЕАГИРУЕТ С ВОДОЙ: P2O5 + H2O → 2HPO3
- 23. ХИМИЧЕСКИЕ СВОЙСТВА P2O5 P2O5+ 6КOH →2К3РО4 + 3H2O P2O5+ 2КOH + H2O →2КH2РО4 P2O5+ 4КOH →2К2HРО4+
- 24. ОРТОФОСФОРНАЯ КИСЛОТА ПОЛУЧЕНИЕ .ЗАПИШИТЕ УРАВНЕНИЯ РЕАКЦИЙ ПО СХЕМЕ: Р→Р2О5→Н3РО4 Взаимодействие оксида фосфора (V) с водой при
- 25. ОРТОФОСФОРНАЯ КИСЛОТА ВЫТЕСНЕНИЕ ПРИРОДНЫХ ФОСФАТОВ БОЛЕЕ СИЛЬНОЙ КИСЛОТОЙ ПРИ НАГРЕВАНИИ. ФОСФОРНАЯ КИСЛОТА, ПОЛУЧЕННАЯ ПЕРЕРАБОТКОЙ ПРИРОДНЫХ ФОСФАТОВ,
- 26. ОРТОФОСФОРНАЯ КИСЛОТА Ортофосфорная кислота – кристаллическое, нелетучее, твердое, бесцветное вещество. Концентрированную кислоту называют ледяной Смешивается с
- 27. КАК ТРЕХОСНОВНАЯ КИСЛОТА, ДИССОЦИИРУЕТ СТУПЕНЧАТО. Н3РО4 ↔ Н+ + Н2РО4― (ДИГИДРОФОСФАТ-ИОН) Н2РО4― ↔ Н+ + НРО42―(ГИДРОФОСФАТ-ИОН)
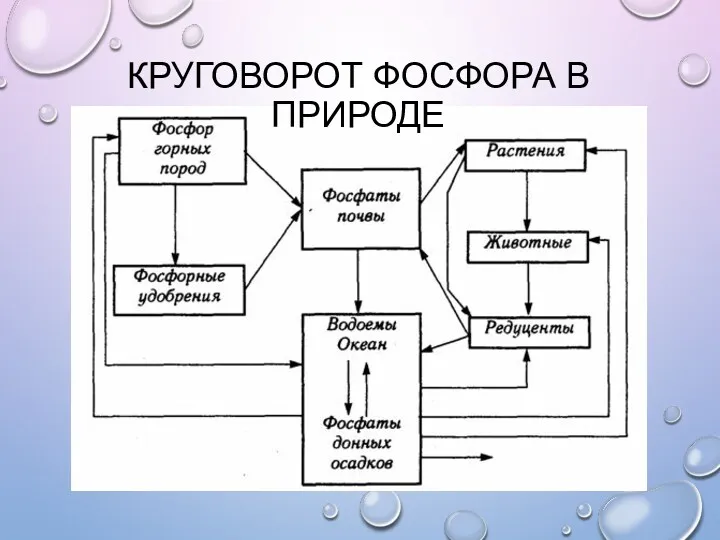
- 28. КРУГОВОРОТ ФОСФОРА В ПРИРОДЕ
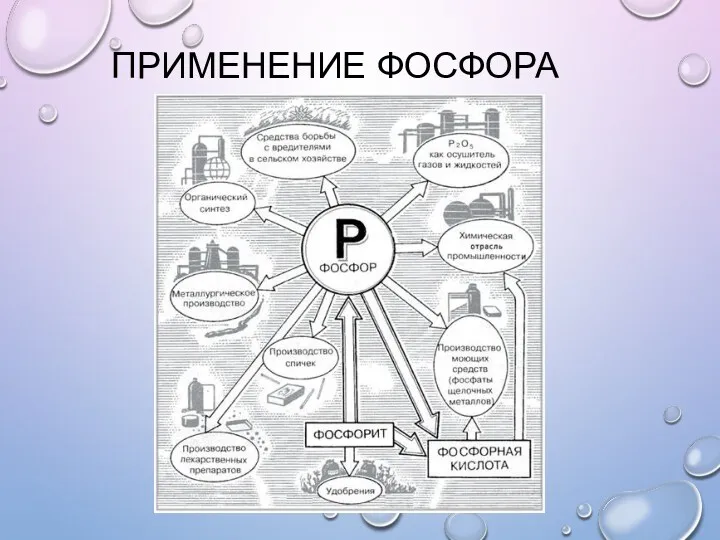
- 29. ПРИМЕНЕНИЕ ФОСФОРА
- 30. ПРИМЕНЕНИЕ ФОСФОРА Около 80% от всего производства белого фосфора идет на синтез чистой ортофосфорной кислоты. Она
- 31. ПРИМЕНЕНИЕ ФОСФОРА: СПИЧКИ Первые фосфорные спички – с головкой из белого фосфора – были созданы лишь
- 32. ПРИМЕНЕНИЕ ФОСФОРА: СПИЧКИ Зажигательная поверхность спичечного коробка покрыта смесью красного фосфора и порошка стекла. В состав
- 33. ПРИМЕНЕНИЕ ФОСФОРА Немало ортофосфорной кислоты потребляет пищевая промышленность. Дело в том, что на вкус разбавленная ортофосфорная
- 34. ПРИМЕНЕНИЕ ФОСФОРА Интересны и другие применения ортофосфорной кислоты в промышленности. Например, было замечено, что пропитка древесины
- 35. НЕОБХОДИМ ЛИ ФОСФОР ЧЕЛОВЕКУ?
- 36. ЗНАЧЕНИЕ ФОСФОРА ФОСФОР ЯВЛЯЕТСЯ ОСНОВОЙ СКЕЛЕТА ЧЕЛОВЕКА И ЗУБОВ. ЖИВЫЕ ОРГАНИЗМЫ НЕ МОГУТ ОБХОДИТЬСЯ БЕЗ ФОСФОРА.
- 37. БИОЛОГИЧЕСКАЯ РОЛЬ ФОСФОРА СУТОЧНАЯ ПОТРЕБНОСТЬ ДЛЯ ВЗРОСЛОГО ЧЕЛОВЕКА 1 ГРАММ ВХОДИТ В СОСТАВ СКЕЛЕТА ВХОДИТ В
- 38. РЕАКЦИЯ ОРГАНИЗМА НА НЕДОСТАТОК И ИЗБЫТОК ФОСФОРА НЕДОСТАТОК ФОСФОРА РАЗВИВАЕТСЯ ЗАБОЛЕВАНИЕ РАХИТ, СНИЖАЕТСЯ УМСТВЕННАЯ И МЫШЕЧНАЯ
- 40. Скачать презентацию
































 Аминокислоты, их строение, изомерия, свойства, применение
Аминокислоты, их строение, изомерия, свойства, применение Изучение процесса коррозии железа (домашний эксперимент)
Изучение процесса коррозии железа (домашний эксперимент) Минералы и горные породы
Минералы и горные породы Сұйықтардағы газ ерітінділері. Генри заңы. Сұйық-сұйық ерітінділердегі бу қысымы. Рауль заңынын ауытқу. Криометрия
Сұйықтардағы газ ерітінділері. Генри заңы. Сұйық-сұйық ерітінділердегі бу қысымы. Рауль заңынын ауытқу. Криометрия Протекание ОВР зависит от рН среды
Протекание ОВР зависит от рН среды Сполуки неметалічних елементів з Гідрогеном
Сполуки неметалічних елементів з Гідрогеном Хром. Химиялық қасиеттері
Хром. Химиялық қасиеттері 20230306_vodorod_ego_fizicheskie_svoystva
20230306_vodorod_ego_fizicheskie_svoystva Закономерности процессов нитрования НЦ
Закономерности процессов нитрования НЦ Основные электрохимические процессы
Основные электрохимические процессы Иодометрия. Комплексиметрия (начало)
Иодометрия. Комплексиметрия (начало) Золото Au (Аурум)
Золото Au (Аурум) Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Растворение как физико-химический процесс
Растворение как физико-химический процесс Химический анализ веществ
Химический анализ веществ Диагностические свойства минералов. Занятие 3-4
Диагностические свойства минералов. Занятие 3-4 Химия воды
Химия воды Химические свойства основных неорганических соединений в свете ЭД и ОВР
Химические свойства основных неорганических соединений в свете ЭД и ОВР Основные виды химических связей
Основные виды химических связей Занимательные опыты
Занимательные опыты Титриметрический метод анализа
Титриметрический метод анализа Введение в органическую химию
Введение в органическую химию Полиэтилен - термопластичный полимер этилена
Полиэтилен - термопластичный полимер этилена Native elements
Native elements Понятие о солях (8 класс)
Понятие о солях (8 класс) Скорость химической реакции
Скорость химической реакции Состояние радионуклидов в различных фазах и методы его изучения
Состояние радионуклидов в различных фазах и методы его изучения Периодический закон и периодический закон Д.И. Менделеева
Периодический закон и периодический закон Д.И. Менделеева