Содержание
- 2. Скорость химической реакции Скорость химической реакции – это изменение количества реагирующего вещества в единицу времени в
- 3. Факторы, влияющие на скорость химической реакции природа реагирующих веществ концентрация реагирующих веществ, давление (в реакциях с
- 4. 1) влияние природы реагирующих веществ Чем прочнее химические связи в веществе, тем труднее оно вступает в
- 5. 2) Зависимость скорости химической реакции от концентрации При повышении концентрации хотя бы одного из реагирующих веществ
- 6. 3) Зависимость скорости химической реакции от давления при наличии газообразных реагентов - повышение давления повышает концентрацию
- 7. 3) Зависимость скорости химической реакции от температуры Правило Я.Х. Вант - Гоффа : Повышение температуры на
- 8. 5) Катализатор —ускоряет различные химические реакции в заданном направлении.
- 9. 6) Влияние поверхности соприкосновения реагирующих веществ на скорость реакции. Чем мельче твёрдые частицы, тем больше скорость
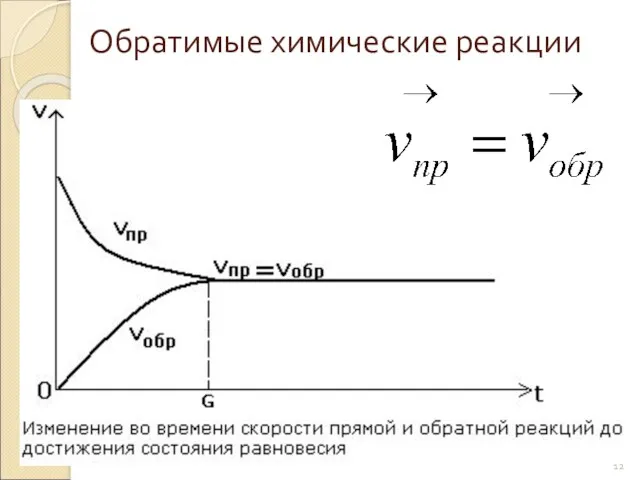
- 10. Обратимость химических реакций Химическое равновесие
- 11. Обратимые и необратимые реакции Необратимыми называют химические реакции, протекающие только в одном направлении. Обратимыми называют реакции,
- 12. Обратимые химические реакции
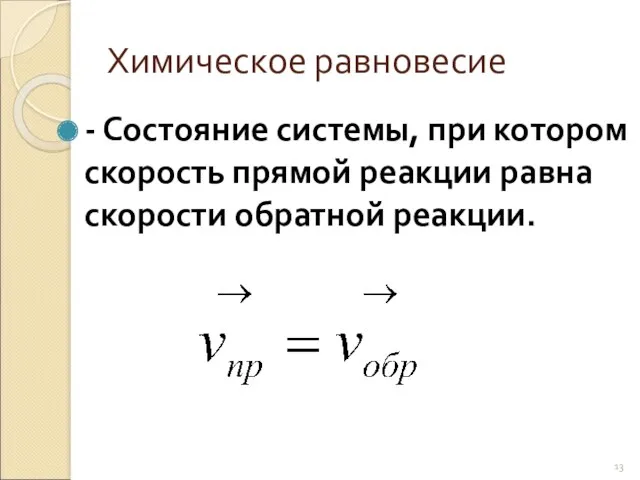
- 13. Химическое равновесие - Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции.
- 14. 1. Концентрации всех веществ в состоянии равновесия (равновесные концентрации) постоянны. 2. Химическое равновесие имеет динамический характер
- 15. Константа химического равновесия Для одностадийной обратимой реакции при равновесии выражения для скоростей прямой υ1 и обратной
- 16. Константа химического равновесия Из условия равновесия υ1 =υ2 следует: k1 · [A]α · [B]b ═ k2
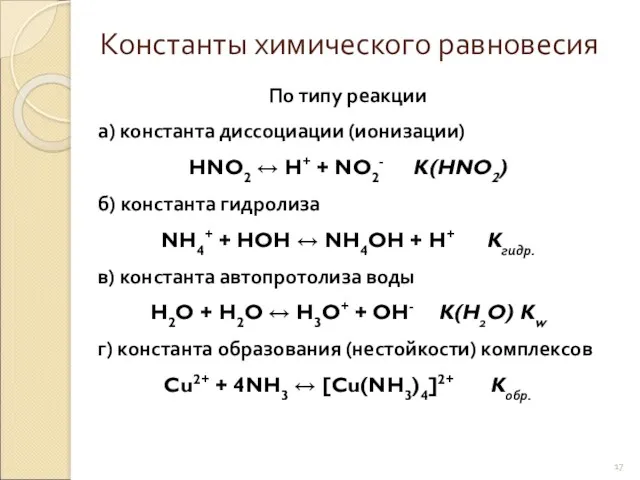
- 17. По типу реакции а) константа диссоциации (ионизации) HNO2 ↔ H+ + NO2- K(HNO2) б) константа гидролиза
- 18. Смещение химического равновесия Принцип Ле Шателье (1884г.): если на систему, находящуюся в равновесии, оказывается внешнее воздействие,
- 19. Влияние температуры на смещение равновесия Реакции, сопровождающиеся выделением теплоты, называются экзотермическими. Реакции, сопровождающиеся поглощением теплоты, называются
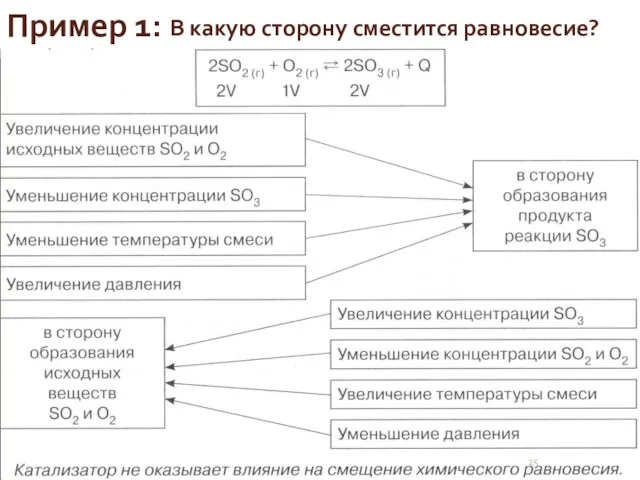
- 20. Влияние изменения температуры При повышении температуры равновесие смещается в сторону эндотермической реакции. При понижении температуры –
- 21. Влияние изменения концентрации веществ При увеличении концентрации одного из веществ равновесие смещается в сторону его расходования.
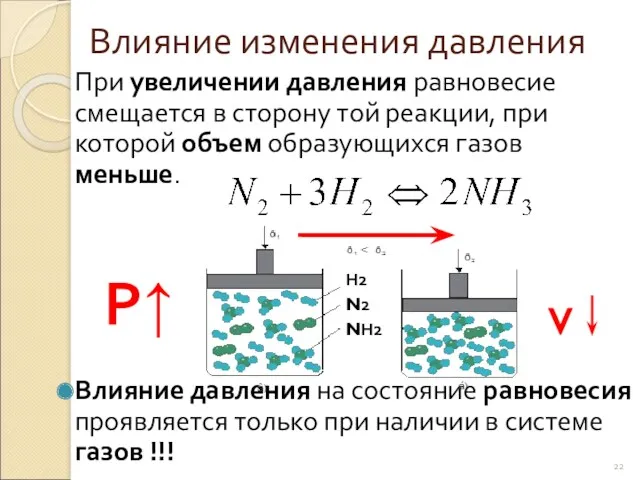
- 22. Влияние изменения давления При увеличении давления равновесие смещается в сторону той реакции, при которой объем образующихся
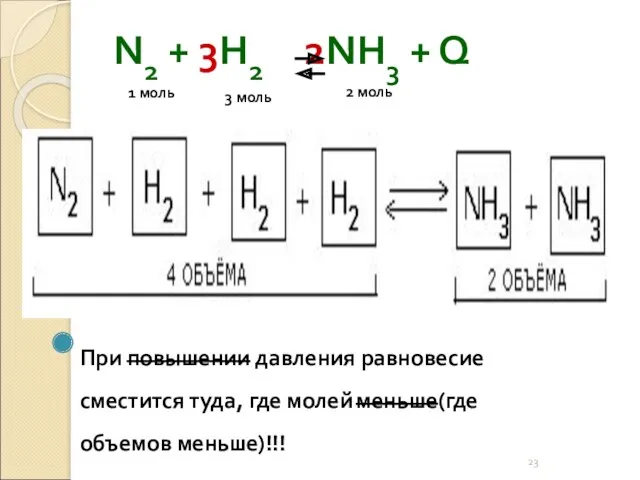
- 23. N2 + 3H2 2NH3 + Q При повышении давления равновесие сместится туда, где молей меньше(где объемов
- 24. Катализатор: не влияет на смещение химического равновесия (он лишь ускоряет процесс его достижения)
- 25. Пример 1: В какую сторону сместится равновесие?
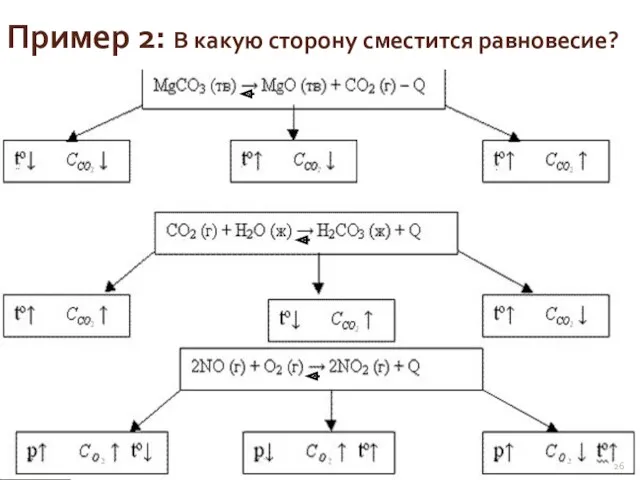
- 26. Пример 2: В какую сторону сместится равновесие?
- 28. Скачать презентацию


















 Металдардыњ механикалыќ ќасиеттері-алюминий
Металдардыњ механикалыќ ќасиеттері-алюминий Алкины. Химические свойства и способы получения алкинов
Алкины. Химические свойства и способы получения алкинов Гидролиз неорганических солей
Гидролиз неорганических солей Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов
Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов Классификация химических реакций по различным основаниям. 9 класс
Классификация химических реакций по различным основаниям. 9 класс Тұндыру әдістері
Тұндыру әдістері Алюминий и его соединения
Алюминий и его соединения Валентные состояния атома углерода
Валентные состояния атома углерода Моющие средства
Моющие средства Способи очищення води
Способи очищення води Кислород как элемент
Кислород как элемент Реакционная способность твердых тел и способы ее регулирования
Реакционная способность твердых тел и способы ее регулирования Карбоновые кислоты. Строение
Карбоновые кислоты. Строение Химический элемент. Электронное строение атома
Химический элемент. Электронное строение атома Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Химия в строительстве
Химия в строительстве Муравьиная кислота
Муравьиная кислота Взаимное влияние атомов в молекулах. Шкалы электроотрицательности
Взаимное влияние атомов в молекулах. Шкалы электроотрицательности Технологии получения полимерных нанокомпозитов
Технологии получения полимерных нанокомпозитов Ферменттер. Зерттелу тарихы
Ферменттер. Зерттелу тарихы Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы
Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы Электрохимическая коррозия
Электрохимическая коррозия Лекция как один из методов обучения химии на старшей ступени общего образования. Методика ее подготовки и чтения
Лекция как один из методов обучения химии на старшей ступени общего образования. Методика ее подготовки и чтения Радиогеохимия метаморфических процессов
Радиогеохимия метаморфических процессов Сучасні каталізатори у процесах нафтопереробки та нафтохімії
Сучасні каталізатори у процесах нафтопереробки та нафтохімії Биологически важные вещества жиры
Биологически важные вещества жиры Периодический закон и периодическая система Д.И. Менделеева. 9 класс
Периодический закон и периодическая система Д.И. Менделеева. 9 класс Коррозия и защита полимерных строительных материалов
Коррозия и защита полимерных строительных материалов