Содержание
- 2. Строение атома углерода Охарактеризуйте положение атома углерода в ПСХЭ. Каков состав атома углерода? Каково строение электронной
- 3. Электронное облако Электрон обладает одновременно свойствами и частицы и волны, поэтому можно определить только его верояность
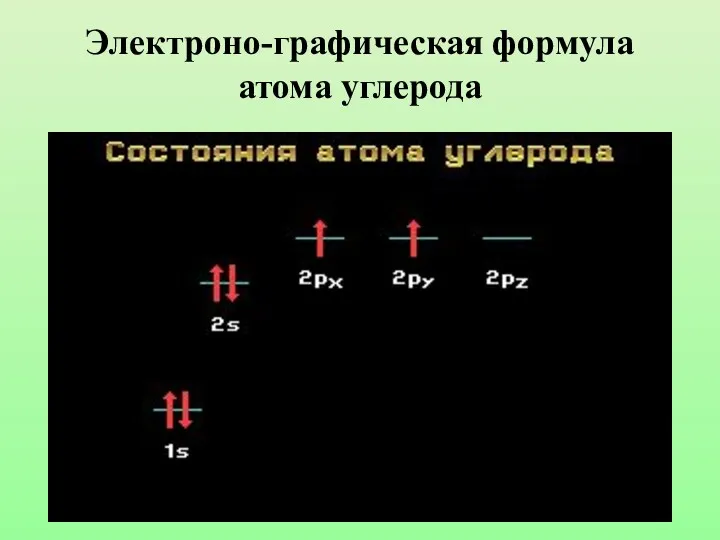
- 4. Составьте электронно-графическую формулу атома углерода. Какие виды атомных орбиталей имеет в своем составе атом углерода?
- 6. Электроно-графическая формула атома углерода
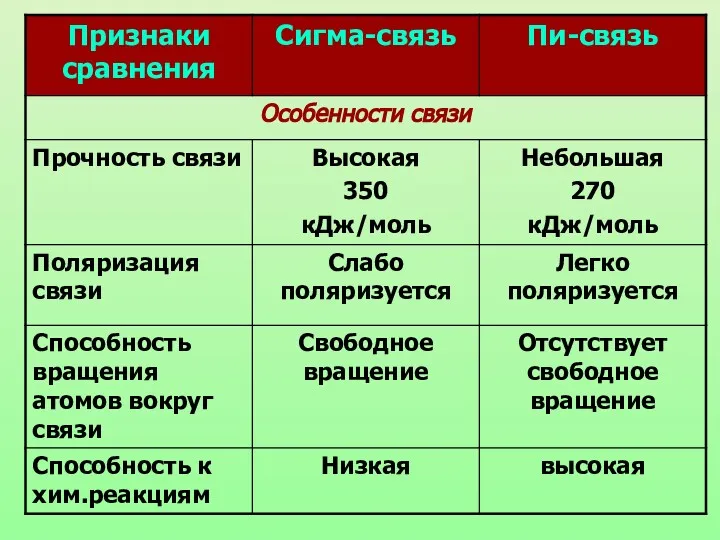
- 7. Валентность элемента чаще всего определяется числом неспаренных электронов в атоме или числом ковалентных связей в молекуле.
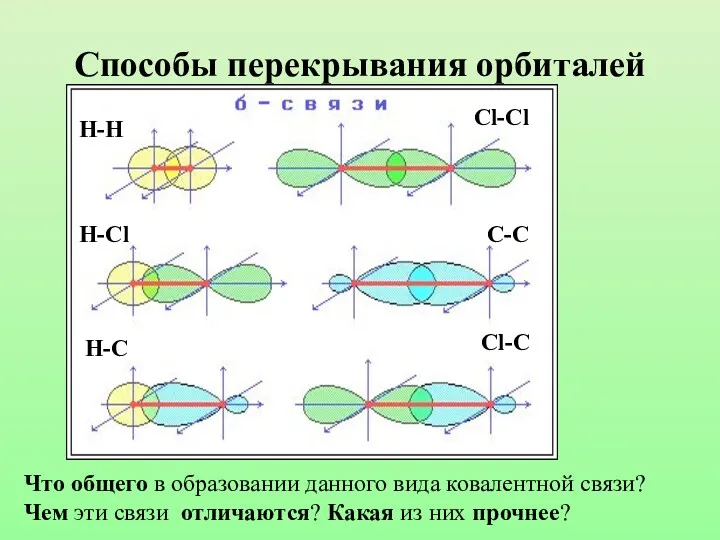
- 8. Способы перекрывания орбиталей Н-Н Cl-Cl H-Cl H-C C-C Cl-C Что общего в образовании данного вида ковалентной
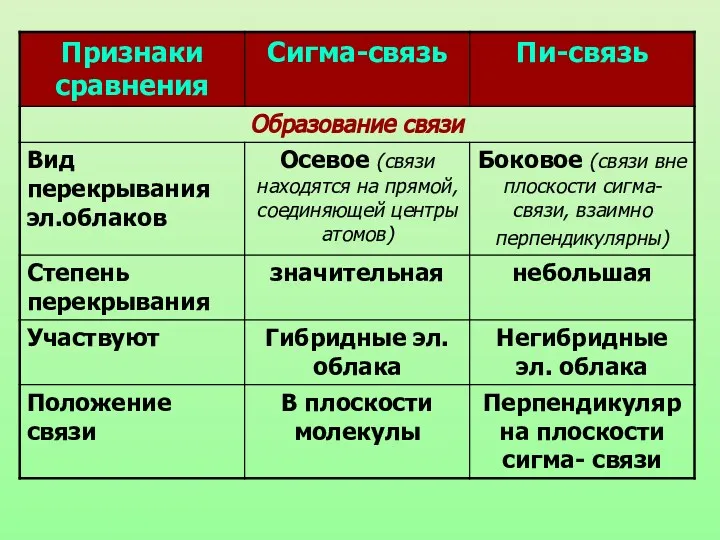
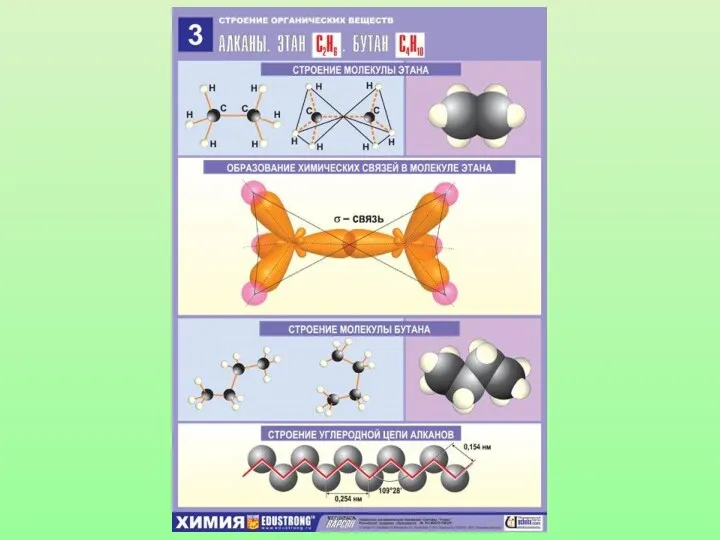
- 9. Химическая связь, образующаяся в результате перекрывания электронных орбиталей вдоль линии связи, называются б-связями (сигма-связями).
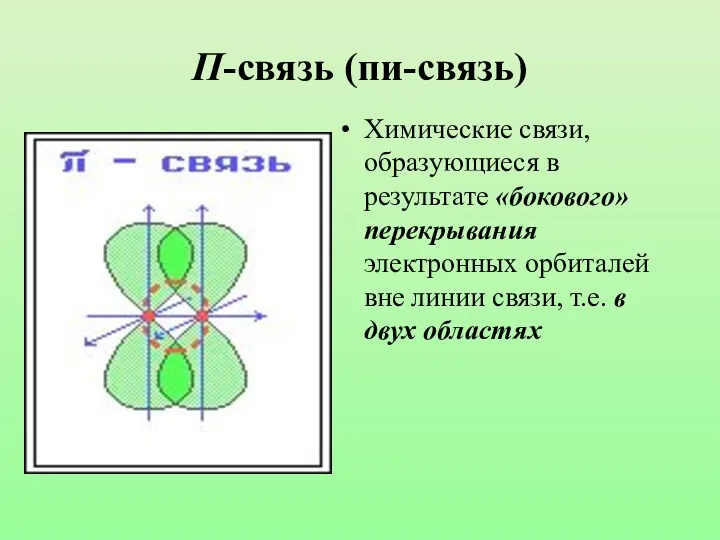
- 10. П-связь (пи-связь) Химические связи, образующиеся в результате «бокового» перекрывания электронных орбиталей вне линии связи, т.е. в
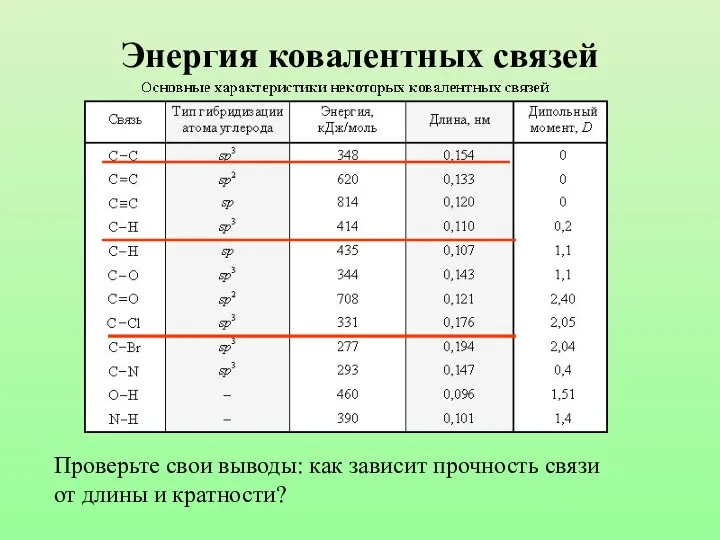
- 13. Энергия ковалентных связей Проверьте свои выводы: как зависит прочность связи от длины и кратности?
- 14. Запомни! Атомы углерода в органических соединениях всегда четырехвалентны. Атомы углерода могут находиться в трех валентных состояниях.
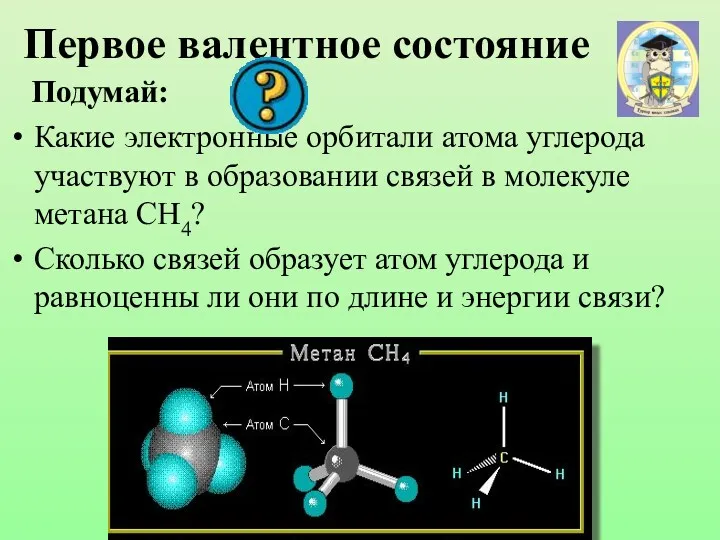
- 15. Первое валентное состояние Подумай: Какие электронные орбитали атома углерода участвуют в образовании связей в молекуле метана
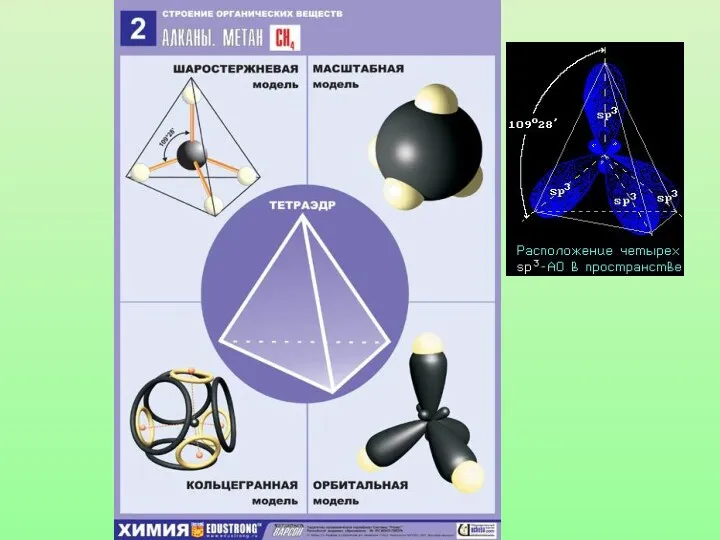
- 16. Модель молекулы метана Электронные орбитали атома углерода в молекуле метана Шаростержневая модель молекулы метана
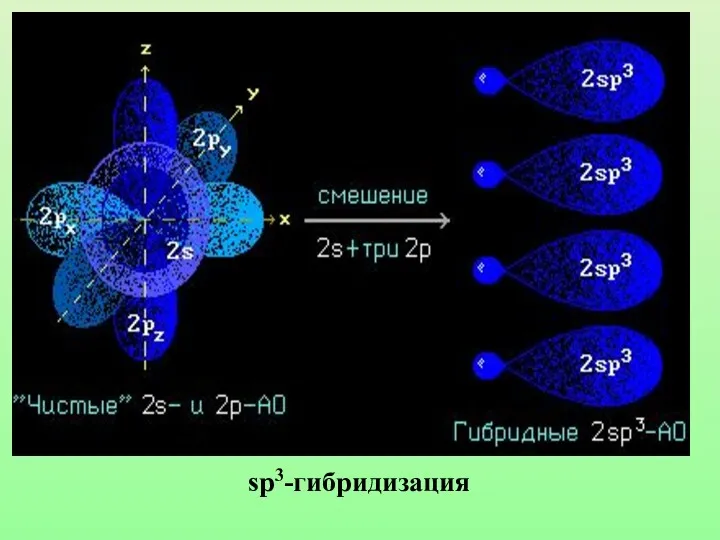
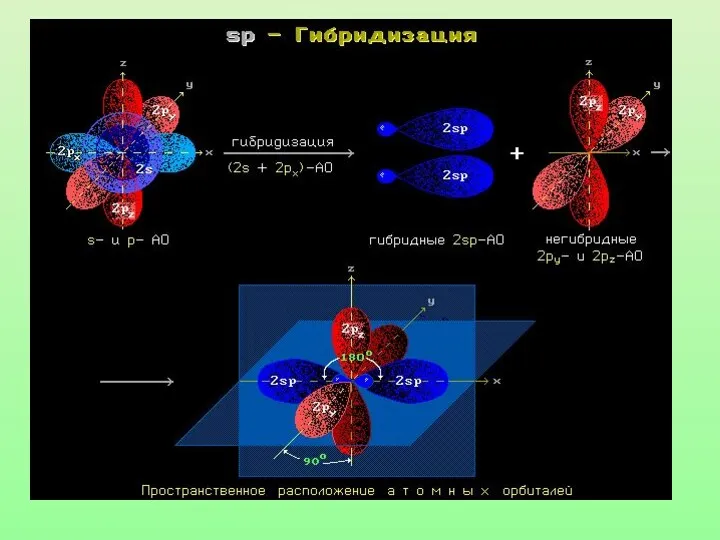
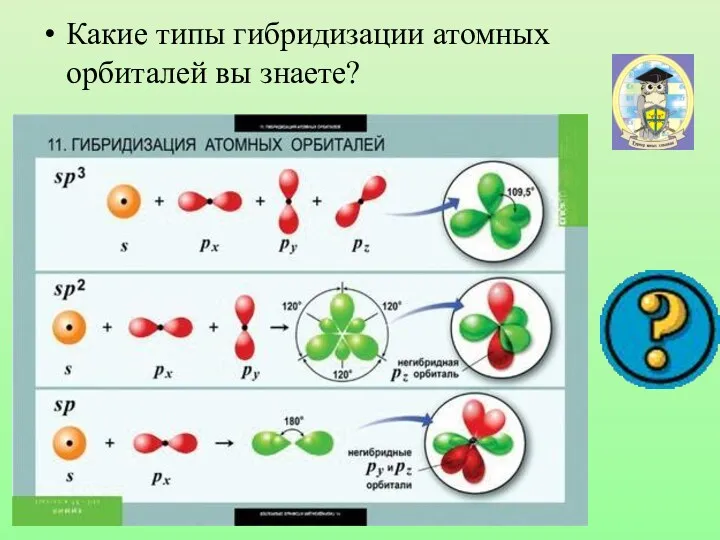
- 17. Гибридизацией орбиталей называется процесс выравнивания их по форме и энергии
- 18. sp3-гибридизация
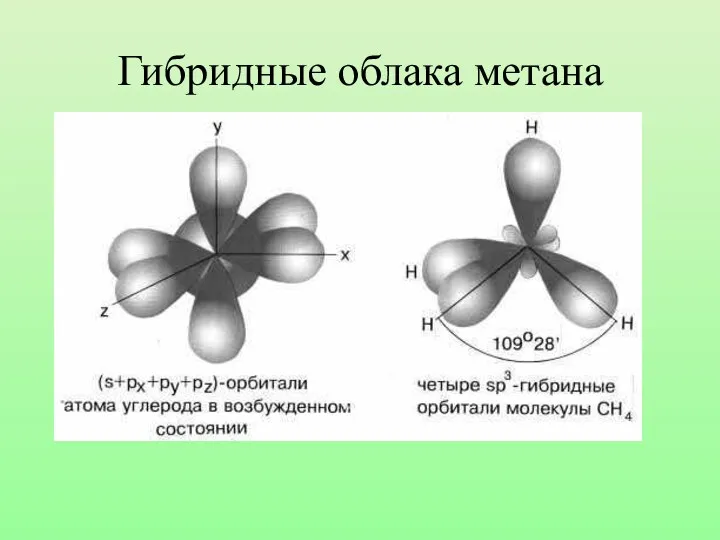
- 19. Гибридные облака метана
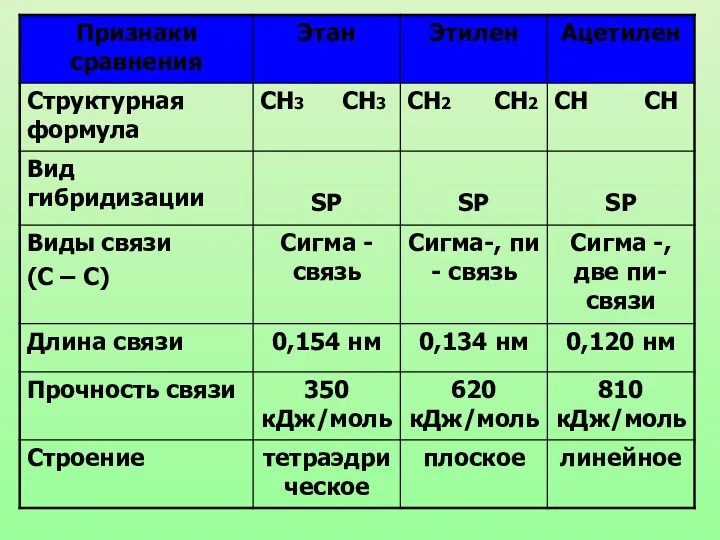
- 21. Запомни! Характеристики sp3-гибридизации: Угол связи 1090 28/ Все связи сигма (б-связи) Все связи одинарные Длина одинарной
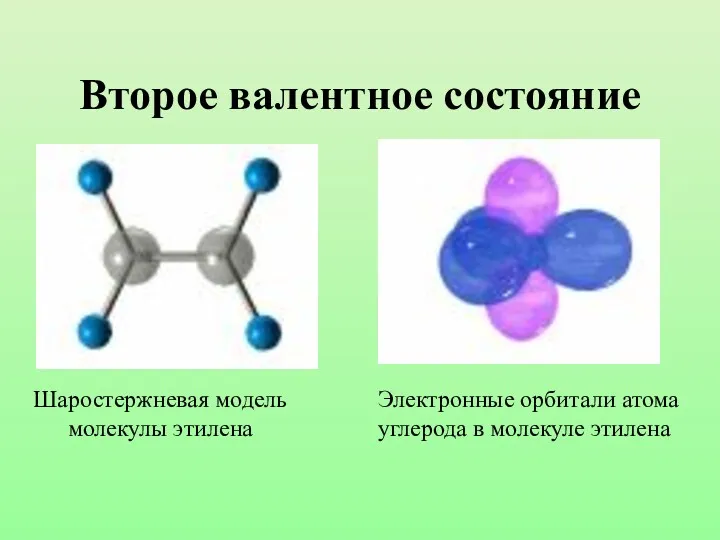
- 22. Второе валентное состояние Шаростержневая модель молекулы этилена Электронные орбитали атома углерода в молекуле этилена
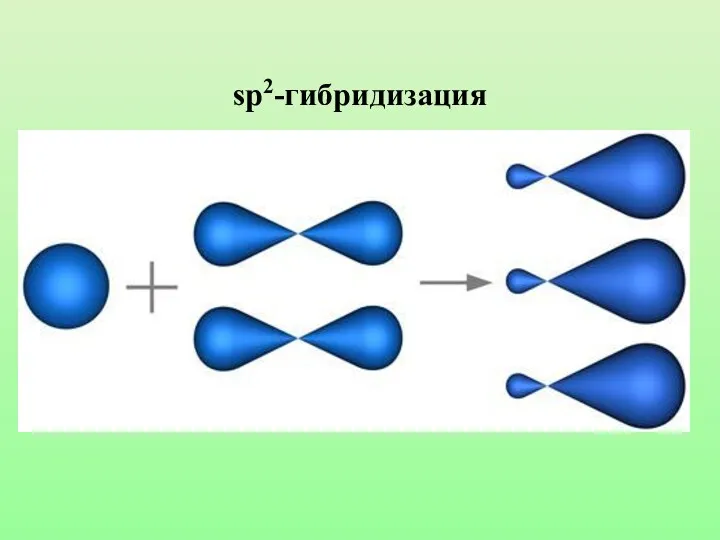
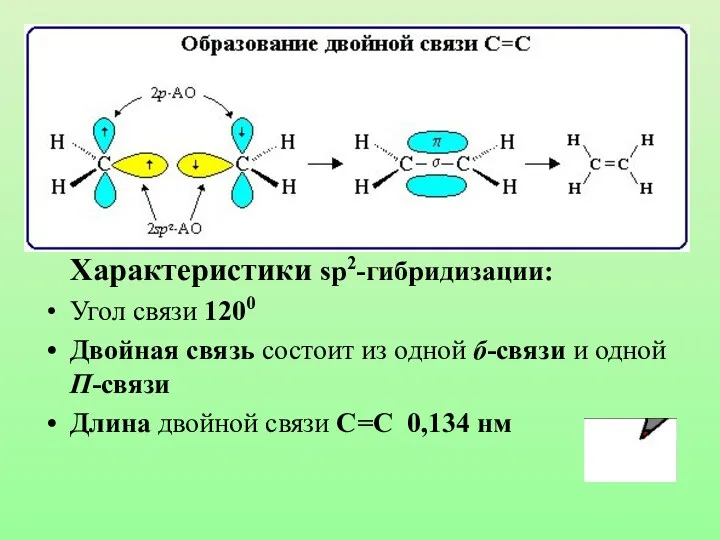
- 23. sp2-гибридизация
- 24. Характеристики sp2-гибридизации: Угол связи 1200 Двойная связь состоит из одной б-связи и одной П-связи Длина двойной
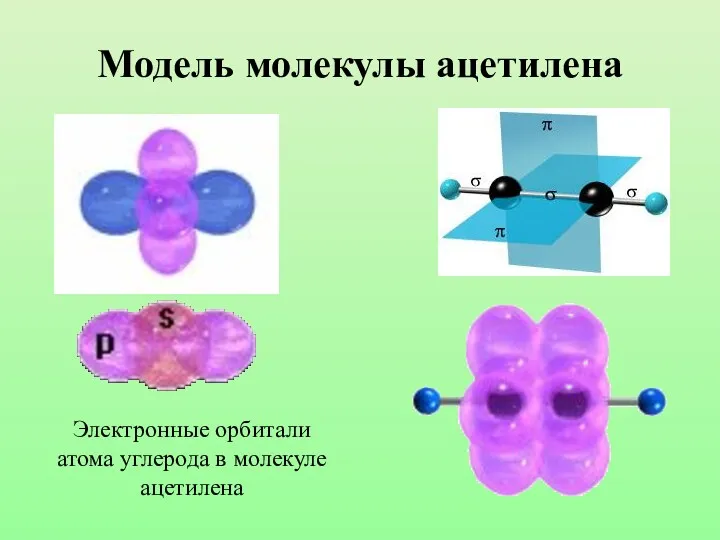
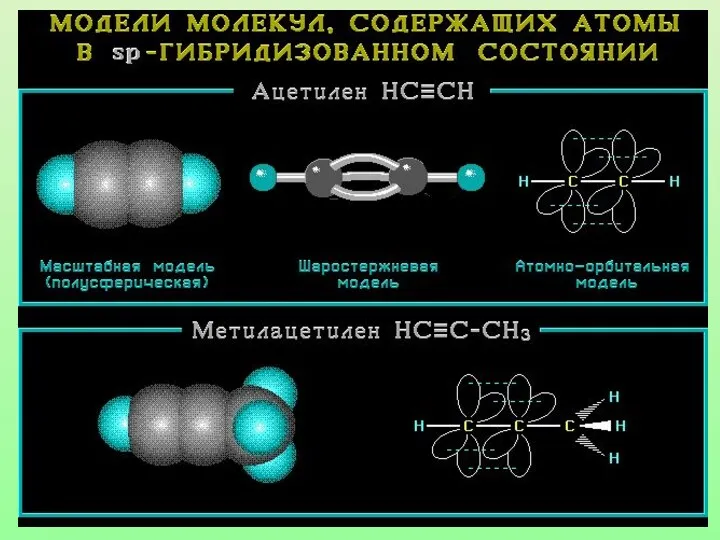
- 26. Модель молекулы ацетилена Электронные орбитали атома углерода в молекуле ацетилена
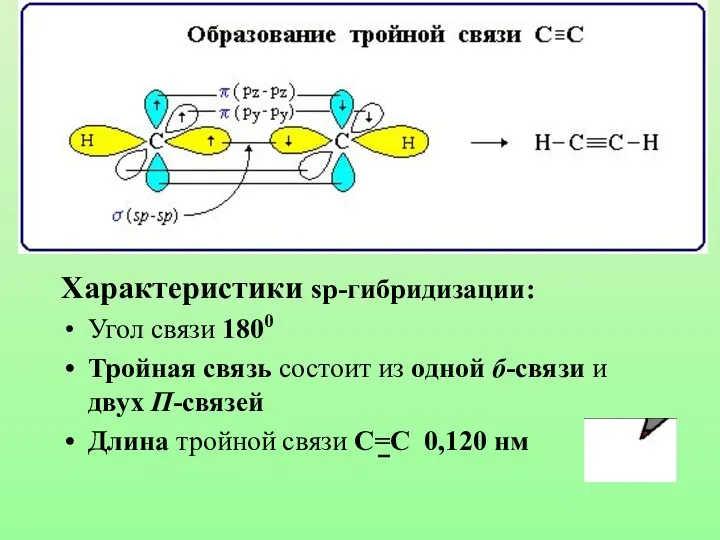
- 27. Характеристики sp-гибридизации: Угол связи 1800 Тройная связь состоит из одной б-связи и двух П-связей Длина тройной
- 30. Какие типы гибридизации атомных орбиталей вы знаете?
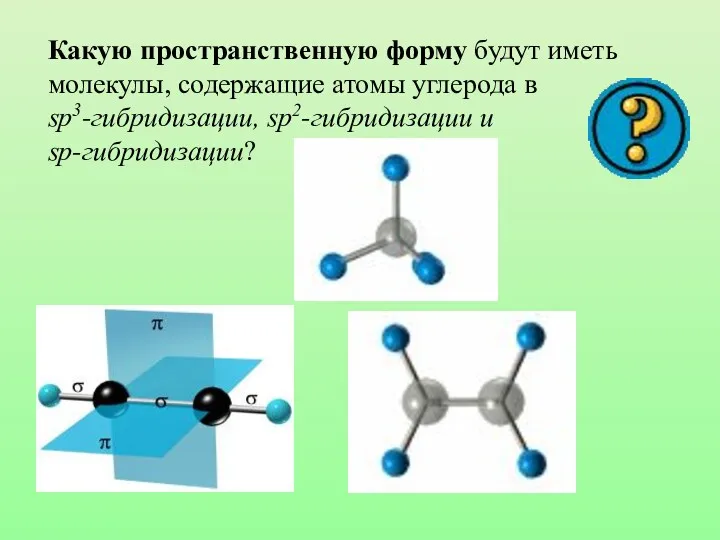
- 31. Какую пространственную форму будут иметь молекулы, содержащие атомы углерода в sp3-гибридизации, sp2-гибридизации и sp-гибридизации?
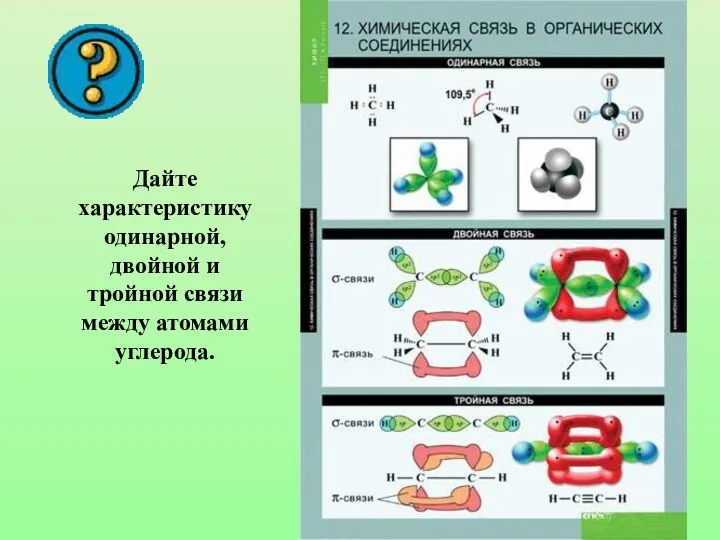
- 32. Дайте характеристику одинарной, двойной и тройной связи между атомами углерода.
- 33. Домашнее задание Параграф 3, вопросы 1-5 Параграф 4, вопросы 1-4 Выучить характеристики валентных состояний атома углерода
- 35. Сигма связи
- 37. Скачать презентацию












 Курс хімії за 11 клас
Курс хімії за 11 клас Кремний и его соединения
Кремний и его соединения Кислоты. Серная кислота-H₂SO₄
Кислоты. Серная кислота-H₂SO₄ Подготовка к ОГЭ по химии
Подготовка к ОГЭ по химии Кислотно-основные (протолитические) равновесия
Кислотно-основные (протолитические) равновесия Природный и синтетический каучуки. Резина
Природный и синтетический каучуки. Резина Аккумуляторные батареи
Аккумуляторные батареи Альдегіди
Альдегіди Алюминий туралы мәлімет
Алюминий туралы мәлімет Имидазол. Получение, свойства, анализ, применение, условия хранения лекарственных препаратов производных имидазола
Имидазол. Получение, свойства, анализ, применение, условия хранения лекарственных препаратов производных имидазола Роль химии в создании новых материалов
Роль химии в создании новых материалов Химические опасности. Токсичные элементы. Мышьяк. Свинец. Ртуть
Химические опасности. Токсичные элементы. Мышьяк. Свинец. Ртуть Бета-лактамиды (природные и полусинтетические пенициллины и цефалоспорины)
Бета-лактамиды (природные и полусинтетические пенициллины и цефалоспорины) Многоатомные спирты (10 класс)
Многоатомные спирты (10 класс) Железо и его соединения
Железо и его соединения Термодинамика химических процессов
Термодинамика химических процессов Класифікація неорганічних сполук. Оксиди
Класифікація неорганічних сполук. Оксиди Kарбонові кислоти. Гетерофункціональні похідні карбонових кислот
Kарбонові кислоти. Гетерофункціональні похідні карбонових кислот Азот, строение, свойства. Круговорот азота в природе
Азот, строение, свойства. Круговорот азота в природе Оптические свойства дисперсных систем. Оптические методы исследования коллоидных систем
Оптические свойства дисперсных систем. Оптические методы исследования коллоидных систем Медико-биологическое значение неметаллов. Йод
Медико-биологическое значение неметаллов. Йод Химия. Лекция 1. Растворы
Химия. Лекция 1. Растворы Фосфор и его соединения. Электронные формулы атома фосфора
Фосфор и его соединения. Электронные формулы атома фосфора Многоатомные и одноатомные спирты
Многоатомные и одноатомные спирты 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 Степени окисления атомов и формулы веществ
Степени окисления атомов и формулы веществ Карбоновые кислоты. (Лекция 6.3)
Карбоновые кислоты. (Лекция 6.3) Открытие Периодического закона
Открытие Периодического закона