Содержание
- 2. План занятия Нуклеиновые кислоты – строение, биологическая роль; Методы исследования нуклеиновых кислот (самостоятельная работа) Репликация ДНК;
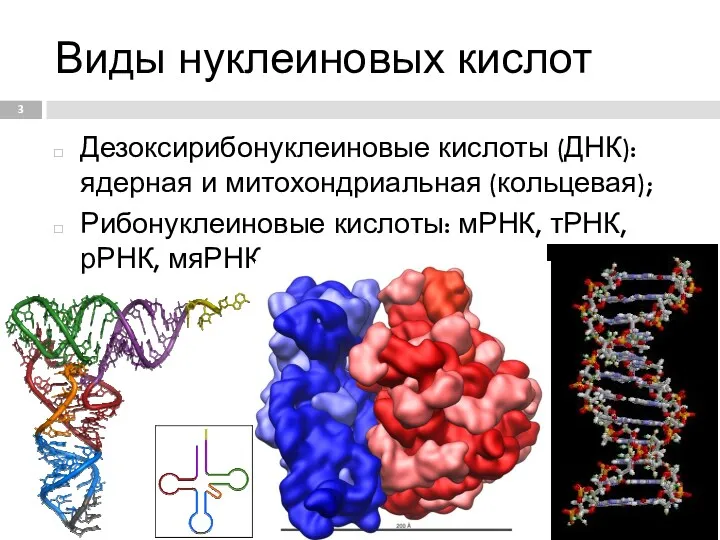
- 3. Виды нуклеиновых кислот Дезоксирибонуклеиновые кислоты (ДНК): ядерная и митохондриальная (кольцевая); Рибонуклеиновые кислоты: мРНК, тРНК, рРНК, мяРНК
- 4. Функции ДНК Хранение запаса генетической информации, необходимой для кодирования структуры всех белков и РНК каждого вида
- 5. Функции РНК Перевод языка нуклеотидов в язык аминокислот белковых молекул; Формируют нуклеопротеидный комплекс рибосом; Регулируют метаболизм
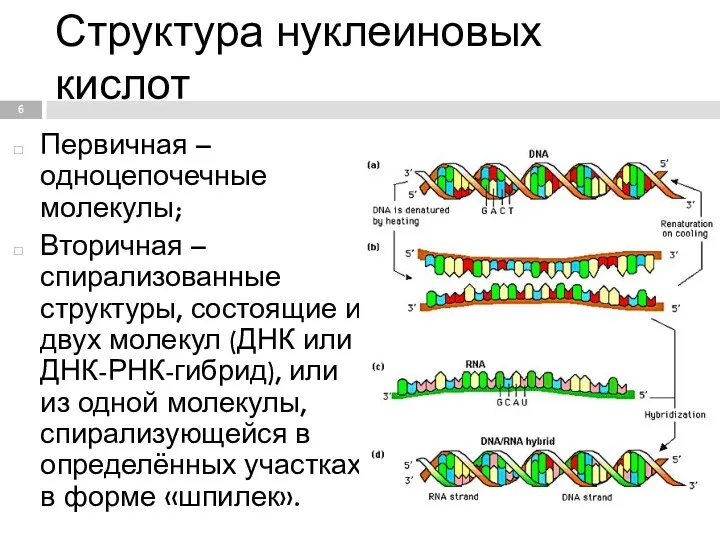
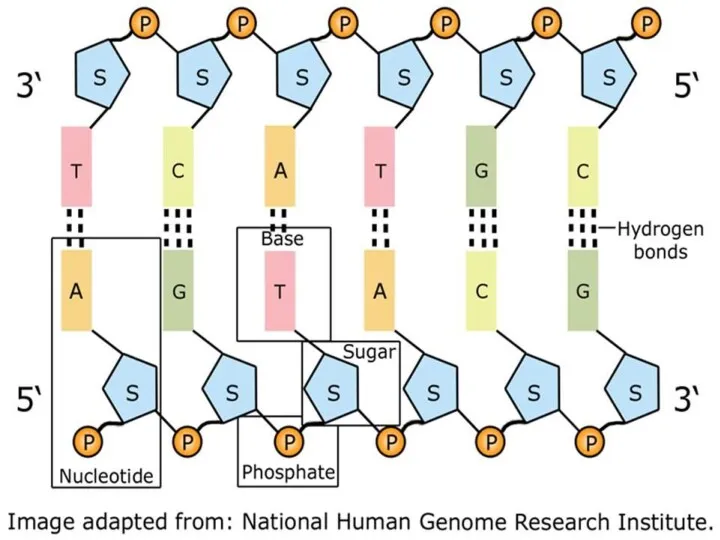
- 6. Структура нуклеиновых кислот Первичная – одноцепочечные молекулы; Вторичная – спирализованные структуры, состоящие из двух молекул (ДНК
- 7. Вторичная структура ДНК
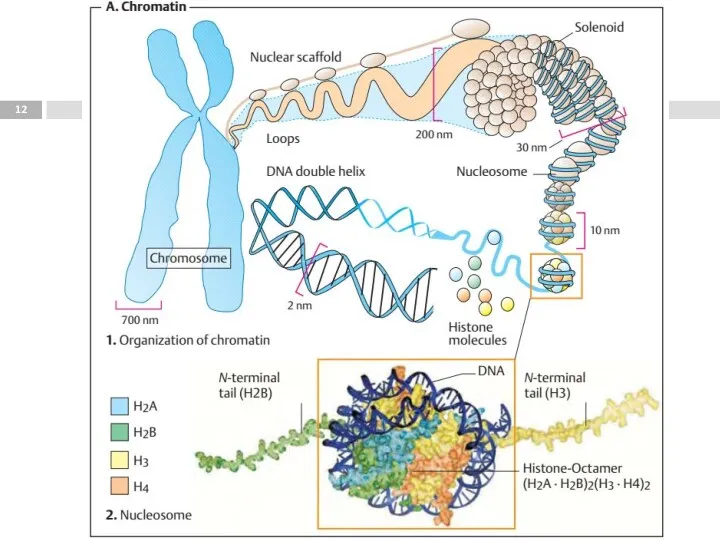
- 8. Вторичная структура ДНК Макромолекулы, объединённые водородными связями между остатками азотистых оснований, в двухвинтовую надмолекулярную структуру. Относительно
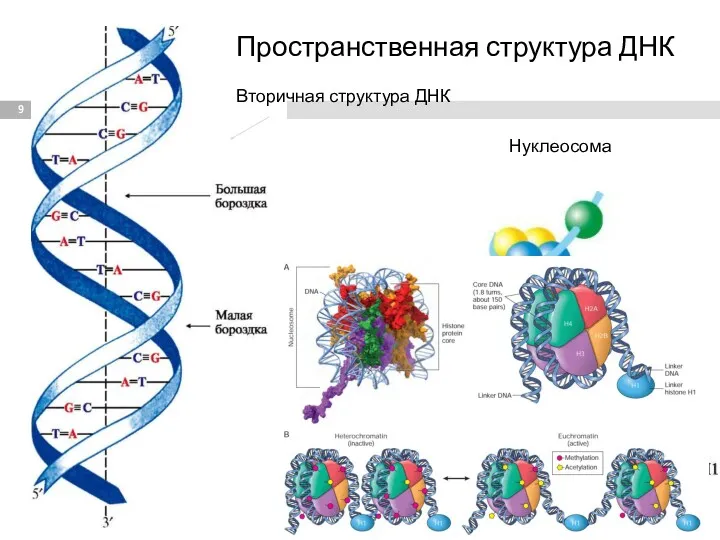
- 9. Вторичная структура ДНК Нуклеосома Пространственная структура ДНК
- 11. Третичная структура ДНК ДНК в клетке имеет длину 1,74 м, однако молекула упакована в хромосомы, которые
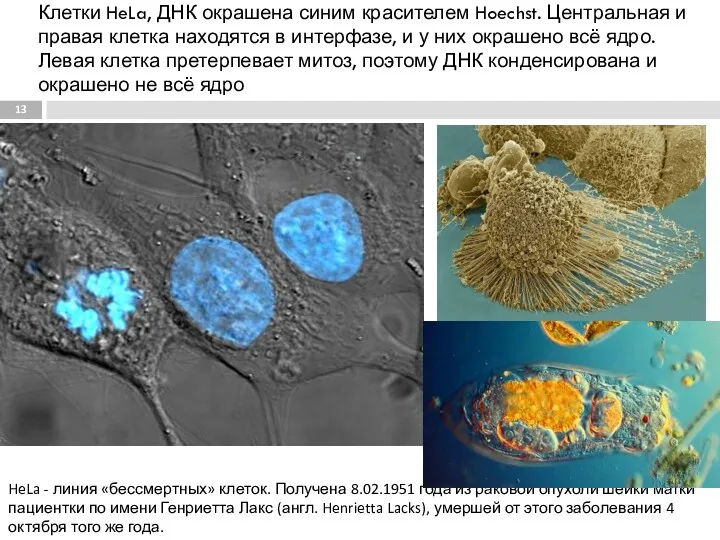
- 13. Клетки HeLa, ДНК окрашена синим красителем Hoechst. Центральная и правая клетка находятся в интерфазе, и у
- 14. Методы изучения нуклеиновых кислот Рестрикционный анализ ДНК; Блоттинг: Саузерн- и нозерн-блоттинг технологии; Секвенирование ДНК; Синтез нуклеиновых
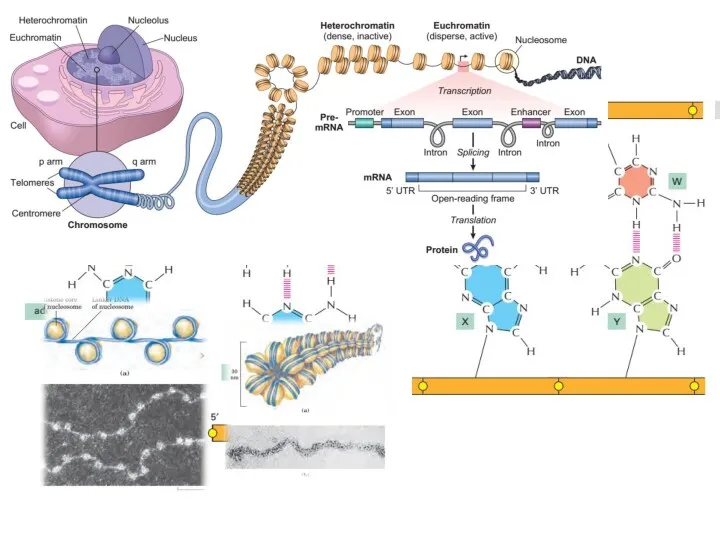
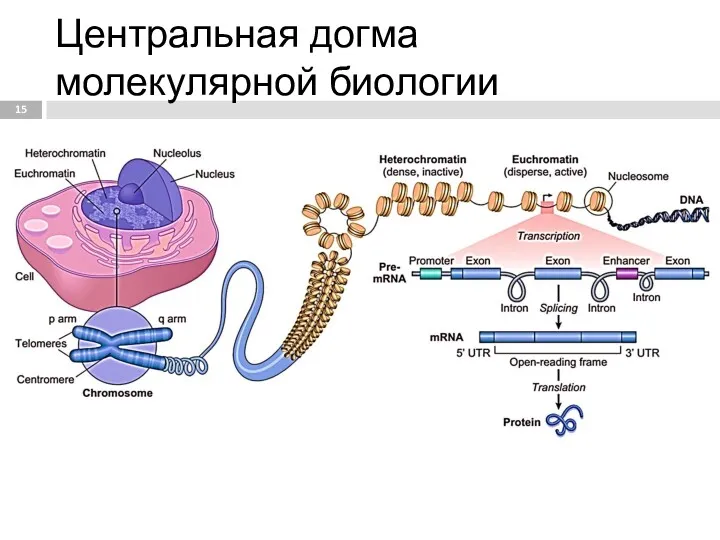
- 15. Центральная догма молекулярной биологии
- 16. Репликация (от лат. replicatio - возобновление) - процесс синтеза дочерней ДНК на матрице родительской молекулы ДНК.
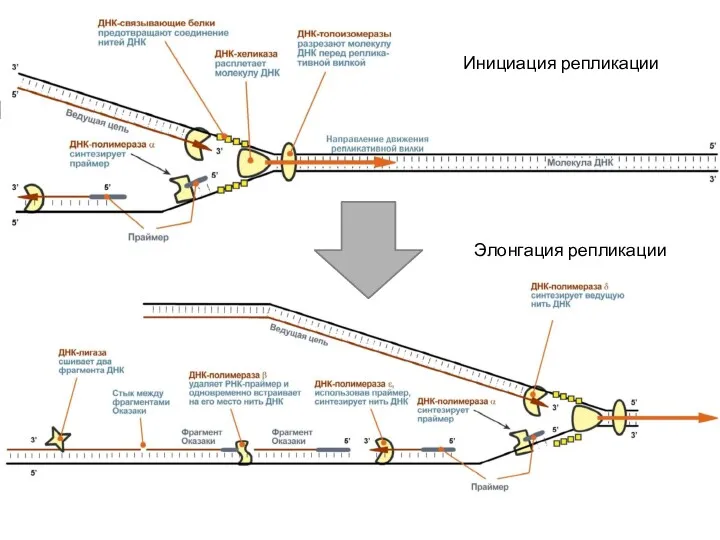
- 17. Этапы репликации Инициация – образование репликативных «пузыря» и вилок; Элонгация – синтез дочерних цепей на матрице
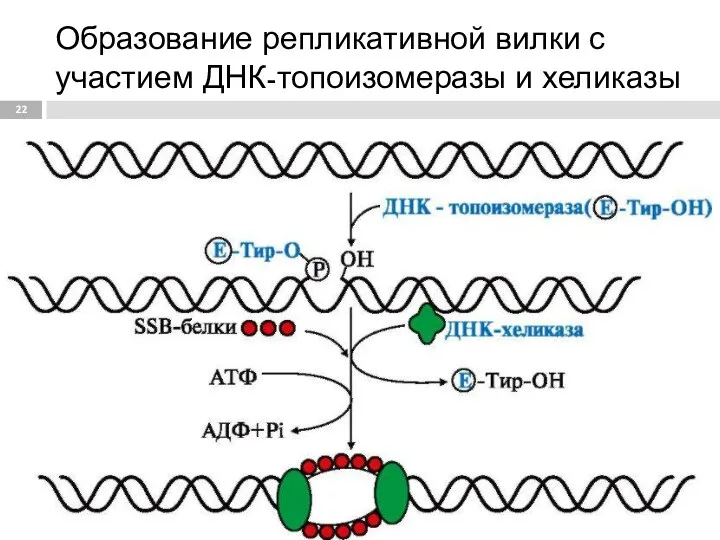
- 19. Инициация (начало) репликации ДНК-топоизомеразы, находясь перед репликативной вилкой, разрезают молекулу ДНК для облегчения ее расплетания и
- 20. ДНК-связывающие белки (ssb- protein от англ. Single-strand binding protein) связывают расплетённые нити ДНК и стабилизируют их,
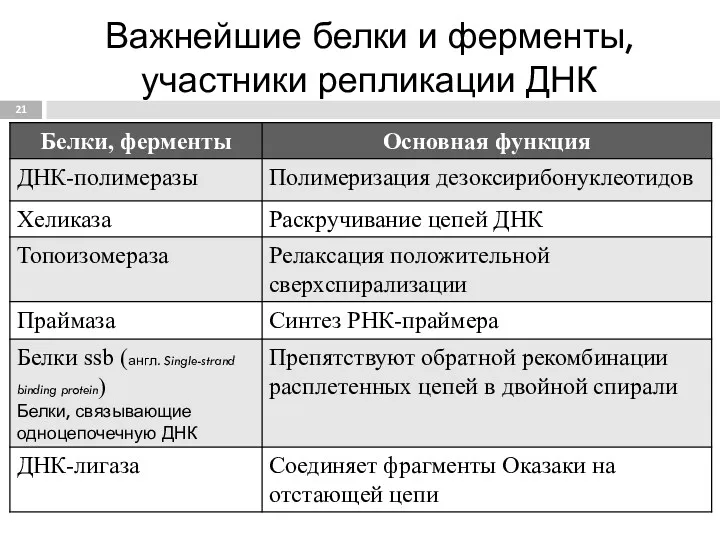
- 21. Важнейшие белки и ферменты, участники репликации ДНК
- 22. Образование репликативной вилки с участием ДНК-топоизомеразы и хеликазы
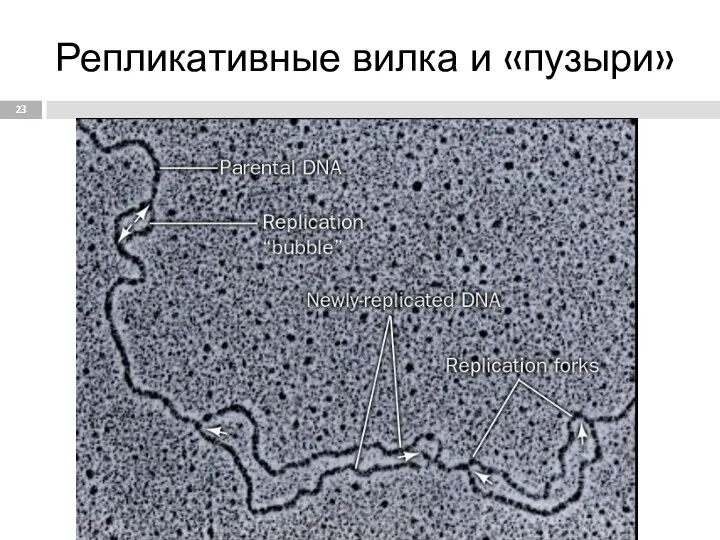
- 23. Репликативные вилка и «пузыри»
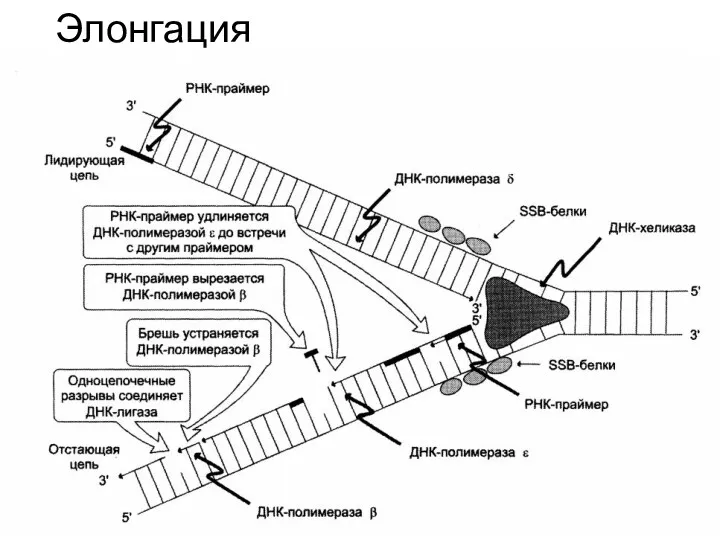
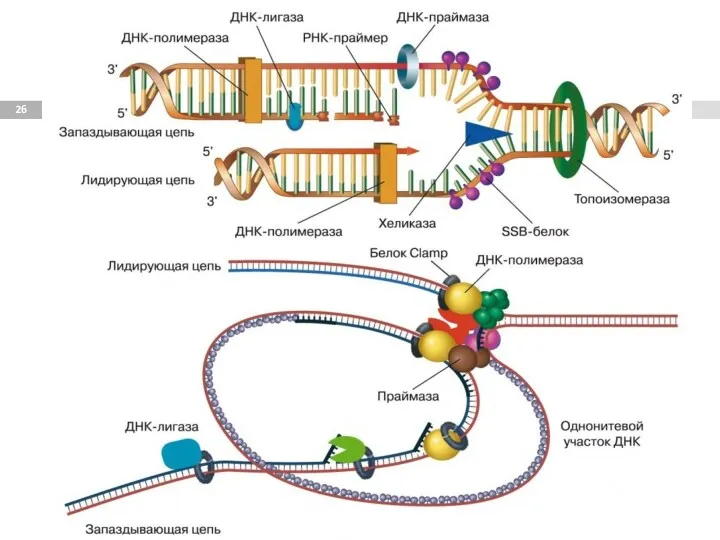
- 24. Элонгация
- 25. Инициация репликации Элонгация репликации
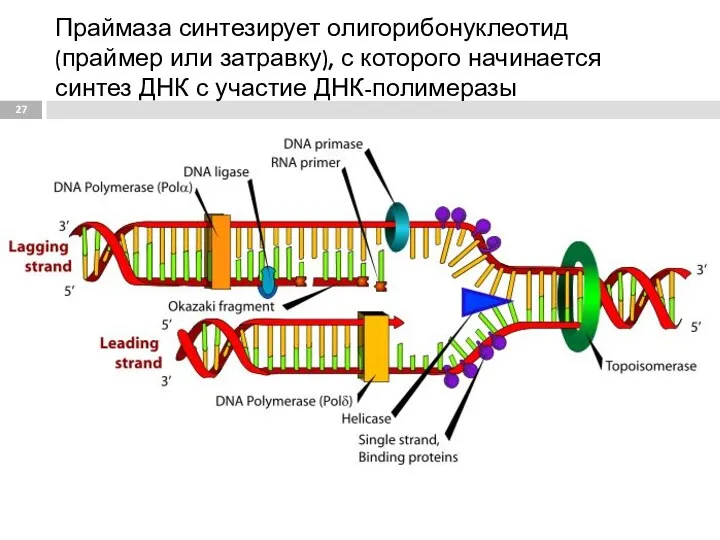
- 27. Праймаза синтезирует олигорибонуклеотид (праймер или затравку), с которого начинается синтез ДНК с участие ДНК-полимеразы
- 28. В отстающей нити праймер удаляется эндонуклеазой или РНК-азой. Затем ДНК-полимераза β заполняет образованную «брешь». Связывание 3'-ОН-группы
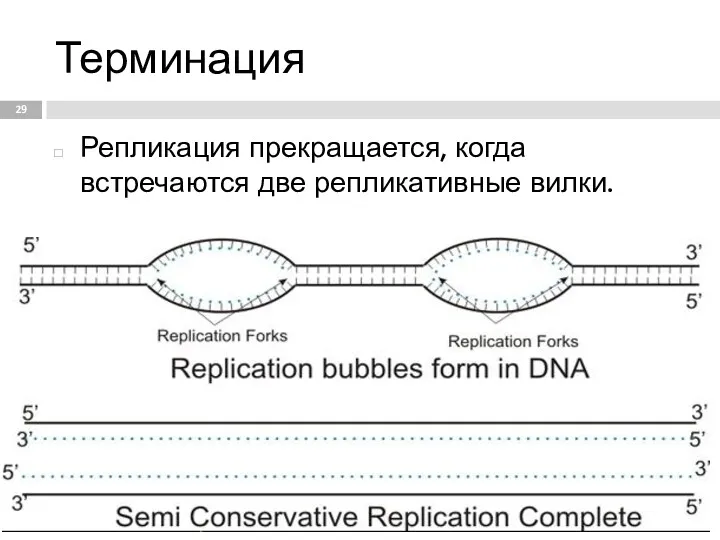
- 29. Терминация Репликация прекращается, когда встречаются две репликативные вилки.
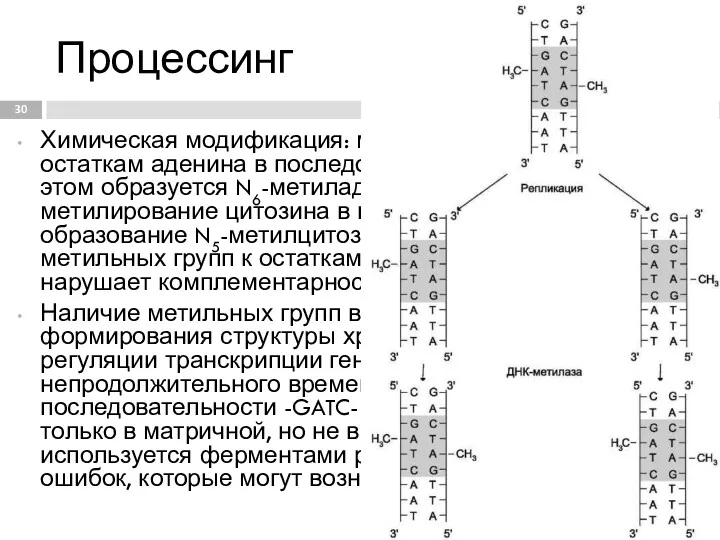
- 30. Процессинг Химическая модификация: метилирование цепей по остаткам аденина в последовательности -ГАТЦ-, при этом образуется N6-метиладенин, а
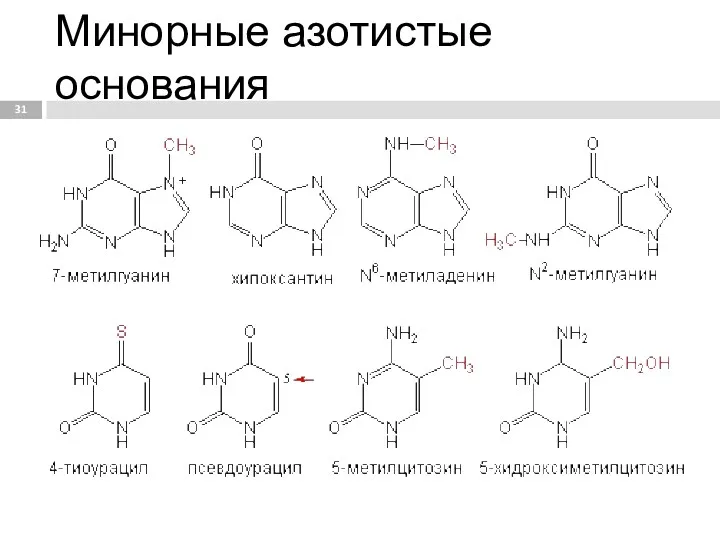
- 31. Минорные азотистые основания
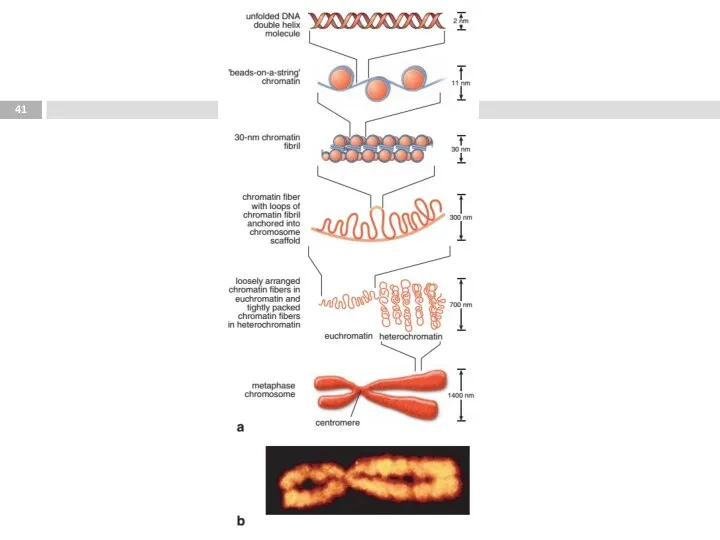
- 32. Процессинг Спирализация – образование двухспиральной структуры; Суперспирализация – формирование хроматина; Стабилизация – формирование хромосом с участками
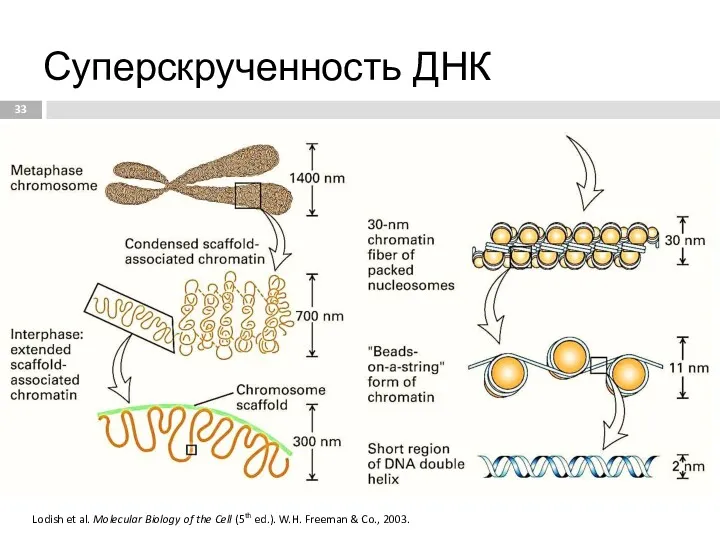
- 33. Суперскрученность ДНК Lodish et al. Molecular Biology of the Cell (5th ed.). W.H. Freeman & Co.,
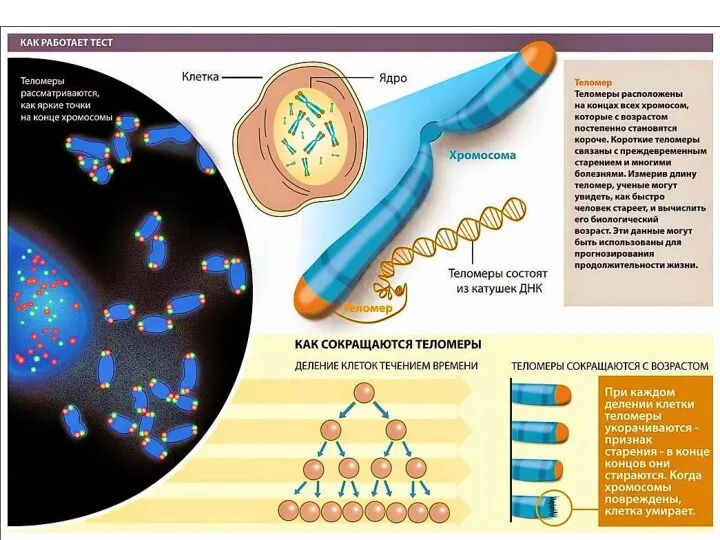
- 34. Теломеры концевые участки хромосом. Теломерные участки хромосом характеризуются отсутствием способности к соединению с другими хромосомами или
- 35. У человека теломера состоит из многократно повторяющейся нуклеотидной последовательности ДНК – ТТАГГГ. Такие повторы идут на
- 36. Теломеры Теломеры принимают участие в поддержании жизненно важных процессов в клетке: защищают хромосомы от деградации и
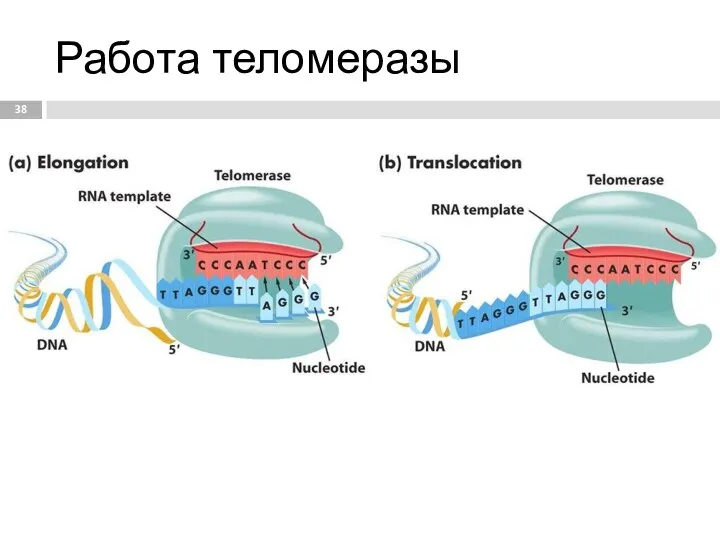
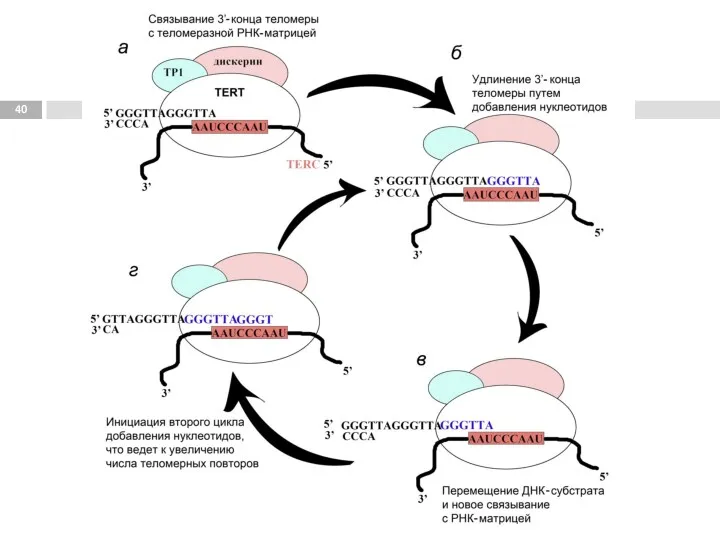
- 38. Работа теломеразы
- 39. Синтез теломерного повтора происходит в 3 этапа: 1. Связывание. Удлиняемый 3'-конец теломеры комплементарно соединяется с РНК-матрицей
- 42. Репарация ДНК Повреждения ДНК: Гидролитическое отщепление NН2-групп от цитозина, аденина и гуанина с образованием урацила, гипоксантина
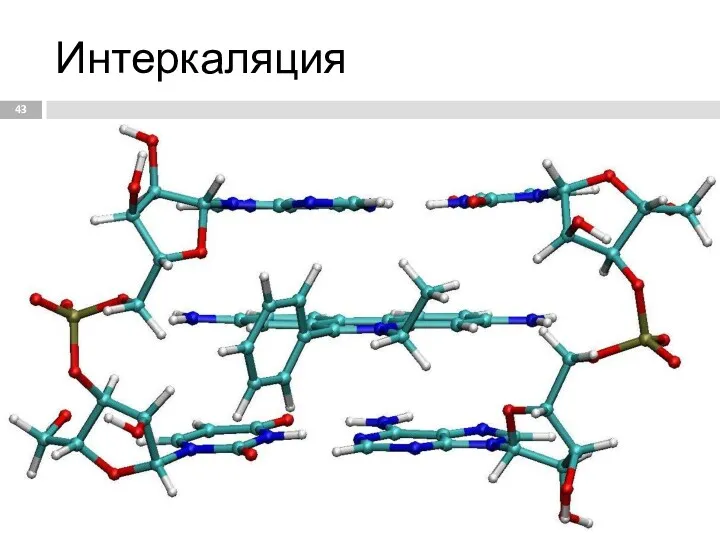
- 43. Интеркаляция Молекула бромистого этидия интеркалирует между адениловыми основаниями ДНК дуплекса. ДНК интеркаляторы используются при химиотерапии как
- 44. Повреждение ДНК и вызывающие их факторы
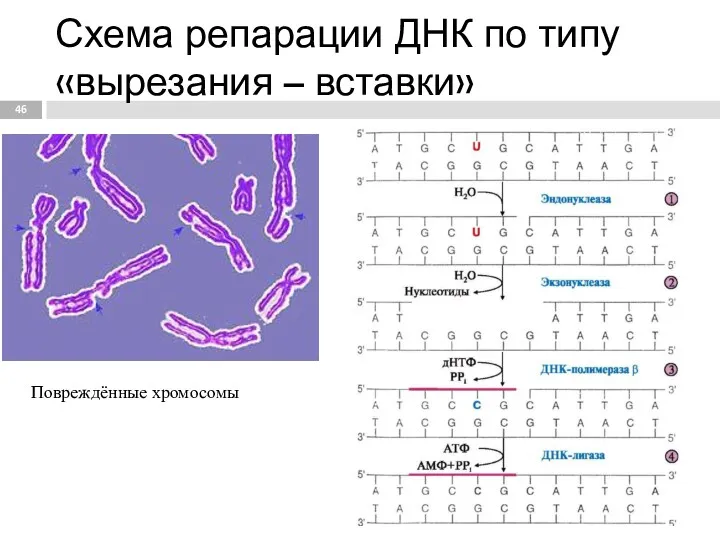
- 46. Повреждённые хромосомы Схема репарации ДНК по типу «вырезания – вставки»
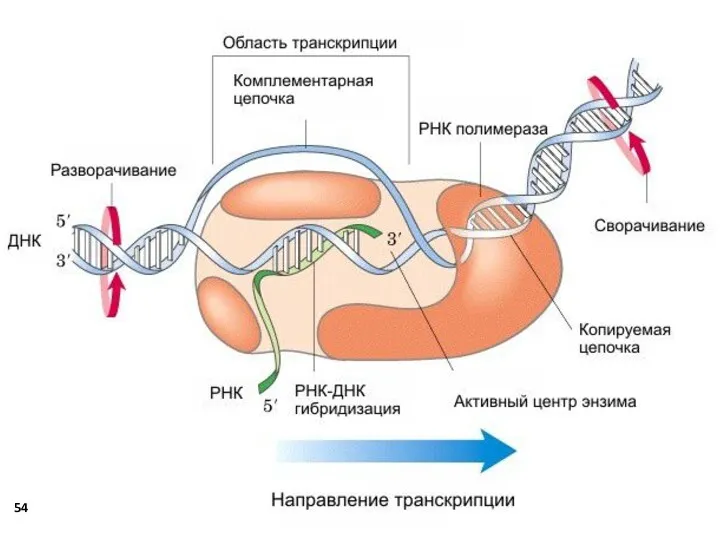
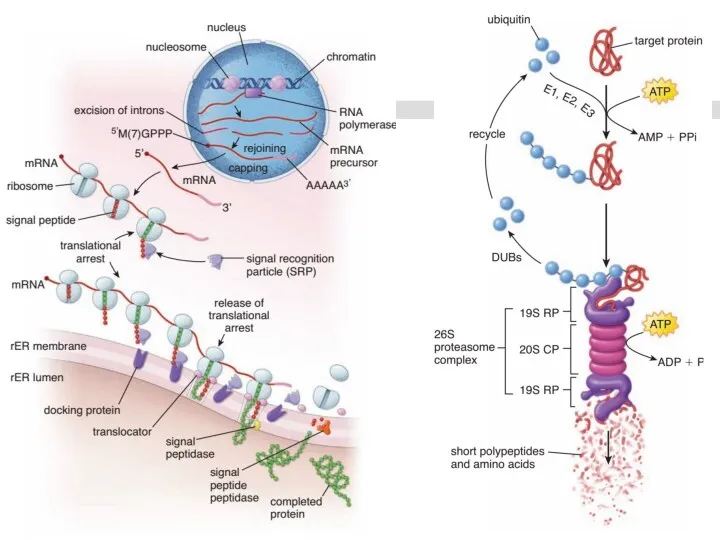
- 47. Транскрипция РНК Процесс синтеза РНК на матрице ДНК. Транскрипция осуществляется только с одной из цепей ДНК,
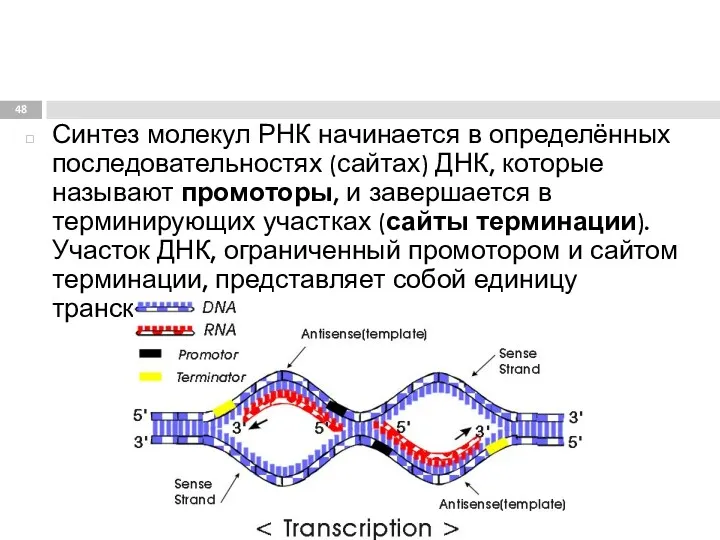
- 48. Синтез молекул РНК начинается в определённых последовательностях (сайтах) ДНК, которые называют промоторы, и завершается в терминирующих
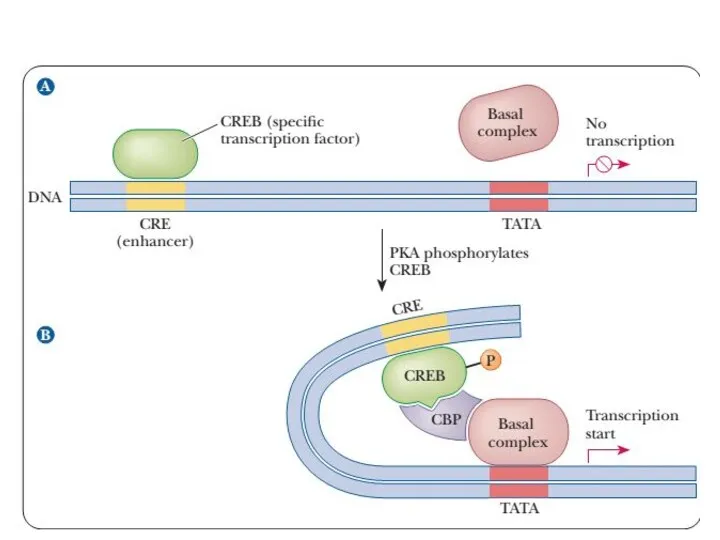
- 49. Транскрипционые факторы белки , взаимодействующие с определёнными регуляторными сайтами и ускоряющие или замедляющие процесс транскрипции. Транскрипционные
- 50. Инициация транскрипции РНК Активация промотора происходит с помощью большого белка - ТАТА-фактора, который присоединяется к некодирующей
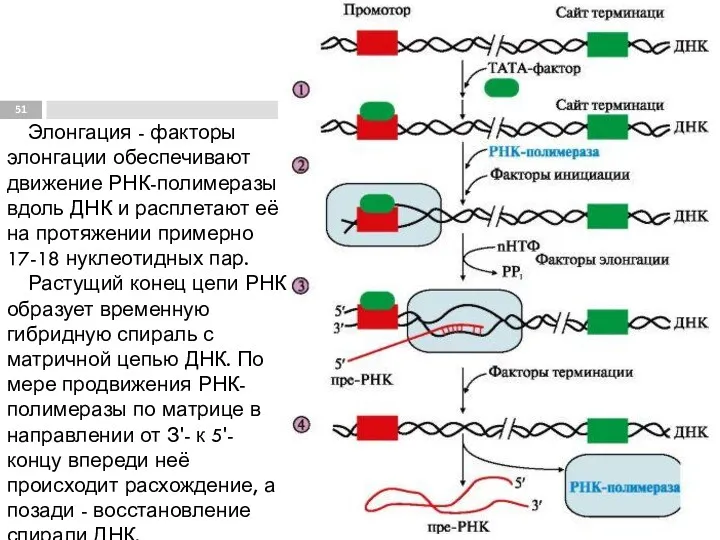
- 51. Элонгация - факторы элонгации обеспечивают движение РНК-полимеразы вдоль ДНК и расплетают её на протяжении примерно 17-18
- 52. Терминация транскрипции РНК Раскручивание двойной спирали ДНК в области сайта терминации делает его доступным для фактора
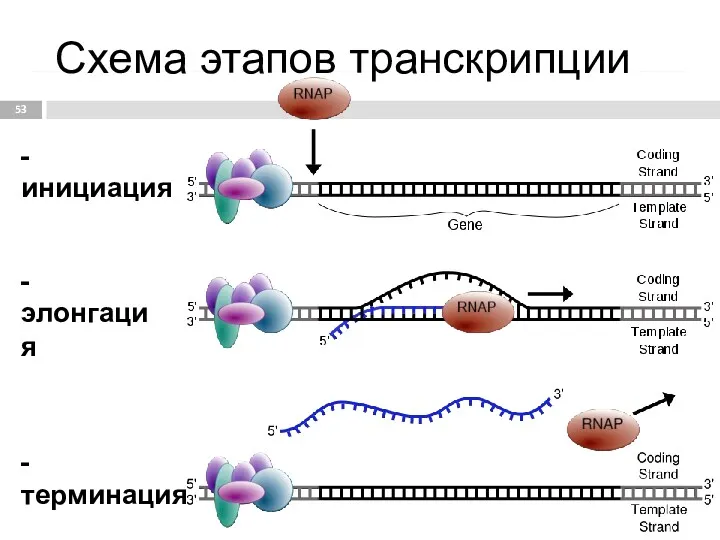
- 53. - инициация - элонгация - терминация Схема этапов транскрипции
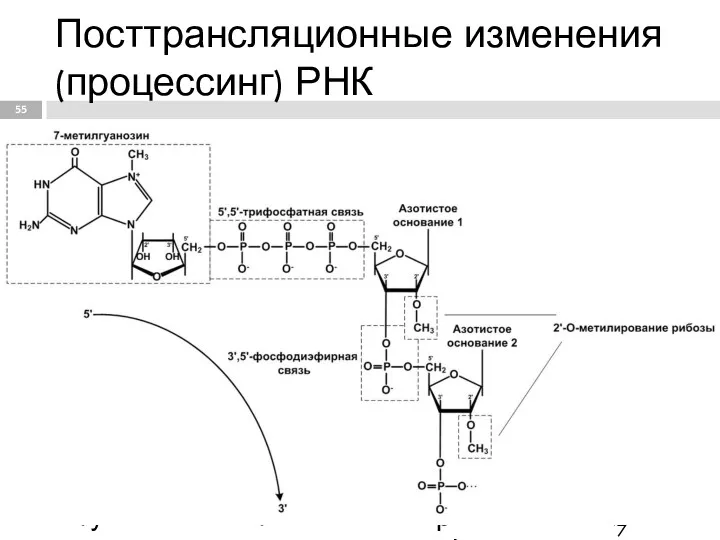
- 55. Посттрансляционные изменения (процессинг) РНК - Модификация 5'-конца начинается на стадии элонгации. Процесс кепирования (кеширования) осуществляется гуанилилтрансфераза,
- 56. Значение кепирования Модифицированный 5'-конец обеспечивает инициацию трансляции, удлиняет время жизни мРНК, защищая её от действия 5'-экзонуклеаз
- 57. Полиаденилирование 3'-конца Фермент полиА-полимераза формирует полиаденилатный «хвост» РНК. Наличие полиА-последовательности на З'-конце облегчает выход мРНК из
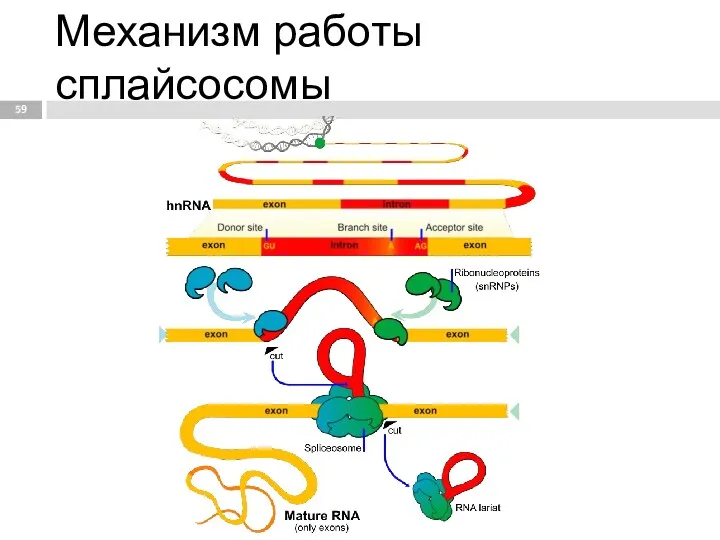
- 58. Сплайсинг процесс вырезания интронов из молекул пре-мРНК и соединения экзонов, в ходе процессинга РНК. Осуществляется сплайсосомой
- 59. Механизм работы сплайсосомы
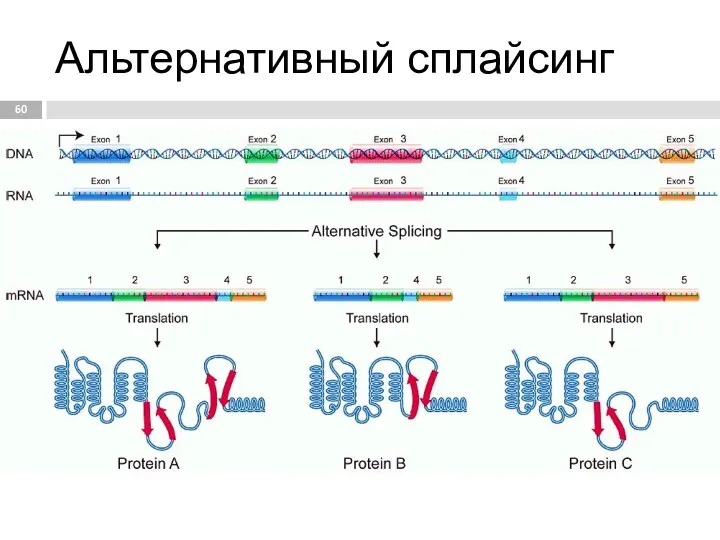
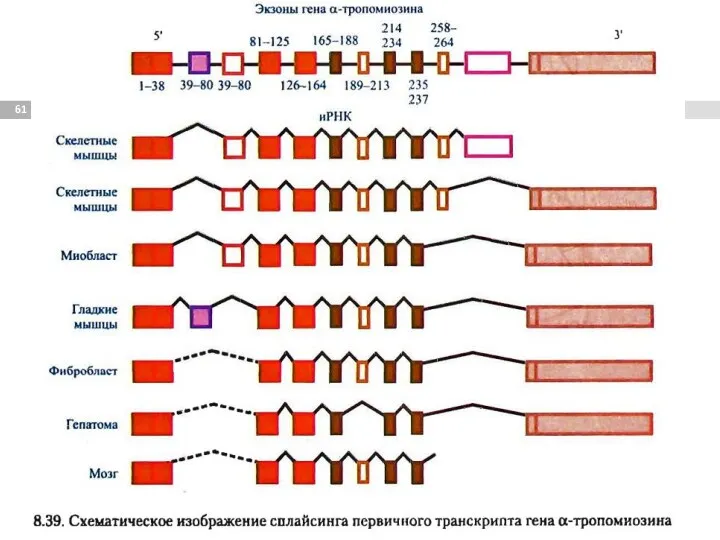
- 60. Альтернативный сплайсинг
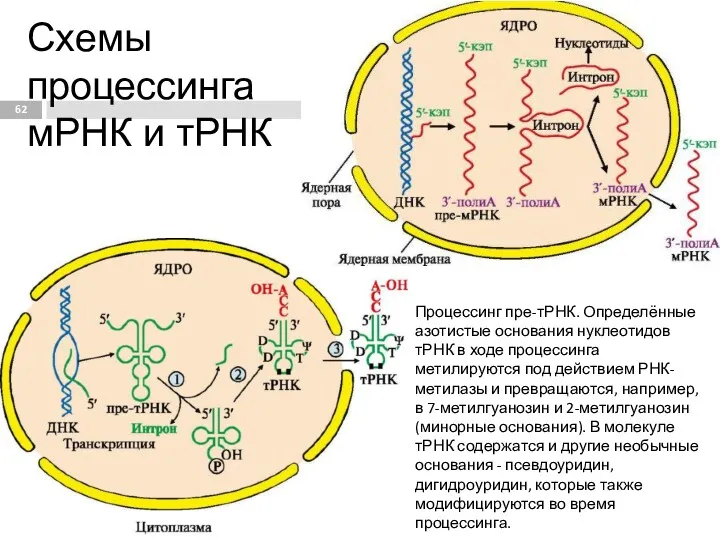
- 62. Схемы процессинга мРНК и тРНК Процессинг пре-тРНК. Определённые азотистые основания нуклеотидов тРНК в ходе процессинга метилируются
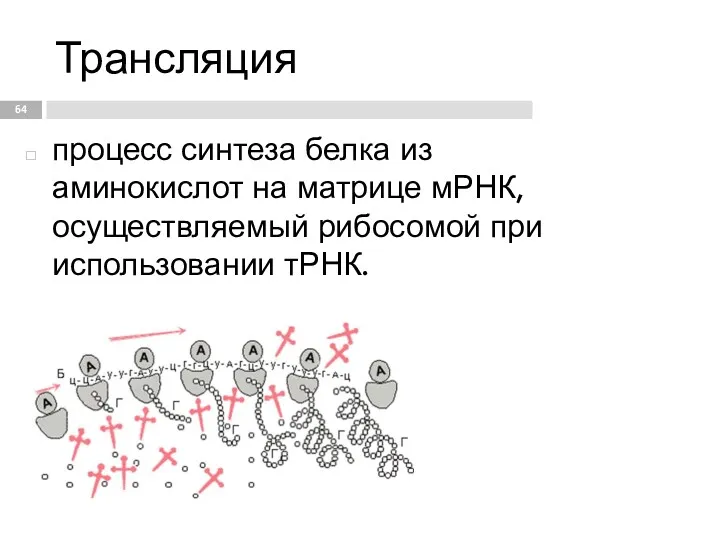
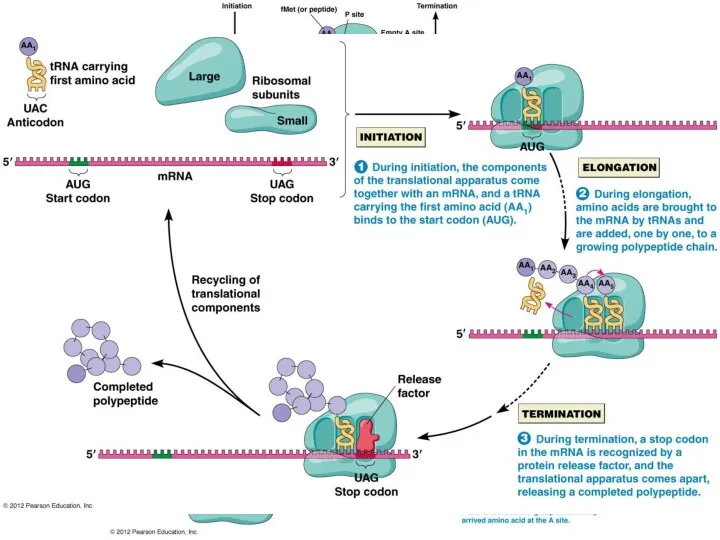
- 64. Трансляция процесс синтеза белка из аминокислот на матрице мРНК, осуществляемый рибосомой при использовании тРНК.
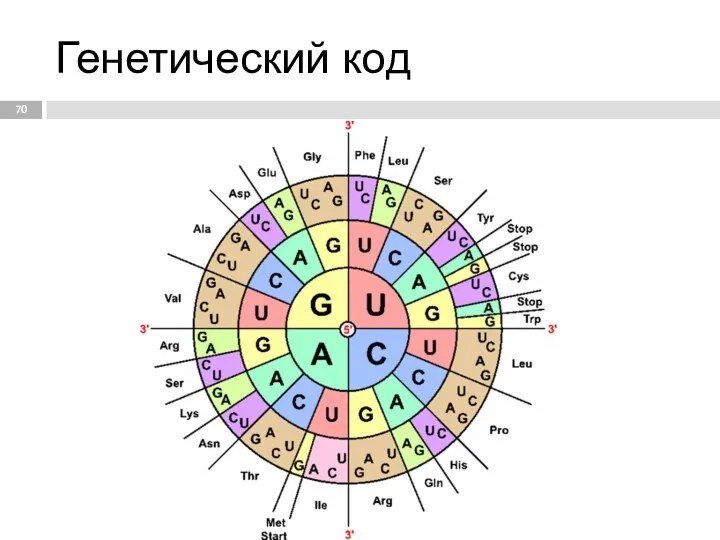
- 65. Генетический код способ кодирования информации о строении белков в виде нуклеотидной последовательности. Он предназначен для перевода
- 66. Свойства генетического кода Триплетность – три нуклеотида формируют кодон, кодирующий аминокислоту. Всего насчитывают 61 смысловой кодон.
- 67. Колинеарность – последовательность кодонов соответствует последовательности аминокислот в кодируемом белке. Неперекрываемость – триплеты не накладываются друг
- 68. Адапторная роль транспортных РНК тРНК являются единственным посредником между 4-х буквенной последовательностью нуклеиновых кислот и 20-ти
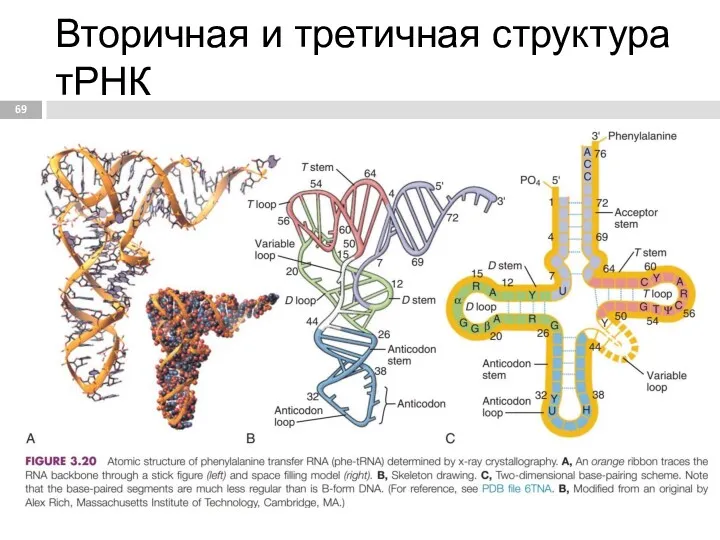
- 69. Вторичная и третичная структура тРНК
- 70. Генетический код
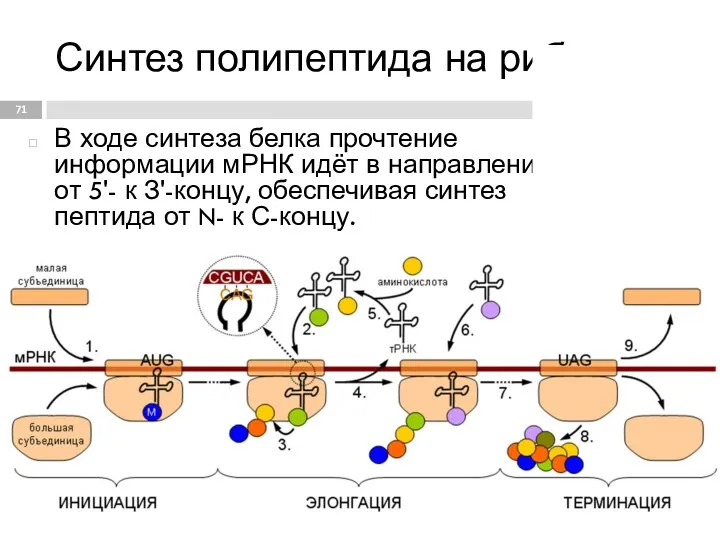
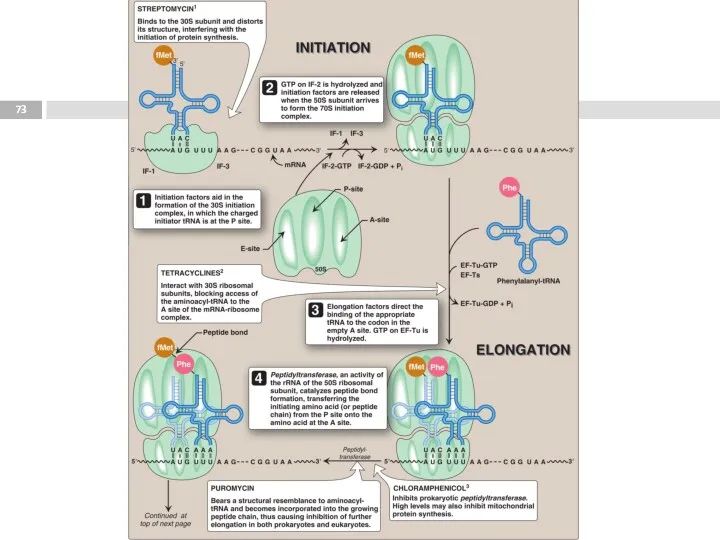
- 71. Синтез полипептида на рибосоме В ходе синтеза белка прочтение информации мРНК идёт в направлении от 5'-
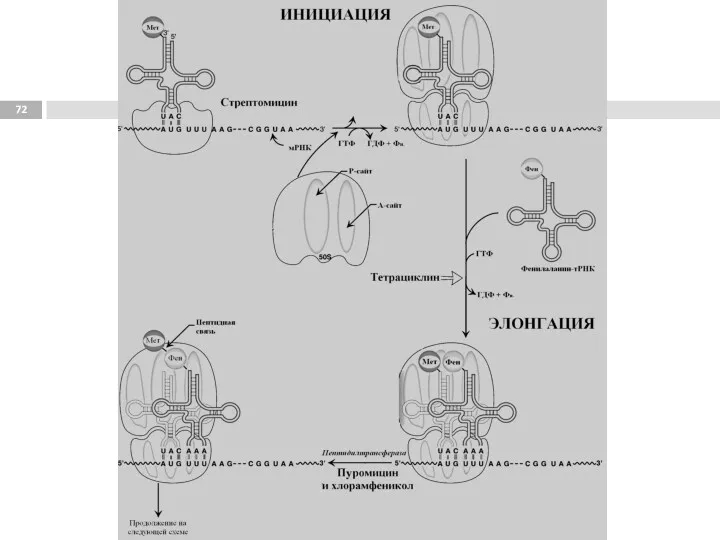
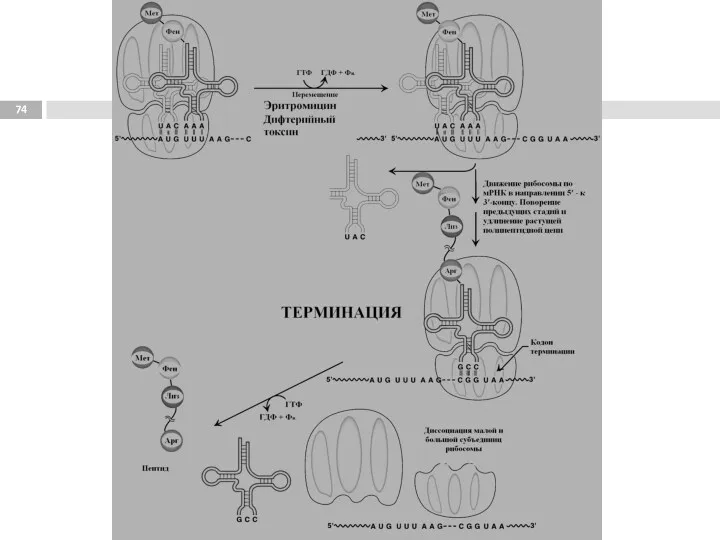
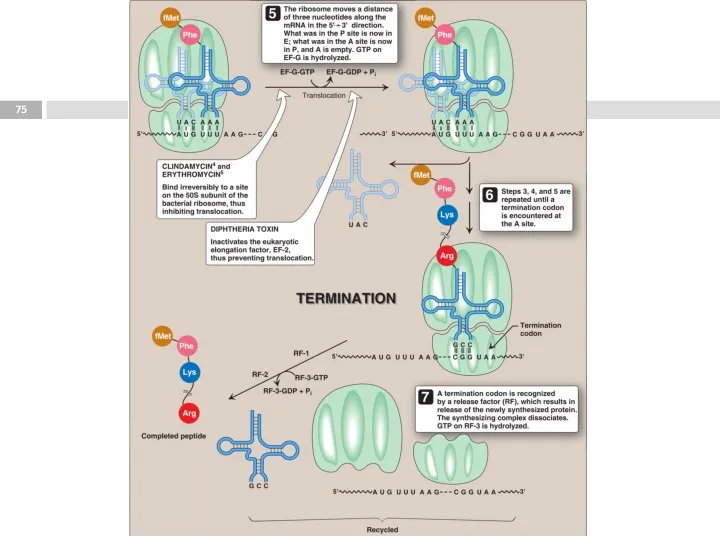
- 77. Этапы трансляции Инициация. 1. Узнавание стартового кодона (AUG), сопровождается присоединением тРНК с метионином (М), и сборкой
- 78. Полирибосома (полисома) Продолжительность жизни матричной РНК невелика, перед клеткой стоит задача использовать её максимально эффективно, т.е.
- 80. Фолдинг процесс спонтанного сворачивания полипептидной цепи в определенную пространственную структуру (третичную) белка. В результате фолдинга в
- 82. Посттрансляционная модификация белков Частичный протеолиз; Ковалентные модификации (N- и О-гликозилирование, О-сульфирование, фосфорилирование, дезаминирование, гидроксилирование, метилирование, иодирование,
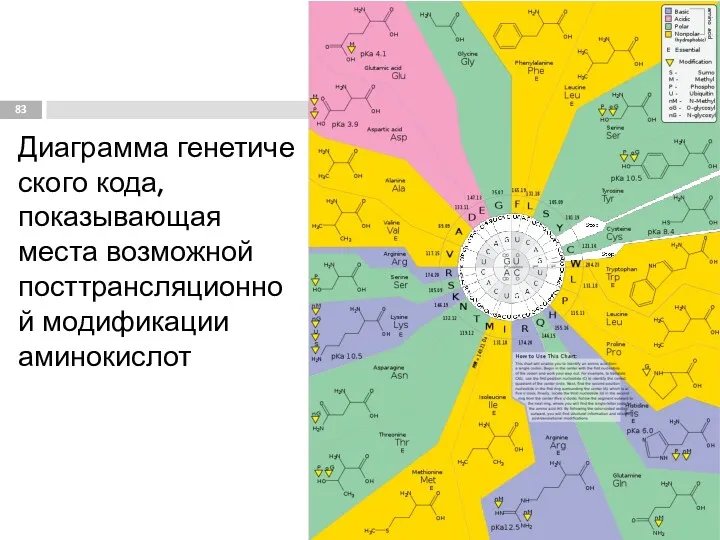
- 83. Диаграмма генетического кода, показывающая места возможной посттрансляционной модификации аминокислот
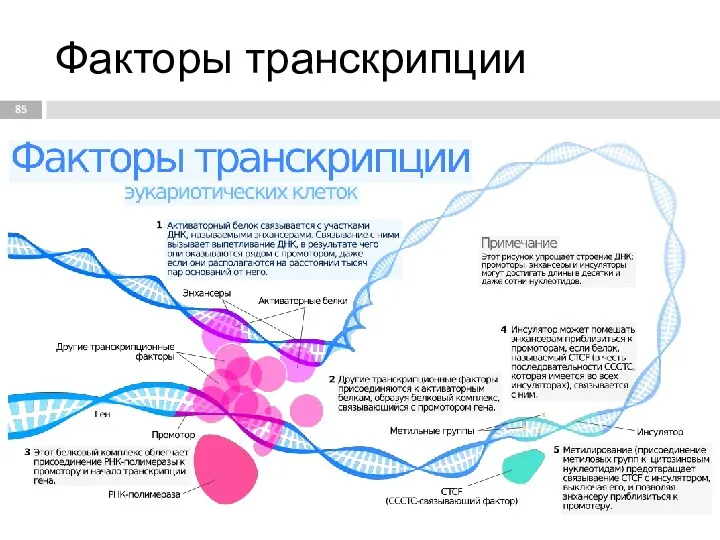
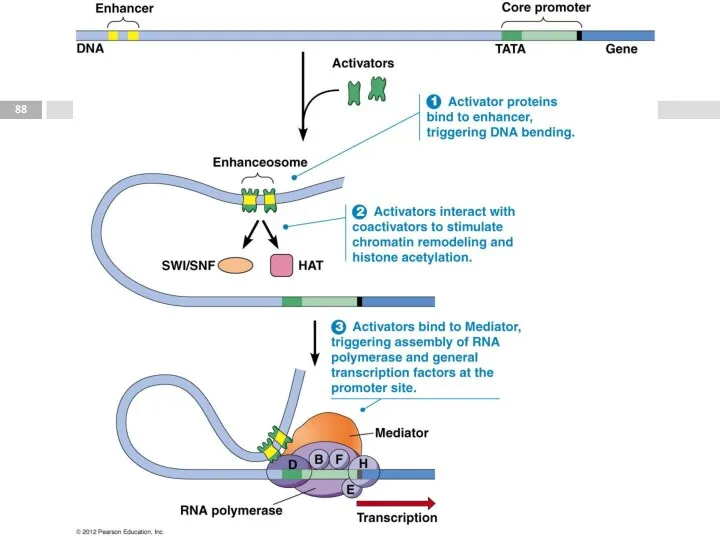
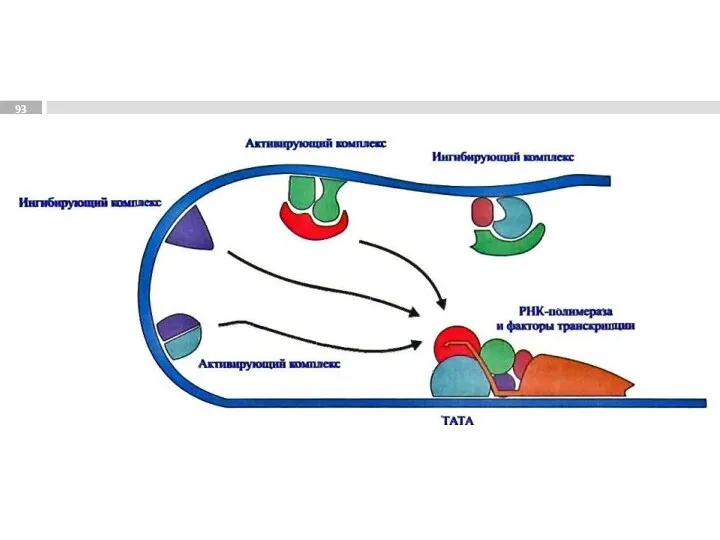
- 85. Факторы транскрипции
- 86. В каждом транскриптоне транскрибируется только одна из двух цепей ДНК, которая называется матричной, вторая, комплементарная ей
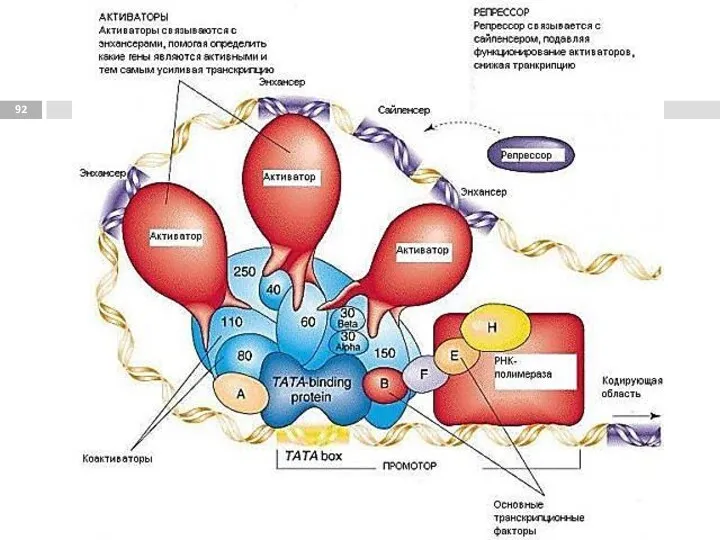
- 87. Энхансер (enhancer) [англ. enhancer - усилитель] регуляторная нуклеотидная последовательность, которая повышает (усиливает) экспрессию генов и может
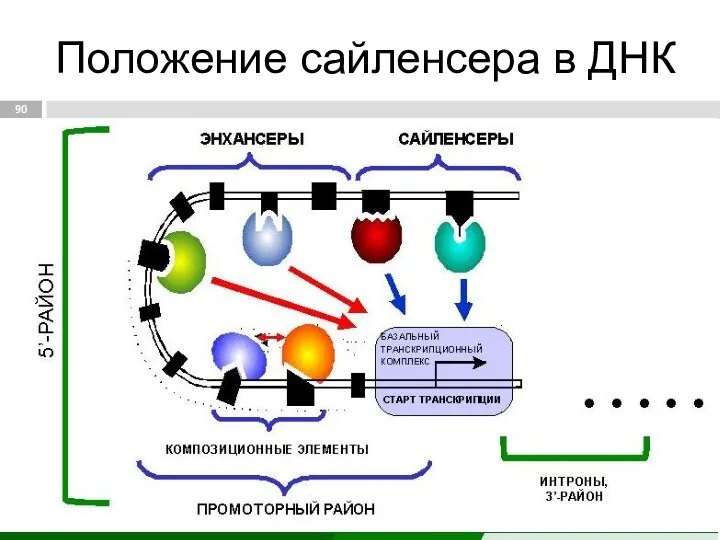
- 89. Сайленсер (silencer) [англ. silencer — глушитель, от лат. silentum - молчание] определенная нуклеотидная последовательность ДНК, являющаяся
- 90. Положение сайленсера в ДНК
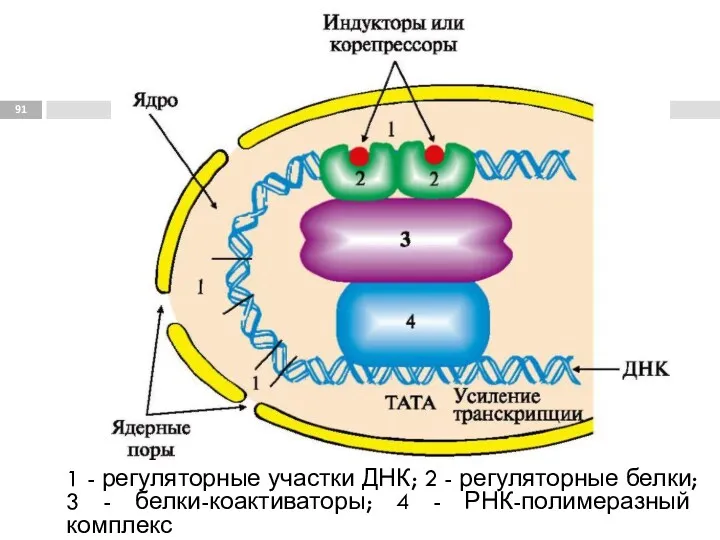
- 91. 1 - регуляторные участки ДНК; 2 - регуляторные белки; 3 - белки-коактиваторы; 4 - РНК-полимеразный комплекс
- 95. Скачать презентацию




































![Энхансер (enhancer) [англ. enhancer - усилитель] регуляторная нуклеотидная последовательность, которая](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/268315/slide-86.jpg)

 Растениеводство. Системы земледелия
Растениеводство. Системы земледелия Эндокринная система
Эндокринная система Положение человека в системе животного мира. Стадии антропогенеза
Положение человека в системе животного мира. Стадии антропогенеза Отряд Журавлеобразные
Отряд Журавлеобразные Выделение ДНК
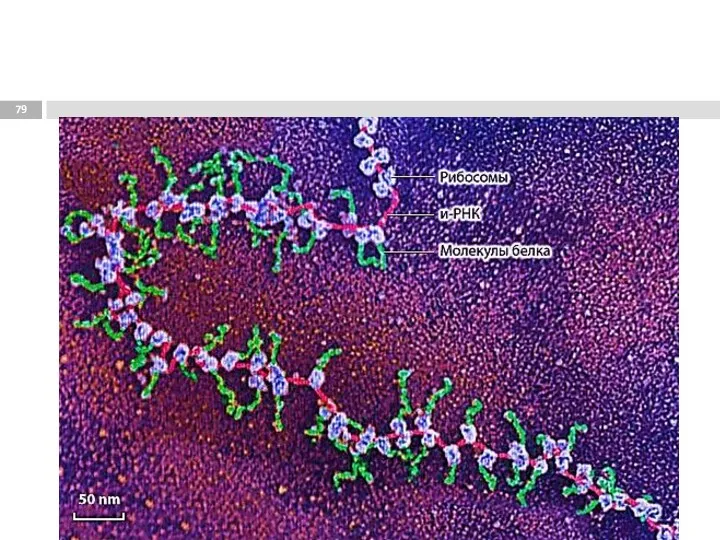
Выделение ДНК Ядовитые растения Крыма
Ядовитые растения Крыма Физиология высшей нервной деятельности. Этология и стадность
Физиология высшей нервной деятельности. Этология и стадность Слуховой анализатор. Гигиена слуха. 8 класс
Слуховой анализатор. Гигиена слуха. 8 класс Типи взаємовідносин між організмами
Типи взаємовідносин між організмами Конечные продукты азотистого обмена. Биосинтез мочевины
Конечные продукты азотистого обмена. Биосинтез мочевины Статеві гормони. Гормони наднирників. Гормони щитовидної залози, гормони нейрогипофиза
Статеві гормони. Гормони наднирників. Гормони щитовидної залози, гормони нейрогипофиза 20181126_razvitie_nasekomyh
20181126_razvitie_nasekomyh Последствия близкородственных браков
Последствия близкородственных браков Келесі өзгерістерді катализдейтін ферменттер қай класс мен подкласка жатады а) Лактат + НАД+ ↔ пируват + НАДН +Н+
Келесі өзгерістерді катализдейтін ферменттер қай класс мен подкласка жатады а) Лактат + НАД+ ↔ пируват + НАДН +Н+ Общее учение о внутренностях
Общее учение о внутренностях Биохимия соединительной ткани
Биохимия соединительной ткани Железы. Гистофизиология секреторного процесса. Типы секреции
Железы. Гистофизиология секреторного процесса. Типы секреции Кровеносная система
Кровеносная система Тип Плоские черви (Plathelminthes)
Тип Плоские черви (Plathelminthes) Витамины. 9 класс
Витамины. 9 класс Карты генов наследственных заболеваний
Карты генов наследственных заболеваний Нуклеиновые кислоты
Нуклеиновые кислоты Показатели загрязненности почв и экологического неблагополучия агроэкосистемы
Показатели загрязненности почв и экологического неблагополучия агроэкосистемы Эволюционное учение (урок обобщающего повторения для 10 класса)
Эволюционное учение (урок обобщающего повторения для 10 класса) Самые необычные кошки планеты
Самые необычные кошки планеты Мышцы. Типы мышц, их строение и значение
Мышцы. Типы мышц, их строение и значение Зоопарк
Зоопарк Органи і системи органів тварин
Органи і системи органів тварин