Содержание
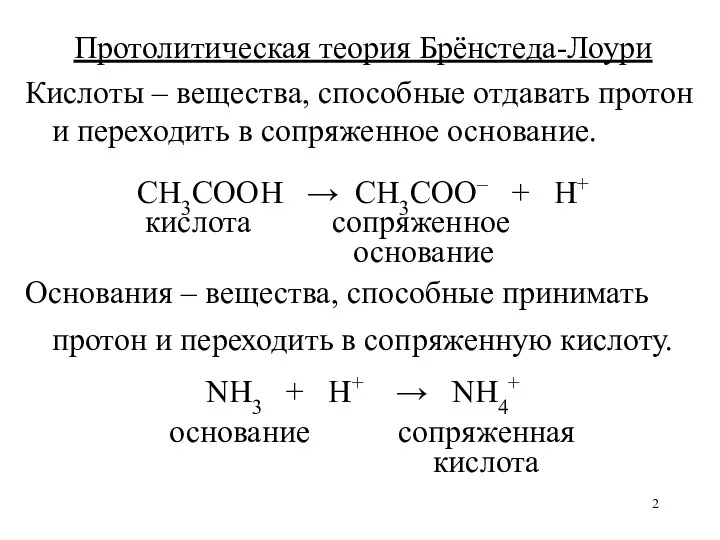
- 2. Протолитическая теория Брёнстеда-Лоури Кислоты – вещества, способные отдавать протон и переходить в сопряженное основание. CH3COOH →
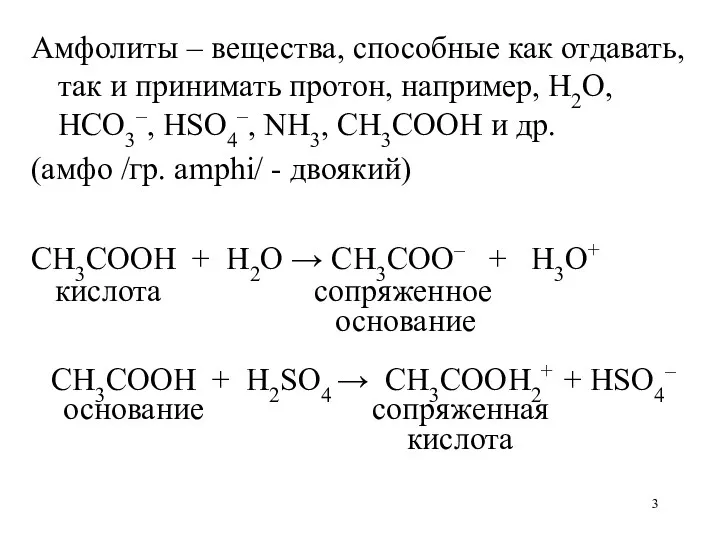
- 3. Амфолиты – вещества, способные как отдавать, так и принимать протон, например, H2O, HCO3–, HSO4–, NH3, CH3COOH
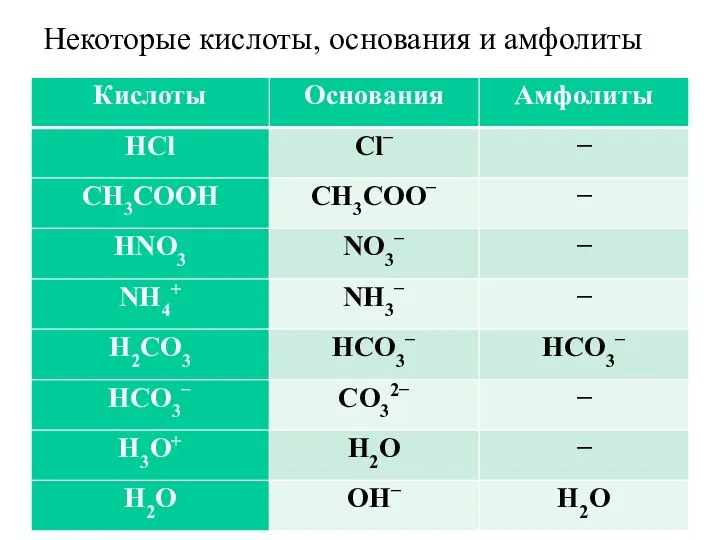
- 4. Некоторые кислоты, основания и амфолиты
- 5. Все вещества могут проявить свои кислотно-основные свойства лишь в протолитической реакции: HA + B → BH+
- 6. Автопротолиз. Константа автопротолиза
- 7. Большинство растворителей являются амфолитами. Реакция, в которой одна молекула растворителя проявляет свой ства кислоты, а другая
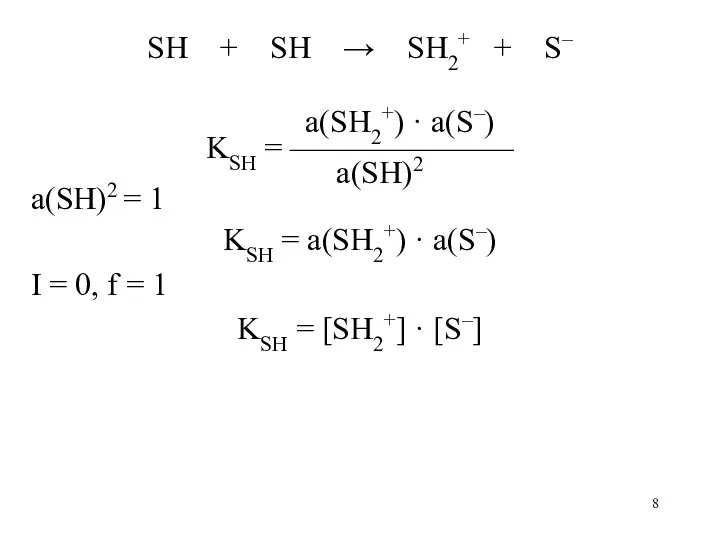
- 8. SH + SH → SH2+ + S– a(SH2+) · a(S–) KSH = ——————— a(SH)2 a(SH)2 =
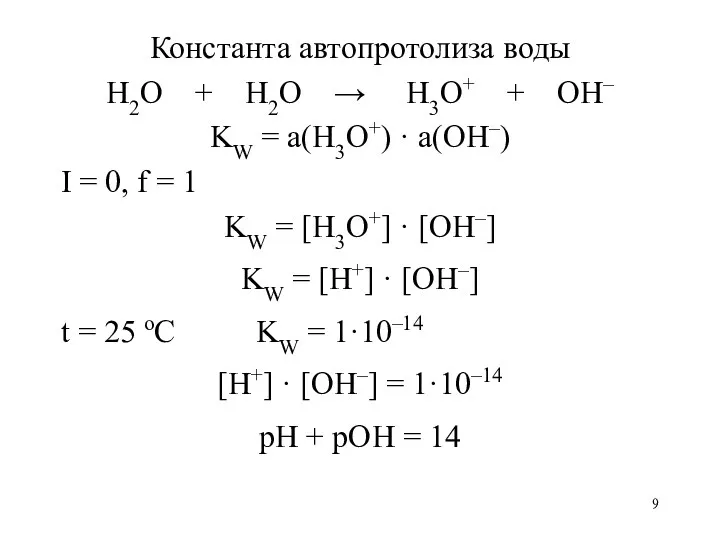
- 9. Константа автопротолиза воды H2O + H2O → H3O+ + OH– KW = a(H3O+) · a(OH–) I
- 10. Сила кислот и оснований Способность кислоты отдавать протон, а основания принимать его (т.е. силу кислот и
- 11. Реакция взаимодействия слабой кислоты с растворителем: HA + SH → SH2+ + A– [SH2+] · [A–]
- 12. Реакция взаимодействия слабого основания с растворителем: B + SH → BH+ + S– [BH +] ·
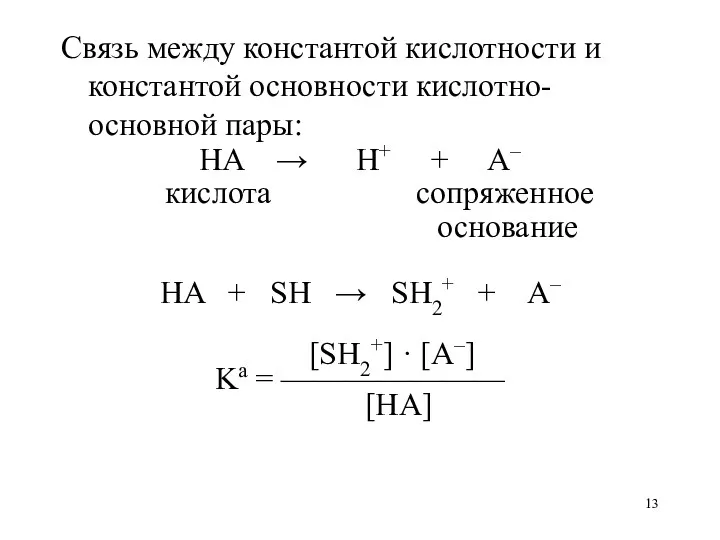
- 13. Связь между константой кислотности и константой основности кислотно-основной пары: HA → H+ + A– кислота сопряженное
- 14. A– + SH → HA + S– [HA] · [S–] Kb = ——————— [A–] [SH2+] ·
- 15. Произведение константы кислотности кислоты на константу основности сопряженного с кислотой основания для данной кислотно-основной пары, при
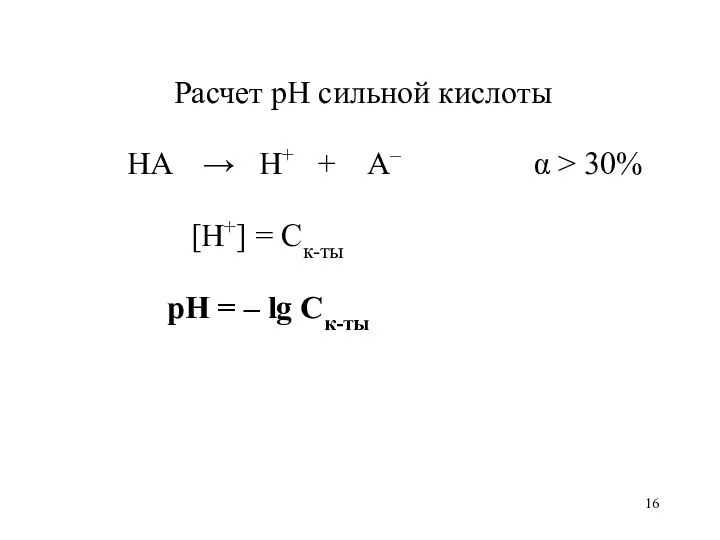
- 16. Расчет рН сильной кислоты HA → H+ + A– α > 30% [H+] = Cк-ты рН
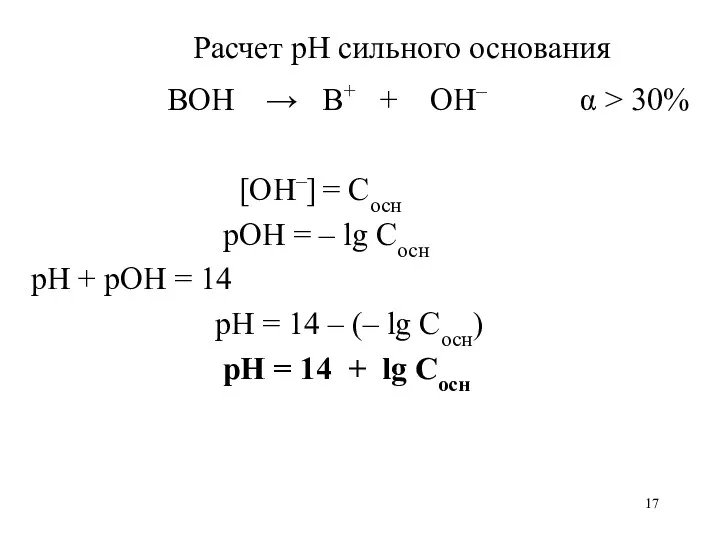
- 17. Расчет рН сильного основания BOH → B+ + OH– α > 30% [OH–] = Cосн рОН
- 18. Расчет рН слабой кислоты HA → H+ + A– α [H +] · [A–] Kк-ты =
- 19. [H +]2 Kк-ты = ——— Cк-ты pH = ½ pKк-ты – ½ lg Cк-ты
- 20. Расчет рН слабого основания BOH → B+ + OH– α [B +] · [OH–] Kосн =
- 21. [OH–]2 Kосн = ——— Cосн pOH = ½ pKосн – ½ lg Cосн pH + pOH
- 22. Связь между константой диссоциации и степенью диссоциации слабой кислоты HA → H+ + A– α [H
- 23. [H +] · [A–] (α ⋅ Cк-ты)2 Kк-ты = ————— = —————— [HA] Cк-ты (1 –
- 24. Расчет рН многоосновных кислот H2A → H+ + HA– [H +] · [HA–] K1 к-ты =
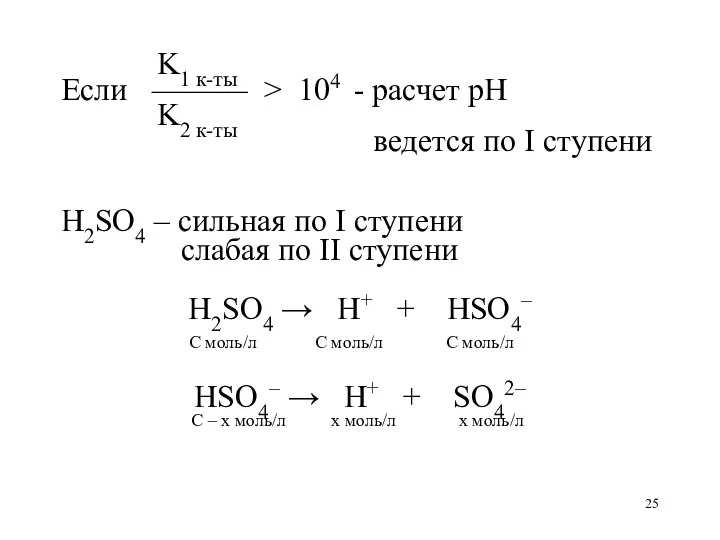
- 25. K1 к-ты Если ——— > 104 - расчет рН K2 к-ты ведется по I ступени H2SO4
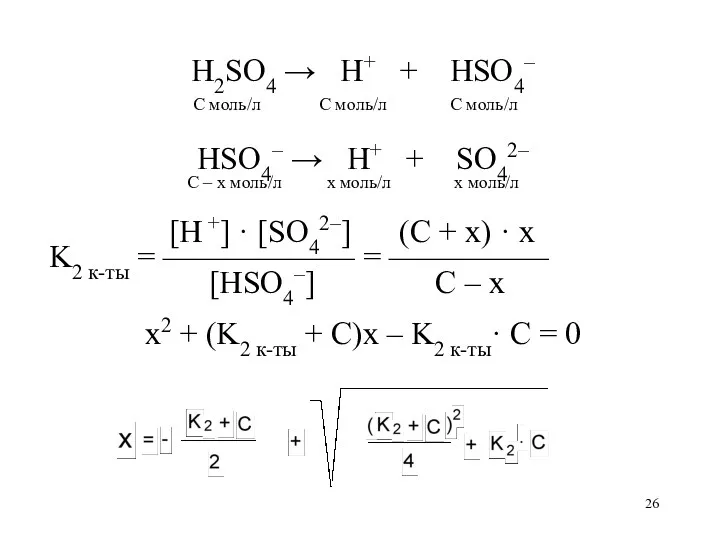
- 26. H2SO4 → H+ + HSO4– C моль/л C моль/л C моль/л HSO4– → H+ + SO42–
- 27. Вычислить рН 0,01 М раствора азотной кислоты. Решение. Определяем, сильная или слабая кислота сильное или слабое
- 28. В 300 мл раствора растворили 0,12 г NaOH. Вычислите рН раствора. Решение. 0,12 С(NaOH) = ———
- 29. Вычислить рН 0,5% раствора бензойной кислоты. pH = ½ pKк-ты – ½ lg Cк-ты pKк-ты =
- 30. Рассчитайте концентрацию ацетат-иона в 0,02 М растворе уксусной кислоты. Решение. Кк-ты = 1,74·10–5
- 31. Рассчитайте степень диссоциации муравьиной кислоты в 1% растворе. Решение. Кк-ты = 1,8·10–4 1,0 · 1 ·
- 32. рН 0,5 М раствора гидразина равна 10,89. Вычислите константу диссоциации гидразина. Решение. рOH = 14 –
- 33. При какой концентрации бензойная кислота ионизирована на 3%? Решение. 3% или 0,03; Кк-ты = 6,3·10–5 α2
- 34. Миндальная кислота в 1,5% растворе ионизирована на 6,5%. Вычислите константу диссоциации миндальной кислоты. Решение. 1,5% =
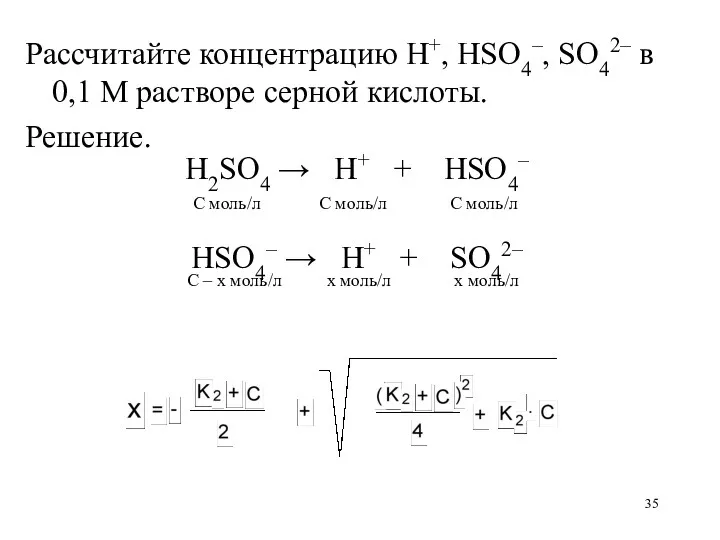
- 35. Рассчитайте концентрацию H+, HSO4–, SO42– в 0,1 М растворе серной кислоты. Решение. H2SO4 → H+ +
- 36. K2 к-ты= 1,2·10–2 [SO42– ] = x = 0,009 M [H+] = 0,1 + x =
- 38. Скачать презентацию






![A– + SH → HA + S– [HA] · [S–]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/409766/slide-13.jpg)


![[H +]2 Kк-ты = ——— Cк-ты pH = ½ pKк-ты – ½ lg Cк-ты](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/409766/slide-18.jpg)

![[OH–]2 Kосн = ——— Cосн pOH = ½ pKосн –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/409766/slide-20.jpg)

![[H +] · [A–] (α ⋅ Cк-ты)2 Kк-ты = —————](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/409766/slide-22.jpg)









![K2 к-ты= 1,2·10–2 [SO42– ] = x = 0,009 M](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/409766/slide-35.jpg)
 Кристалогідрати. Номенклатура, найважливіші кристалогідрати та їх застосування
Кристалогідрати. Номенклатура, найважливіші кристалогідрати та їх застосування Нұсқа талдау
Нұсқа талдау Химические реакции. Реакции обмена
Химические реакции. Реакции обмена osobennosti_i_klassifikatsiya_khimicheskikh_reaktsiy_v_organicheskoy_khimii
osobennosti_i_klassifikatsiya_khimicheskikh_reaktsiy_v_organicheskoy_khimii Қайтымды реакция. Химиялық тепе-теңдік
Қайтымды реакция. Химиялық тепе-теңдік Organic chemistry. Alcohols
Organic chemistry. Alcohols Общая характеристика халькогенов. Кислород
Общая характеристика халькогенов. Кислород Calcium and magnesium. Formation of calcareous.water hardness
Calcium and magnesium. Formation of calcareous.water hardness Химические реакции. Реакции разложения
Химические реакции. Реакции разложения Общая характеристика металлов. Металлическая связь
Общая характеристика металлов. Металлическая связь Хімічна кінетика
Хімічна кінетика Алкины. Ацетиленовые углеводороды
Алкины. Ацетиленовые углеводороды Тұздар гидролизі
Тұздар гидролизі Липиды. Структурные компоненты липидов
Липиды. Структурные компоненты липидов Стандартный электродный потенциал
Стандартный электродный потенциал Якісні реакції на деякі йони
Якісні реакції на деякі йони Соли Mg SO4 – сульфат магния
Соли Mg SO4 – сульфат магния Кислотно-основное титрование в неводных средах
Кислотно-основное титрование в неводных средах Природный и попутный нефтяной газ
Природный и попутный нефтяной газ Тепловой эффект химических реакций
Тепловой эффект химических реакций Синтетические моющие средства
Синтетические моющие средства Природные источники углеводородов
Природные источники углеводородов Йод. Йодтың ашылуы
Йод. Йодтың ашылуы 6-я группа элементов. 9 класс
6-я группа элементов. 9 класс Арены. Бензол и его гомологи
Арены. Бензол и его гомологи Water
Water Current Condition(Revision C)
Current Condition(Revision C)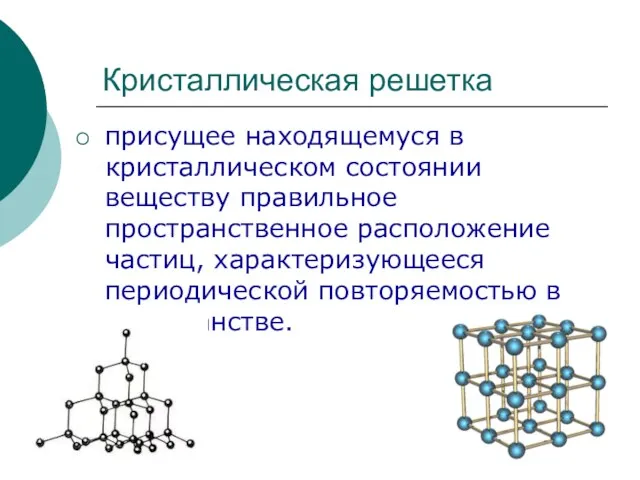 Кристаллическая решетка
Кристаллическая решетка