Содержание
- 2. Физические свойства различных металлов делает их полезными для различных целей Например, Алюминий ………………………………………………………………………………………………………………. Золото …………………………………………………………………………………………………………………….. Медь………………………………………………………………………………………………………………………..
- 3. Металлам присущи свойства, которых нет у неметаллов! К А К И Е ?
- 4. Ме блеск, ковкость, пластичность, теплопроводность, электропроводность, а также высокие температуры плавления и кипения, твердость, плотность.
- 5. Metallic bonding металлическая связь Частицы в металле удерживаются вместе с помощью сильных металлических связей. Чтобы отделить
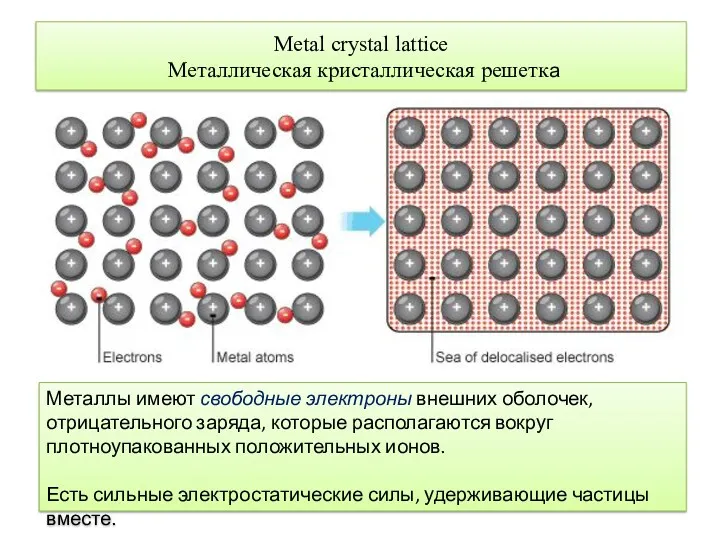
- 6. Мetal crystal lattice Металлическая кристаллическая решетка Металлы имеют свободные электроны внешних оболочек, отрицательного заряда, которые располагаются
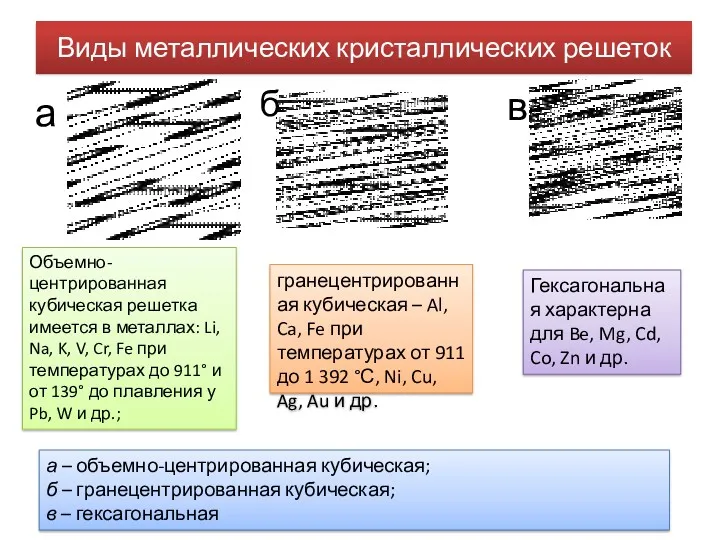
- 7. Виды металлических кристаллических решеток а – объемно-центрированная кубическая; б – гранецентрированная кубическая; в – гексагональная а
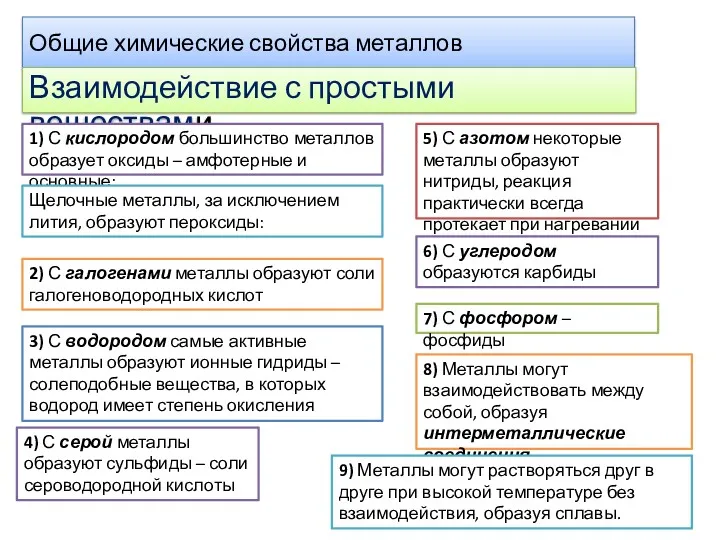
- 8. Общие химические свойства металлов Взаимодействие с простыми веществами 1) С кислородом большинство металлов образует оксиды –
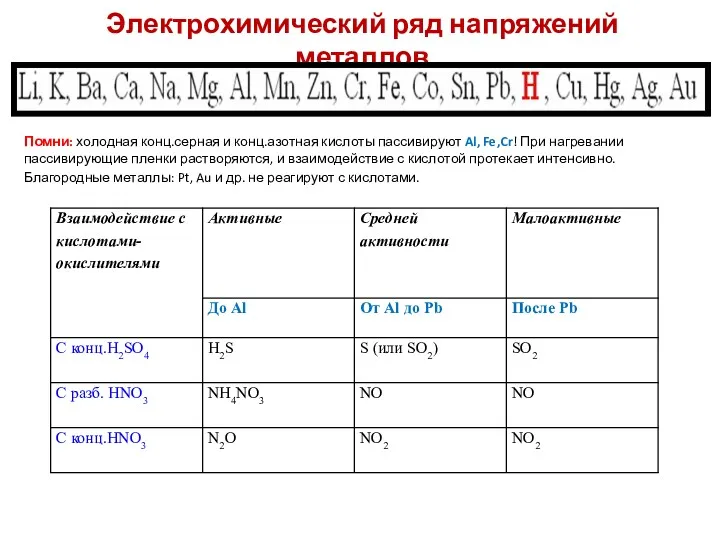
- 10. Металлы, стоящие в ряду активности до водорода восстанавливают кислоты-неокислители до водорода! Взаимодействие металлов с кислотами
- 11. Взаимодействие металлов с кислотами-неокислителями
- 12. Взаимодействие металлов с кислотами окислителями При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами
- 13. Электрохимический ряд напряжений металлов Помни: холодная конц.серная и конц.азотная кислоты пассивируют Al, Fe,Cr! При нагревании пассивирующие
- 14. Вытеснение более активными металлами менее активных металлов из растворов их солей. Приведите два примера уравнений реакций.
- 16. Скачать презентацию









 Массовая доля вещества в растворе
Массовая доля вещества в растворе Состав, строение и свойства натурального каучука
Состав, строение и свойства натурального каучука Study of the properties of halogens and the determination of halide ions in aqueous solution
Study of the properties of halogens and the determination of halide ions in aqueous solution Установка производства серы по методу Клауса
Установка производства серы по методу Клауса Кислород O2
Кислород O2 Литий. Физические и химические свойства. Получение и применение
Литий. Физические и химические свойства. Получение и применение Массообменные процессы
Массообменные процессы Введение в минералогию. Генезис минералов
Введение в минералогию. Генезис минералов Фізичні та хімічні явища (гра)
Фізичні та хімічні явища (гра) Классификация химических реакций в органической химии
Классификация химических реакций в органической химии Кремнекислые породы группа гранитов-риолитов гранодиоритов-дацитов. Интрузивные породы
Кремнекислые породы группа гранитов-риолитов гранодиоритов-дацитов. Интрузивные породы Пурин нуклеозидтері (аденозии 3-фосфор қышқылы, рибоксии). Сапасына Қойылантын талаптар, талдау әдістері
Пурин нуклеозидтері (аденозии 3-фосфор қышқылы, рибоксии). Сапасына Қойылантын талаптар, талдау әдістері История открытия кислорода
История открытия кислорода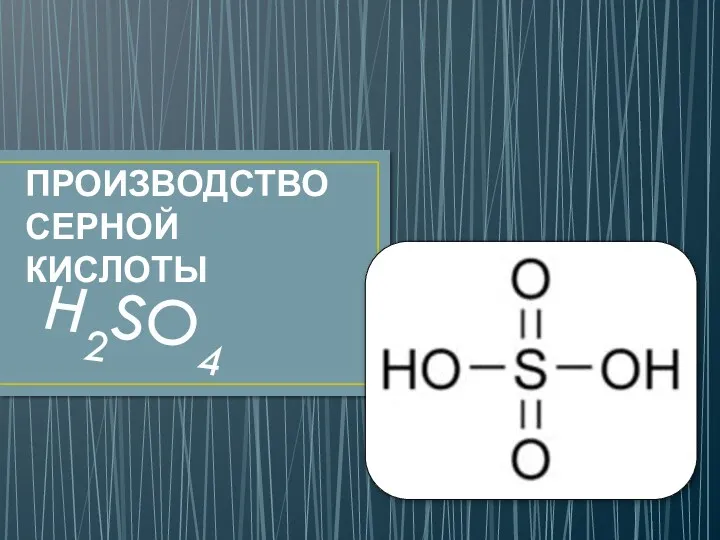 Производство серной кислоты
Производство серной кислоты Основания. (8 класс)
Основания. (8 класс) Хлорид натрия
Хлорид натрия Нефть и нефтепродукты. Происхождение. Состав. Свойства. Переработка
Нефть и нефтепродукты. Происхождение. Состав. Свойства. Переработка История становления органической химии
История становления органической химии Физические явления в химии. Чистые вещества и смеси
Физические явления в химии. Чистые вещества и смеси Строение атома
Строение атома Металловедение. Классификация металлов
Металловедение. Классификация металлов Основные постулаты квантовой механики
Основные постулаты квантовой механики Изохинолин туындыларының дәрілік заттарын талдау
Изохинолин туындыларының дәрілік заттарын талдау Кислоты. Химические свойства кислот
Кислоты. Химические свойства кислот Первоначальные представления об органических веществах. Органическая химия
Первоначальные представления об органических веществах. Органическая химия Изучение физико-химических свойств мицеллярных растворов индивидуальных ПАВ, композиций различных ПАВ
Изучение физико-химических свойств мицеллярных растворов индивидуальных ПАВ, композиций различных ПАВ Природные источники углеводородов
Природные источники углеводородов Відносна густина газів
Відносна густина газів