Содержание
- 2. Особенности реакций с участием органических веществ 1. Органические вещества имеют молекулярное строение, поэтому реакции с их
- 3. Особенности реакций с участием органических веществ 3. Для записи реакций органических веществ используют схемы, где а)
- 4. Классификация реакций в органической химии I. Реакции замещения (S)- в молекуле субстрата один атом или группа
- 5. Субстрат – основное вещество ( от лат. Sybstratum- основа), вступающее в химическую реакцию. Это более сложное
- 6. II. Реакции присоединения (А) от англ. addition – присоединение В зависимости от того, какие изменения происходят
- 7. II. Реакции присоединения (А) от англ. addition - присоединение 4. Гидратация (присоединение воды): СН2 =СН2 +
- 8. III. Реакции элиминирования (отщепления) – Е (от англ. eleminate- удалять) 1. Дегидрирование (отщепление водорода) на никелевом
- 9. IV. Реакции изомеризации Под влиянием катализаторов при нагревании углеводороды нормального строения подвергаются изомеризации - перестройке углеродного
- 10. V. Реакции разложения (сокращения углеродной цепи) 1. Крекинг (от англ. to crack – «колоть, расщеплять») При
- 11. VI. Ароматизация (риформинг) (англ. reforming, от reform — переделывать, улучшать) -промышленный процесс переработки бензиновых и лигроиновых
- 12. VII. Реакции oкисления 1. Полное окисление (реакция горения): СН4+ 2О2 → СО2+ 2Н2О 2. Каталитическое окисление:
- 13. VIII. Наращивания углеродной цепи Реакция Вюрца: 03.02.2015 21:20 Кокорина С.Е., МБОУ СОШ №10 г.Североморск, Мурманская область
- 14. По механизму протекания : 1. Свободно-радикальные ® (протекают под действием и при участии радикалов при сильном
- 15. ГОМОЛИЗ -способ разрыва ковалентной связи, в результате которого каждый из атомов, участвующих в ее образовании, сохраняет
- 16. 3. Электрофильные (Е)-(протекают под действием и при участии электрофилов). Электрофилы – катионы или молекулы, имеющие атом
- 18. Скачать презентацию















 Поняття про родини хімічних елементів: лужні метали, галогени, інертні елементи. Урок хімії у 8 класі
Поняття про родини хімічних елементів: лужні метали, галогени, інертні елементи. Урок хімії у 8 класі Коллигативные свойства растворов
Коллигативные свойства растворов Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність Свойства природного газа
Свойства природного газа Стали и чугуны. Классификация и маркировка
Стали и чугуны. Классификация и маркировка Химические реакции в растворах электролитов. Обобщение и систематизация знаний
Химические реакции в растворах электролитов. Обобщение и систематизация знаний Щелочные и щелочноземельные металлы
Щелочные и щелочноземельные металлы Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Сложные эфиры
Сложные эфиры Пластмаси. Види пластмас. (11 клас)
Пластмаси. Види пластмас. (11 клас) Волшебница - вода
Волшебница - вода Строение атома и атомного ядра. Изотопы
Строение атома и атомного ядра. Изотопы Твердые смазки
Твердые смазки Маркировка пластиковой посуды
Маркировка пластиковой посуды Термодинамика растворов неэлектролитов
Термодинамика растворов неэлектролитов Модифицированные природные полимеры. Их свойства
Модифицированные природные полимеры. Их свойства Законы химии. Классы неорганических соединений
Законы химии. Классы неорганических соединений Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа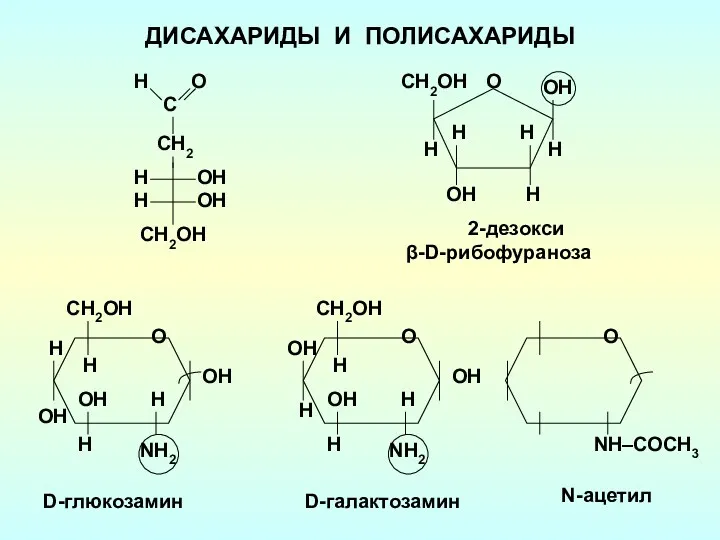 Дисахариды и полисахариды
Дисахариды и полисахариды Щелочноземельные металлы
Щелочноземельные металлы Теплота горения
Теплота горения Процессы нитрозирования и основные реакции диазосоединений
Процессы нитрозирования и основные реакции диазосоединений Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие
Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие Окислительно- восстановительные реакции
Окислительно- восстановительные реакции Чистые вещества и смеси
Чистые вещества и смеси Прикладная геохимия. Первичные ореолы
Прикладная геохимия. Первичные ореолы Почему протекают химические реакции
Почему протекают химические реакции Электрохимия. Окислительно-восстановительные реакции
Электрохимия. Окислительно-восстановительные реакции