Содержание
- 2. План урока. Закон сохранения массы и энергии. Тепловой эффект химической реакции. Экзотермические и эндотермические реакции. Термохимия.
- 3. Почему протекают химические реакции Закон сохранения массы и энергии. Масса веществ, вступающих в реакцию равна массе
- 4. Закон сохранения массы и энергии Взаимосвязь массы и энергии выражается уравнением Эйнштейна: E = mc2 где
- 5. Тепловые эффекты химических реакций нужны для многих технических расчетов. Представьте себя на минуту конструктором мощной ракеты,
- 6. Тепловые эффекты химических реакций. Химическая реакция заключается в разрыве одних и образовании других связей, поэтому она
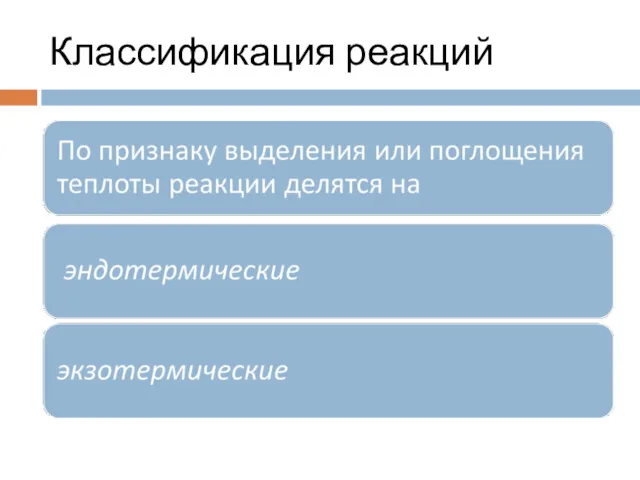
- 7. Классификация реакций
- 8. Реакции, протекающие с выделением теплоты, проявляют положительный тепловой эффект (Q>0, ΔH С(тв) + 2 H2(г) =
- 9. Тепловой эффект химической реакции Количество теплоты, которое выделяется или поглощается в результате реакций между определенными количествами
- 10. Теплота образования соединения (Qобр) Это тепловой эффект реакции образования одного моля соединения из простых веществ, устойчивых
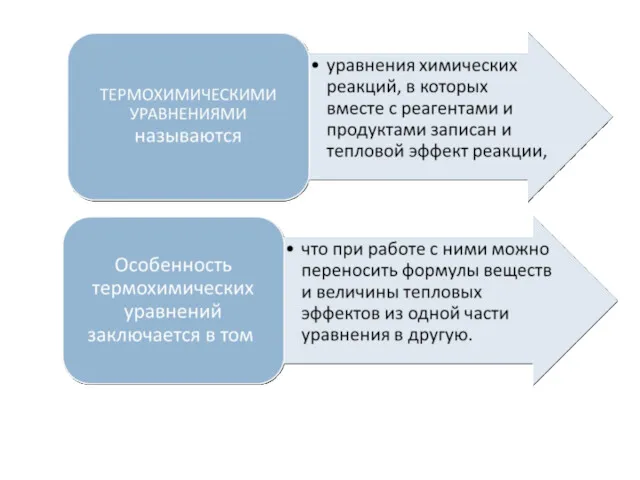
- 12. Раздел химии, занимающийся изучением превращения энергии в химических реакциях, называется ТЕРМОХИМИЕЙ. Существует два важнейших закона термохимии.
- 13. закон Лавуазье–Лапласа Тепловой эффект прямой реакции всегда равен тепловому эффекту обратной реакции с противоположным знаком.
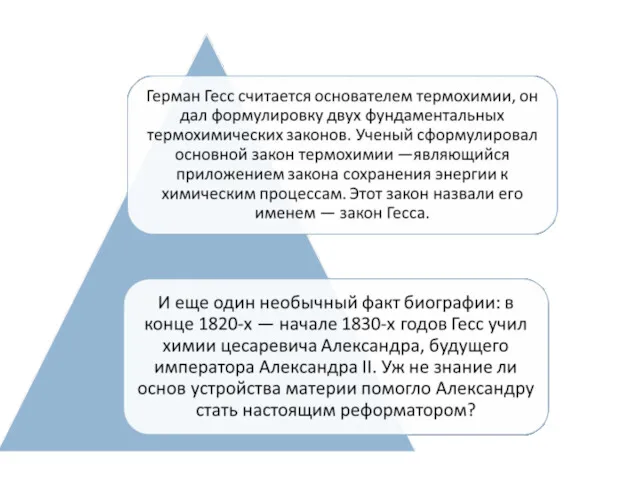
- 14. Второй закон термохимии был сформулирован в 1840 г российским академиком Г. И. Гессом: Тепловой эффект реакции
- 15. Сульфат натрия Na2SO4 можно получить двумя путями из едкого натра NaOH. Первый путь (одностадийный): 2 NaOH
- 17. Энтальпия это определенное свойство вещества, оно является мерой энергии, накапливаемой веществом при его образовании. Величина, характеризующая
- 18. Энтальпия и тепловой эффект противоположны по знаку При экзотермических реакциях, когда тепло выделяется, Δ Н отрицательно.
- 19. Как вычислить тепловой эффект реакции Тепловой эффект химической реакции равен разности суммы теплот образования продуктов реакции
- 20. энтропия S Термодинамическая энтропия S, часто просто именуемая энтропия, в химии и термодинамике является функцией состояния
- 21. энтропия Функция характеризующая степень беспорядка Δ S Чем больше частиц в системе, тем больше в системе
- 22. Выводы Всякая химическая реакция характеризуется двумя энергетическими характеристиками: энтальпией (Δ H) и энтропией (Δ S). Для
- 23. Задача При соединении 18 г алюминия с кислородом выделяется 547 кДж теплоты. Составьте термохимическое уравнение этой
- 24. Задача 5 При соединении 18 г алюминия с кислородом выделяется 547 кДж теплоты. Составьте термохимическое уравнение
- 25. Решение задач 1,2,4 после параграфа 12
- 26. Домашнее задание Изучить материал учебника параграф 12, выполнить задания № 5-8;
- 27. В результате реакции, термохимическое уравнение которой 2H2(г) + O2(г) = 2H2O(г) + 484 кДж, выделилось 1479
- 29. Скачать презентацию























 Водород. Растворы. 8 класс
Водород. Растворы. 8 класс Алмазы. Бриллианты
Алмазы. Бриллианты Nuclear Energy, Controlled Fission and Fusion 2016
Nuclear Energy, Controlled Fission and Fusion 2016 Состояние электронов в атоме
Состояние электронов в атоме Основания, их классификация и свойства
Основания, их классификация и свойства Полиэтилен — [—CH2--CH2—]n ақ түсті термопластикалық полимер
Полиэтилен — [—CH2--CH2—]n ақ түсті термопластикалық полимер Centrifugal Ultrafiltration Devices
Centrifugal Ultrafiltration Devices Антибиотики как ЛС
Антибиотики как ЛС Электронный помощник по химии (8 класс)
Электронный помощник по химии (8 класс) Галогены. Физические свойства галогенов
Галогены. Физические свойства галогенов Химические уравнения. Закон сохранения массы веществ
Химические уравнения. Закон сохранения массы веществ Сера — представитель VIA-группы. Аллотропия серы. Свойства и применение
Сера — представитель VIA-группы. Аллотропия серы. Свойства и применение Теория резонанса в неорганической химии
Теория резонанса в неорганической химии Ионное произведение воды. Водородный показатель воды
Ионное произведение воды. Водородный показатель воды Ионные уравнения реакций
Ионные уравнения реакций Алюминий IIIА топ элементі
Алюминий IIIА топ элементі Диффузия вокруг нас
Диффузия вокруг нас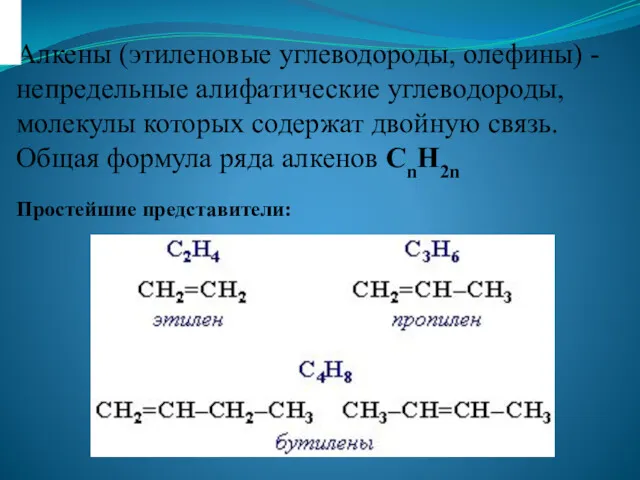 Алкены (этиленовые углеводороды, олефины)
Алкены (этиленовые углеводороды, олефины) Синтетические моющие средства
Синтетические моющие средства Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною
Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною История мыловарения
История мыловарения Геохимия окружающей среды и здоровье человека
Геохимия окружающей среды и здоровье человека Поверхностно-активные вещества (ПАВ). Классификация ПАВ по степени влияния на окружающую среду
Поверхностно-активные вещества (ПАВ). Классификация ПАВ по степени влияния на окружающую среду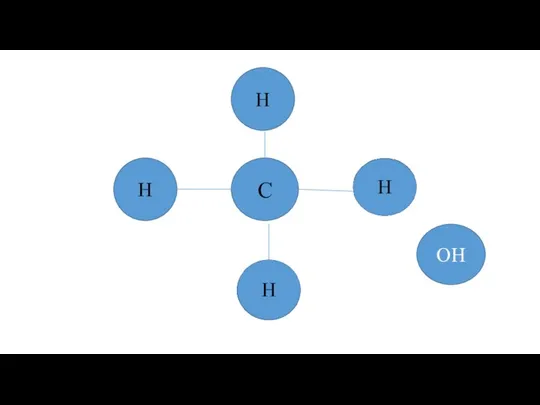 Предельные одноатомные спирты
Предельные одноатомные спирты Горение топлива
Горение топлива Кто хочет стать отличником по химии. Игра
Кто хочет стать отличником по химии. Игра Тренинг. Практическая химия (8-9 классы)
Тренинг. Практическая химия (8-9 классы) Коллоидная химия
Коллоидная химия