Содержание
- 2. Это электролиты, которые диссоциируют с образованием катионов металла и гидроксид-анионов. Me+n(OH)n → Me+n + nOH- Физические
- 3. Классификация оснований:
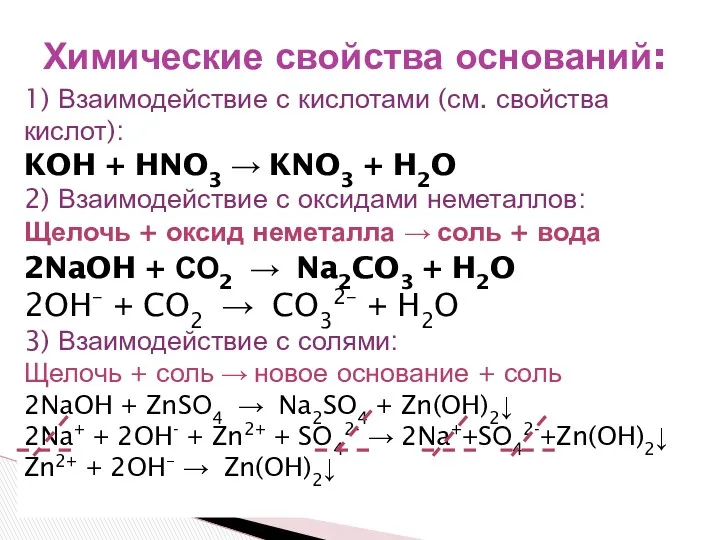
- 4. 1) Взаимодействие с кислотами (см. свойства кислот): KOH + HNO3 → KNO3 + H2O 2) Взаимодействие
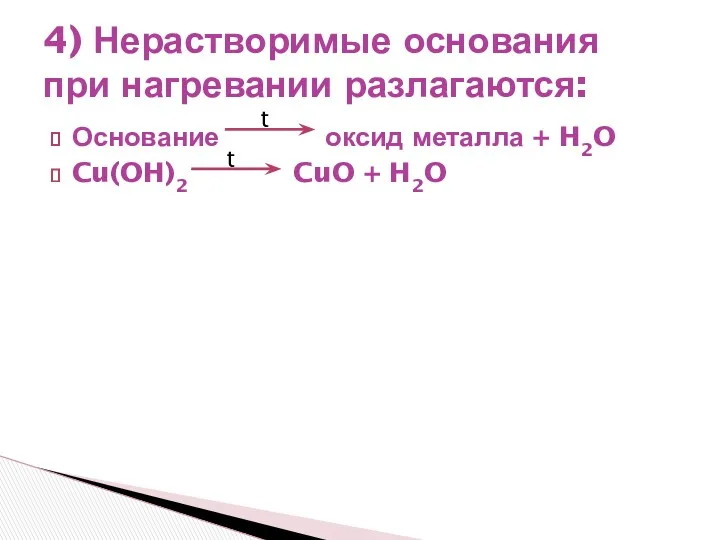
- 5. Основание оксид металла + H2O Cu(OH)2 CuO + H2O 4) Нерастворимые основания при нагревании разлагаются: t
- 6. Оксиды, их классификация и свойства.
- 7. По химическим свойствам: Классификация оксидов: Несолеобразующие оксиды – оксиды, которые не взаимодействуют ни с кислотами, ни
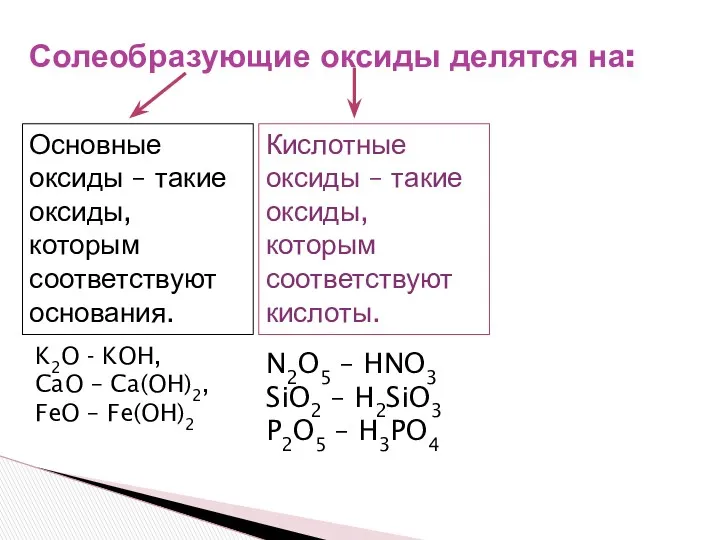
- 8. Солеобразующие оксиды делятся на: Основные оксиды – такие оксиды, которым соответствуют основания. K2O - KOH, CaO
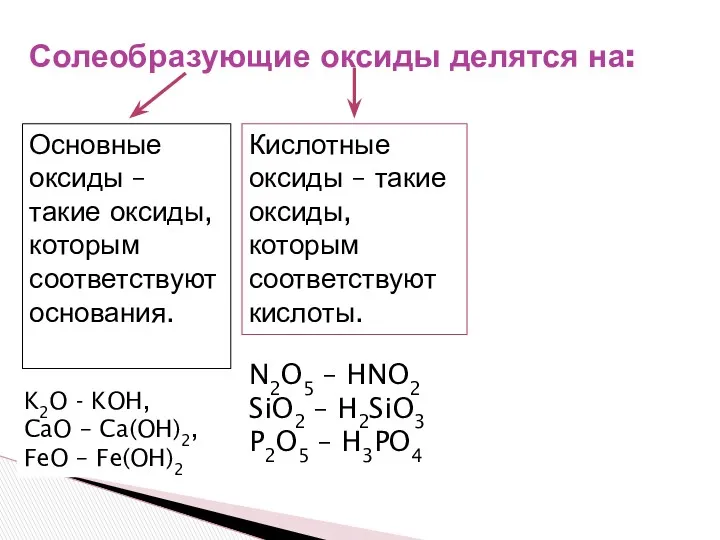
- 9. Солеобразующие оксиды делятся на: Основные оксиды – такие оксиды, которым соответствуют основания. K2O - KOH, CaO
- 10. Солеобразующие оксиды делятся на: Основные оксиды – такие оксиды, которым соответствуют основания. K2O - KOH, CaO
- 12. Скачать презентацию





 Водород. Нахождение в природе. Физические и химические свойства. Применение
Водород. Нахождение в природе. Физические и химические свойства. Применение Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів
Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів Кам’яне вугілля, продукти його переробки
Кам’яне вугілля, продукти його переробки Сложные эфиры. Жиры
Сложные эфиры. Жиры Основы химической термодинамики. Термохимические расчеты
Основы химической термодинамики. Термохимические расчеты Сабын
Сабын Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05)
Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05) Кремний и его соединения. Простое вещество - кристаллический кремний Si
Кремний и его соединения. Простое вещество - кристаллический кремний Si Нефть
Нефть Анализ начальных участков изотерм адсорбции
Анализ начальных участков изотерм адсорбции Органическая химия. Лекция 13
Органическая химия. Лекция 13 Карбоновые кислоты, альдегиды
Карбоновые кислоты, альдегиды Основные синтетические полимеры
Основные синтетические полимеры Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас
Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас Углерод и его свойства
Углерод и его свойства Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Йодометрия
Йодометрия Лекция №11 ДИСПЕРСНЫЕ СИСТЕМЫ И РАСТВОРЫ
Лекция №11 ДИСПЕРСНЫЕ СИСТЕМЫ И РАСТВОРЫ Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Углерод, как химический элемент и простое вещество
Углерод, как химический элемент и простое вещество Химические свойства металлов
Химические свойства металлов Таза зат және қоспа. Қоспаларды бөлу әдістері. Қосылыс Рure substances and mixtures . Мethods for separating mixtures. Compound
Таза зат және қоспа. Қоспаларды бөлу әдістері. Қосылыс Рure substances and mixtures . Мethods for separating mixtures. Compound Інгібіювання та регуляція ензимів
Інгібіювання та регуляція ензимів Основные законы химии. (Лекция 1)
Основные законы химии. (Лекция 1) Минералы. Свойства минералов
Минералы. Свойства минералов Свойства минералов
Свойства минералов Реактор получения элементарной серы
Реактор получения элементарной серы Кристалл. Основные законы кристаллографии
Кристалл. Основные законы кристаллографии