Слайд 2

Используя оксид ртути (II) напишите уравнения реакций, при которых возможны следующие
Слайд 3

Общая характеристика газообразных веществ
Слайд 4

Общая характеристика газообразных веществ
Слайд 5
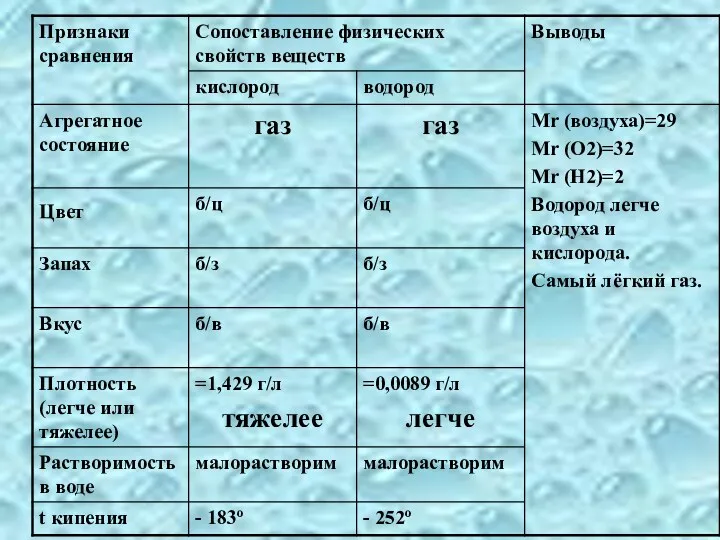
Слайд 6

Слайд 7

На долю
водорода
приходится
50 % массы
Солнца и других
звезд
Слайд 8

Слайд 9

Земная кора
(массовая доля)
1 %
99 %
Слайд 10

В составе атмосферного воздуха присутствие водорода менее 0,0001 %
Слайд 11

Слайд 12

Получение водорода.
В промышленности:
Разложение воды электрическим током:
2H2O=2H2+O2
В лаборатории:
Взаимодействие цинка с соляной кислотой:
Zn+2H Cl=ZnCl2+ H2
хлорид цинка
Взаимодействие калия с водой:
2К+2H2O=2KOH+H2
гидроксид
калия
Слайд 13

Слайд 14
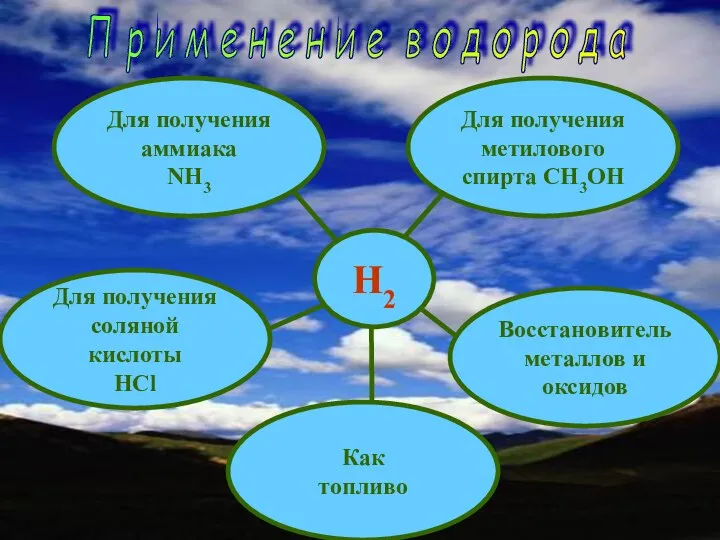
H2
Для получения
аммиака
NH3
Восстановитель
металлов и оксидов
Для получения
соляной кислоты
HCl
Как
топливо
Для получения
метилового
спирта СH3OH
П
р и м е н е н и е в о д о р о д а
Слайд 15

читать параграф 62; 63
практическая работа №4;
Творческое задание: составить кроссворд
на тему «Водород»
Домашнее задание:
Слайд 16

1. В лаборатории водород получают:
а) кипячением воды; б) сжижением воздуха;
в) взаимодействием
неметаллов с водой;
г) взаимодействием металлов с HCl
2. Плотность газообразного водорода:
а) больше, чем у воздуха б) равна плотности воздуха
в) меньше, чем у воздуха г) больше, чем у кислорода
3. В промышленности водород получают:
а) разложением воды под действием электрического тока;
б) взаимодействием воды с метаном при высокой температуре;
в) взаимодействием металлов с кислотами;
г) разложением сероводорода
4. Первооткрывателем водорода является:
а) Кавендиш
б) Шееле
в) Дьюар
г) Пристли
Слайд 17

Проверь себя:
1 – г
2 – в
3 – а
4 - а
















 Ертінділер. Ерітінді концентрациясын білдіру тәсілдері
Ертінділер. Ерітінді концентрациясын білдіру тәсілдері Жиры
Жиры Количество вещества. Единица измерения вещества моль
Количество вещества. Единица измерения вещества моль Кислоты, содержащие серу (S)
Кислоты, содержащие серу (S) Степень окисления. Определение степени окисления в соединениях
Степень окисления. Определение степени окисления в соединениях ОВР в органической химии
ОВР в органической химии Классификация и свойства оксидов
Классификация и свойства оксидов Лекция Атомное строение твердых тел. 1-01
Лекция Атомное строение твердых тел. 1-01 Классификация химических реакций
Классификация химических реакций Презентация по химии _Классификация веществ_ 11 класс
Презентация по химии _Классификация веществ_ 11 класс Пятичленные гетероциклы с двумя гетероатомами
Пятичленные гетероциклы с двумя гетероатомами Physiology lab
Physiology lab Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов
Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов Периодическая система химических элементов. Знаки химических элементов
Периодическая система химических элементов. Знаки химических элементов Природный газ
Природный газ Застосування арт-терапевтичних технік на уроках хімії
Застосування арт-терапевтичних технік на уроках хімії Нефть и ее роль в мировой экономике
Нефть и ее роль в мировой экономике Циклические углеводороды. Циклоалканы
Циклические углеводороды. Циклоалканы Основы химмотологии моторных топлив. Тема 3
Основы химмотологии моторных топлив. Тема 3 Швидкість хімічної реакції
Швидкість хімічної реакції Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Новые катализаторы
Новые катализаторы Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Металлы. Общая характеристика
Металлы. Общая характеристика Кремний и его соединения для 11 класса
Кремний и его соединения для 11 класса Гетероциклы с одним гетероатомом
Гетероциклы с одним гетероатомом Химический элемент, минерал, горная порода. (Лекция 6)
Химический элемент, минерал, горная порода. (Лекция 6) Химиялық тепе-теңдік
Химиялық тепе-теңдік