Содержание
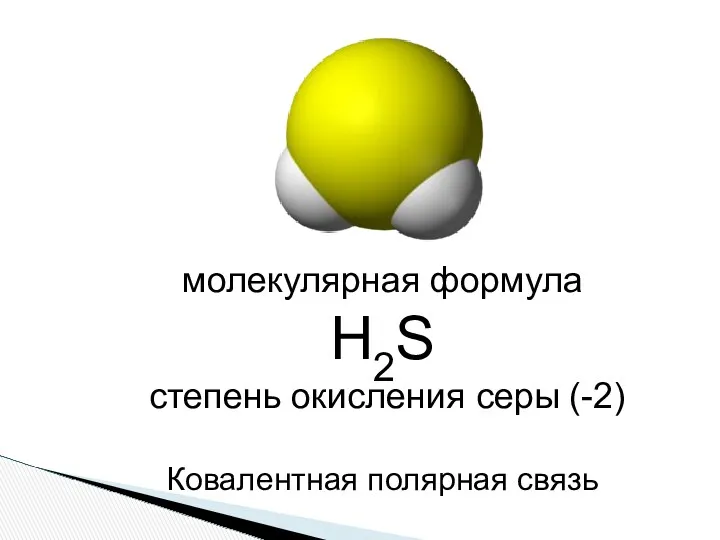
- 3. молекулярная формула Н2S степень окисления серы (-2) Ковалентная полярная связь
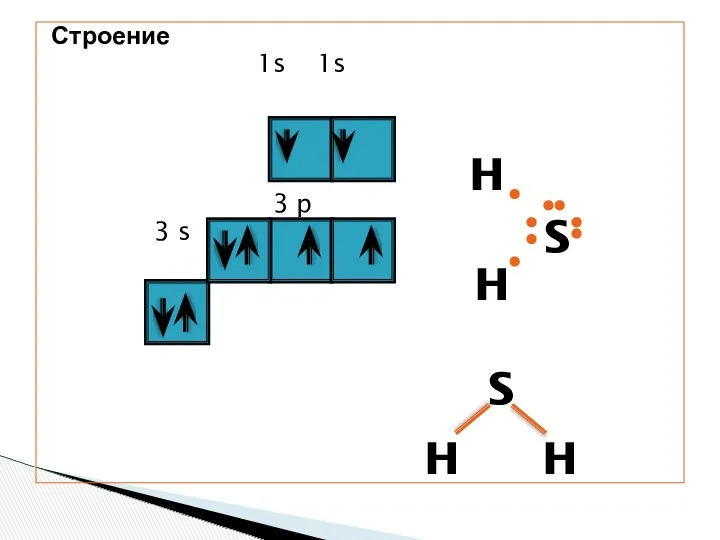
- 4. Строение 1s 1s 3 p 3 s H H S S H H
- 5. Молекула сероводорода имеет угловую форму, поэтому она полярна. В отличие от молекул воды, атомы водорода в
- 6. Нахождение в природе в свободном состоянии встречается в составе вулканических газов, во многих источниках вулканических местностей,
- 7. в растворенном и отчасти в свободном состоянии сероводород содержится в Черном море, начиная с глубины 200
- 8. в небольших количествах она образуется всюду, где происходит разложение или гниение органических веществ
- 9. в небольших количествах она присутствует в минеральных грязях, образующихся на дне неглубоких соляных озер
- 10. D воздух -? М(Воздух)= 29 г/моль М(H2S)= 34 г/моль D воздух = 34:29=1,17 D воздух =1,17
- 11. Сероводоро́д (серни́стый водоро́д, сульфи́д водоро́да) 1. Бесцветный газ с запахом тухлых яиц и сладковатым вкусом. 2.
- 12. 1. В лаборатории сероводород получают взаимодействием сульфида железа с соляной или разбавленной серной кислотами: FeS +
- 13. 1 ступень H2S → H+ + HS- 2 ступень HS- ↔ H+ + S2- Диссоциация по
- 14. Взаимодействуют: - меняют окраску индикаторов -с основаниями(NaOH) -основными и амфотерными оксидами(Na2O, ZnO) Металлами(Mg) Солями(Pb(NO3)2) Общие свойства
- 15. H2S + NaOH → NaHS + H2O избыток H2S + 2NaOH → Na2S + 2H2O избыток
- 16. Лабораторный опыт Pb(NO3)2 + Na2S → PbS↓ + 2NaNO3 осадок черного цвета (Na2S + CuCl2 →
- 17. Сероводород горит на воздухе голубым пламенем при этом образуется сернистый газ или оксид серы(IV) 2H2S-2 +
- 18. Сероводород обладает свойствами восстановителя: если в пробирку с сероводородом прилить небольшое количество йодной воды, то раствор
- 19. Влияние сероводорода на окружающую среду и здоровье человека Очень токсичен. Вдыхание воздуха с содержанием сероводорода вызывает
- 20. Сероводород из-за своей токсичности находит ограниченное применение. В аналитической химии сероводород и сероводородная вода используются как
- 21. Сероводород применяют д для получения серной кислоты, элементной серы, сульфидов. В медицине — в составе природных
- 22. Сульфиды калия, стронция и бария используются в кожевенном деле для удаления шерсти со шкур перед их
- 24. СЕРНИСТАЯ КИСЛОТА H2SO3 Сернистая кислота — неустойчивая двухосновная неорганическая кислота средней силы. Отвечает степени окисления серы
- 25. ХИМИЧЕСКИЕ СВОЙСТВА СЕРНИСТОЙ КИСЛОТЫ Двухосновная кислота образует два ряда солей средние и кислые: H2SO3 + NaOH
- 26. ПРИМЕНЕНИЕ СЕРНИСТОЙ КИСЛОТЫ 1.Сернистую кислоту и её соли применяют как восстановители, для беления шерстиСернистую кислоту и
- 28. Скачать презентацию






















 Кремний и его соединения
Кремний и его соединения Решение задач. Органическая химия
Решение задач. Органическая химия Чисті речовини і суміші
Чисті речовини і суміші Уральские горы. Самоцветы
Уральские горы. Самоцветы Кислотность органических соединений. Типы химических реакций
Кислотность органических соединений. Типы химических реакций Реакции при участии катализатора
Реакции при участии катализатора Тотығу-тотықсыздану реакциялары
Тотығу-тотықсыздану реакциялары Щелочноземельные металлы. Металлы II А подгруппы
Щелочноземельные металлы. Металлы II А подгруппы Производные галогенуглеводородов жирного ряда, спиртов, простых и сложных эфиров, альдегидов
Производные галогенуглеводородов жирного ряда, спиртов, простых и сложных эфиров, альдегидов 36fd4612109c46a6a8f3b83635fe0e02
36fd4612109c46a6a8f3b83635fe0e02 Хроматографические методы анализа
Хроматографические методы анализа Роль полимеров в нашей жизни
Роль полимеров в нашей жизни Сера. Нахождение в природе. Химические свойства серы
Сера. Нахождение в природе. Химические свойства серы Классы органических и неорганических веществ
Классы органических и неорганических веществ Общая характеристика углеводов: глюкоза
Общая характеристика углеводов: глюкоза Источники углеводородов
Источники углеводородов Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Ароматические углеводороды, строение, изомерия, номенклатура
Ароматические углеводороды, строение, изомерия, номенклатура Химия и обмен углеводов. Функции углеводов
Химия и обмен углеводов. Функции углеводов Классификация веществ в зависимости от типа химической связи
Классификация веществ в зависимости от типа химической связи Ферменти
Ферменти Металлы и сплавы в искусстве
Металлы и сплавы в искусстве Сложные эфиры. 10 класс
Сложные эфиры. 10 класс Электрохимические методы
Электрохимические методы Спирты. Классификация спиртов
Спирты. Классификация спиртов Мини-тақталарда немесе дәптерде қатты, сұйық және газтектес заттардың құрылысын сал
Мини-тақталарда немесе дәптерде қатты, сұйық және газтектес заттардың құрылысын сал Кислородсодержащие органические вещества. Фенолы
Кислородсодержащие органические вещества. Фенолы Изменения, происходящие с липидами в процессах технологической переработки сырья и параметры, характеризующие их
Изменения, происходящие с липидами в процессах технологической переработки сырья и параметры, характеризующие их