Содержание
- 2. Відмінність біологічних каталізаторів (ферментів) від мінеральних Надзвичайно висока ефективність дії (в дуже малих кількостях підсилюють швидкості
- 3. Будова ферментів 1) прості білки (однокомпонентні) 2) складні білки (двокомпонентні): простий білок + простетична група (апофермент)
- 4. Молекулярна маса РИБОНУКЛЕАЗА ……………....………………..……………………..13700 ТРИПСИН ………………………………………………………………23800 ГЕКСОКІНАЗА ……………………...………………….……………..45000 АЛЬДОЛАЗА ………………………………………………...………..142000 УРЕАЗА ………………………………………………………………..480000 ПІРУВАТДЕГІДРОГЕНАЗА ………..……….………………...……4500000
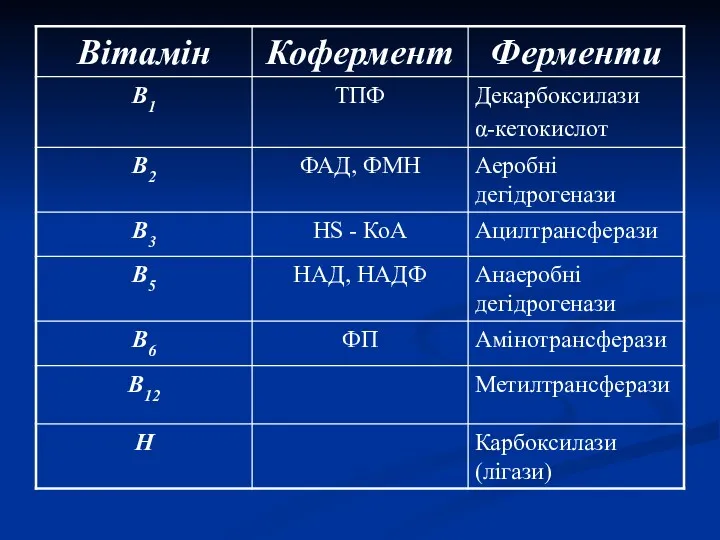
- 5. Коферменти 1. Водорозчинні вітаміни – у вигляді фосфорних ефірів (ТДФ та ФП) або в складі нуклеотидів
- 7. Центри ферментів це особливі ділянки ферментів, які формуються на рівні третинної і четвертинної структури та забезпечують
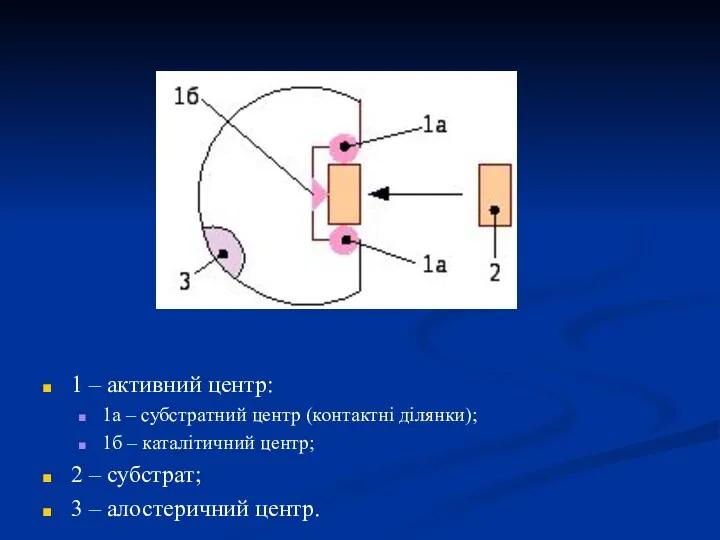
- 8. В структурі ферментів розрізняють наступні центри: 1. Активний центр, в ньому виділяють 2 ділянки, які теж
- 9. 2. Регуляторний (алостеричний) центр – це ділянка ферменту, приєднання до якого різних речовин (модифікаторів) призводить до
- 10. 1 – активний центр: 1а – субстратний центр (контактні ділянки); 1б – каталітичний центр; 2 –
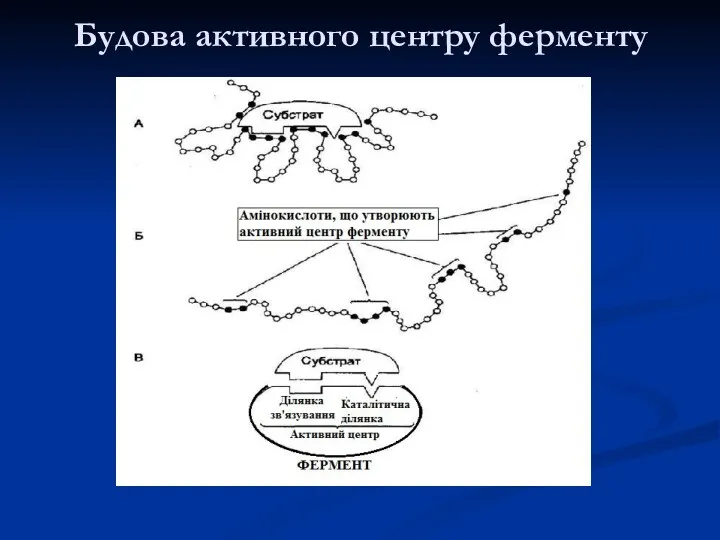
- 11. Будова активного центру ферменту
- 12. Амінокислоти, що найчастіше входять до структури центрів Серин – ОН Треонін – ОН Тирозин – ОН
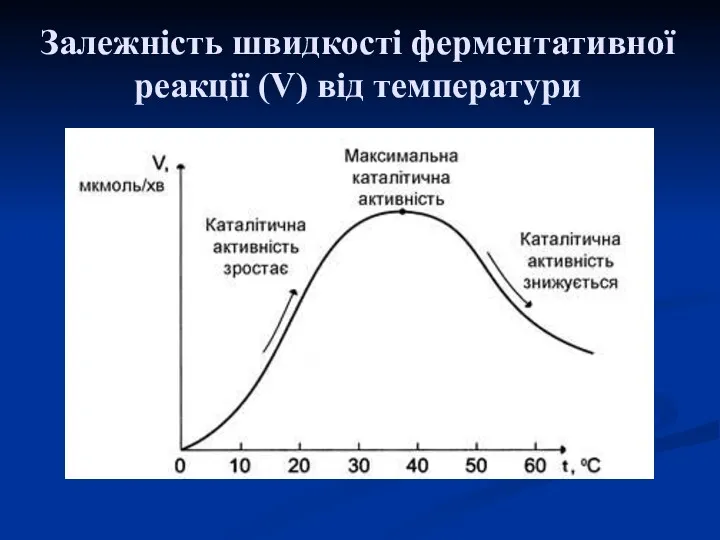
- 13. Загальні властивості ферментів 1. Термолабільність – це зміна активності ферментів при різних температурах: оптимальну активність вони
- 14. Залежність швидкості ферментативної реакції (V) від температури
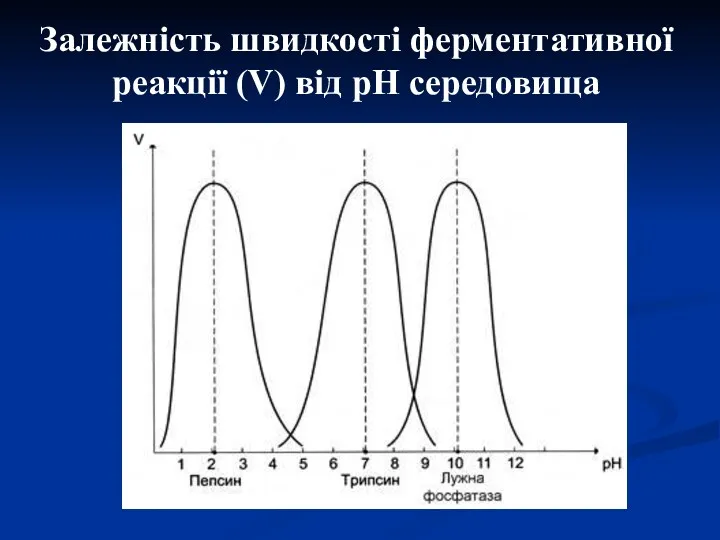
- 15. 2. Чутливість до рН середовища Більшість ферментів організму мають оптимум рН, наближений до нейтрального, хоча для
- 16. Залежність швидкості ферментативної реакції (V) від рН середовища
- 17. 3. Специфічність дії – це вибірковість дії ферментів як по відношенню до субстрату реакції, так і
- 18. 4. Зберігають активність в ізольованому вигляді, тому багато ферментів використовують як лікарські препарати. 5. Чутливість до
- 19. Механізм дії ферментів. Енергетичні зміни ПРИ ХІМІЧНИХ РЕАКЦІЯХ. Будь-які хімічні реакції перебігають згідно двох основних законів
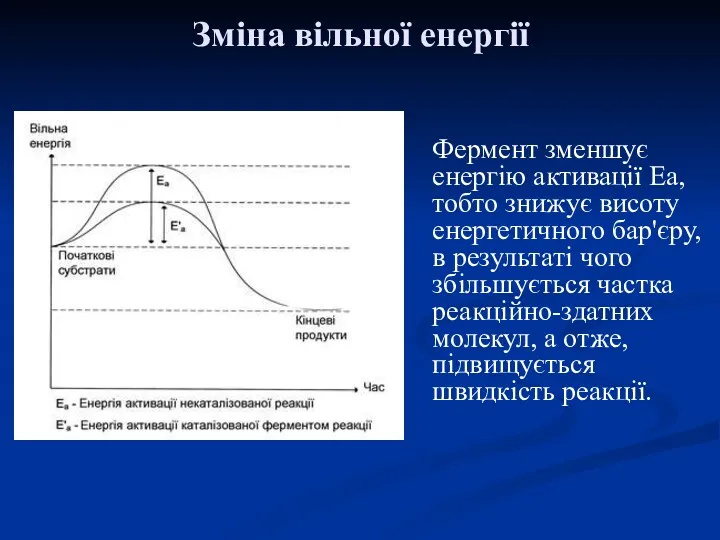
- 20. Фермент зменшує енергію активації Еа, тобто знижує висоту енергетичного бар'єру, в результаті чого збільшується частка реакційно-здатних
- 21. Зниження енергетичного бар'єру відбувається за рахунок: 1. Підвищення ймовірності зіткнення субстратів. 2. Чіткої орієнтації взаємодій молекул
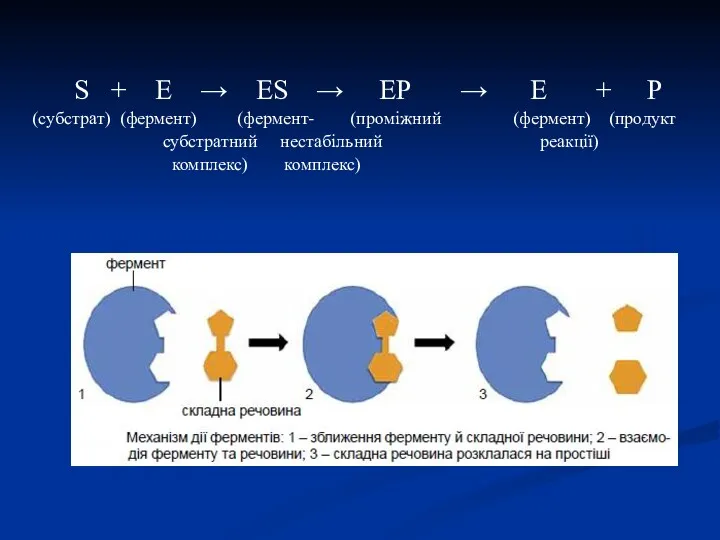
- 22. Механізм ферментативного каталізу (теорія нестійких фермент-субстратних комплексів) В механізмі ферментативного каталізу вирішальне значення має утворення нестійких
- 23. S + E → ES → EP → E + P (cубстрат) (фермент) (фермент- (проміжний (фермент)
- 24. Ефект деформації Активний центр ферменту також сприяє дестабілізації міжатомних зв'язків в молекулі субстрату, що полегшує перебіг
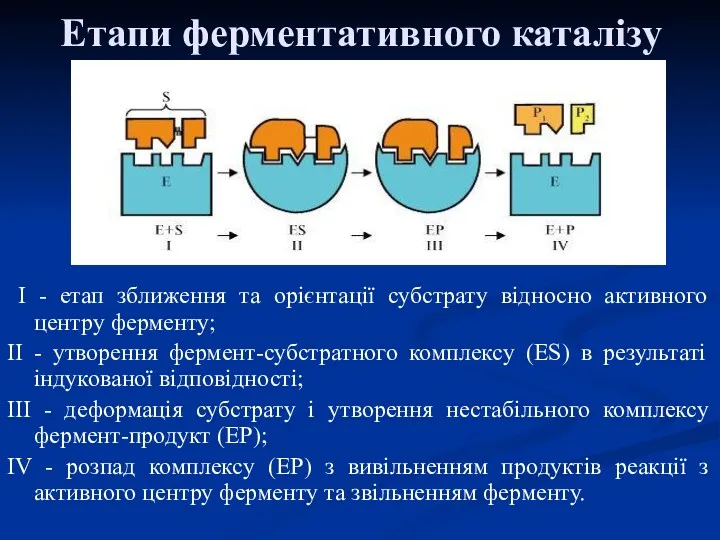
- 25. Етапи ферментативного каталізу I - етап зближення та орієнтації субстрату відносно активного центру ферменту; II -
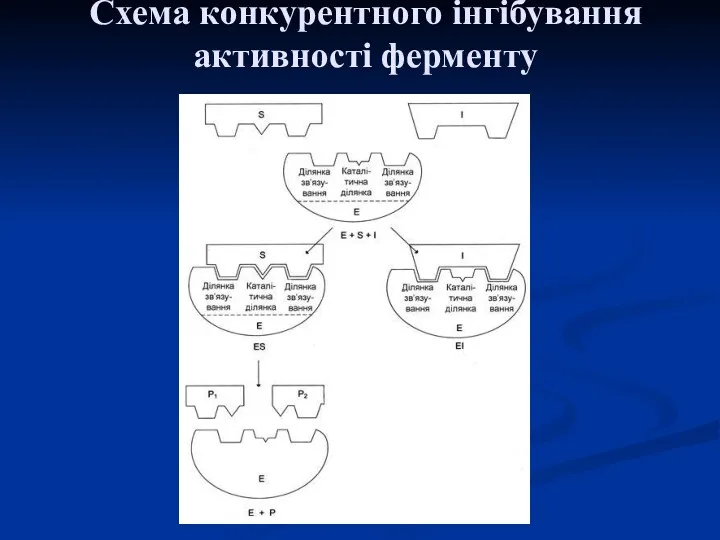
- 26. Конкурентна і неконкурентна дія інгібіторів Конкурентна дія інгібітора буває в тому випадку, коли його хімічна будова
- 27. Схема конкурентного інгібування активності ферменту
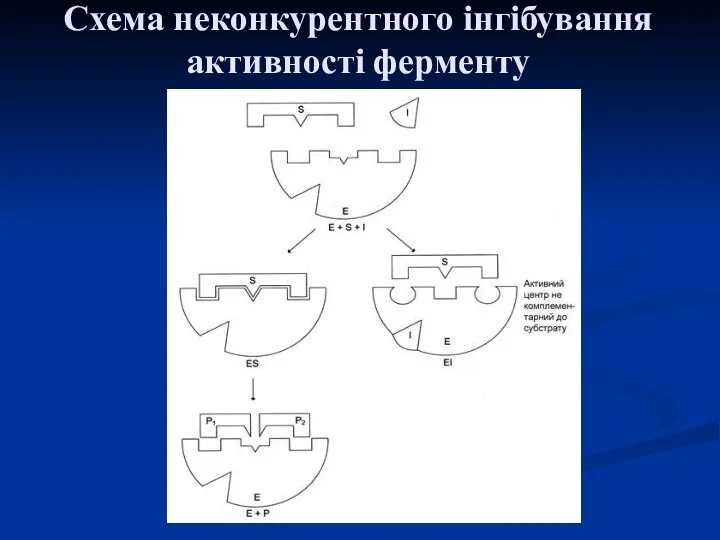
- 28. За неконкурентного інгібування інгібітор приєднується до алостеричного центру, в результаті чого змінюється конформація активного центру та
- 29. Схема неконкурентного інгібування активності ферменту
- 30. Ферментні ансамблі або мультиферменти – комплекс ферментів, які каталізують послідовні реакції при перетворенні однієї речовини.
- 31. ІЗОФЕРМЕНТИ Це множинні молекулярні форми, що мають єдину субстратну специфічність (фактично це один і той самий
- 32. Множинні ізоформи ЛДГ А – будова різних ізоформ ЛДГ (субодиниці типу Н і типу М); Б
- 33. Активність ферментів визначають опосередковано: за кількістю продукту, що утворився (Р), за кількістю спожитого субстрату (S). Міжнародна
- 34. Для оцінки кількості молекул ферменту серед інших білків досліджуваної тканини визначають питому активність (пит. ак.) ферменту,
- 35. Каталітична ефективність Кількість молекул субстрату, які перетворюються в продукт однією молекулою ферменту за 1 с, називають
- 36. Номенклатура ферментів Тривіальна (пепсин, трипсин, хімотрипсин); Назва субстрату (латинська або інша) + закінчення –аза: амілаза (amilum
- 37. Наукова назва: за допомогою цифр: - перша цифра – це номер класу; - друга цифра –
- 38. КЛАСИФІКАЦІЯ ФЕРМЕНТІВ Всі ферменти за механізмом дії розділені на 6 основних класів: Оксидоредуктази 4. Ліази Трансферази
- 39. Оксидоредуктази Ферменти цього класу каталізують окисно-відновні реакції, які лежать в основі забезпечення тканин необхідною енергією. Оксидоредуктази
- 40. Дегідрогенази: а) піридинзалежні (анаеробні), б) флавінзалежні (аеробні). Цитохроми: а) сімейство а (а1, а2, a3,…); б) сімейство
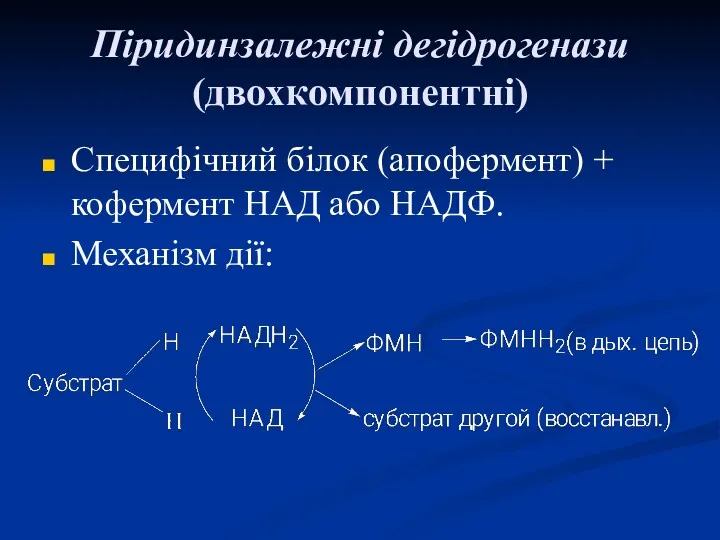
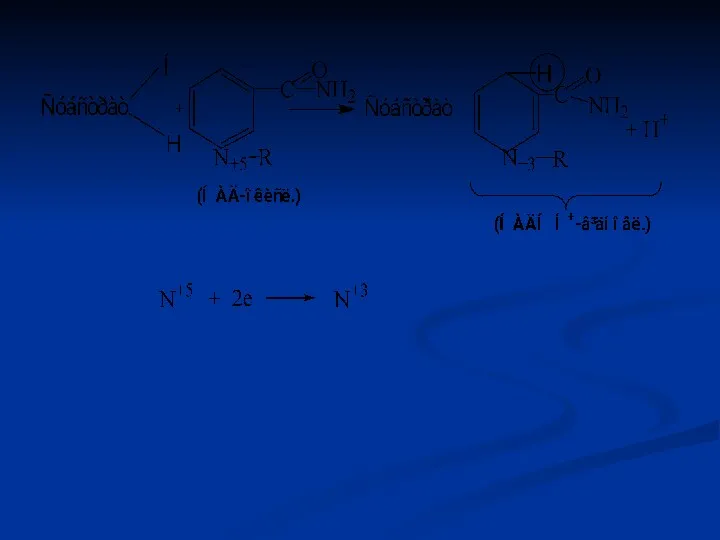
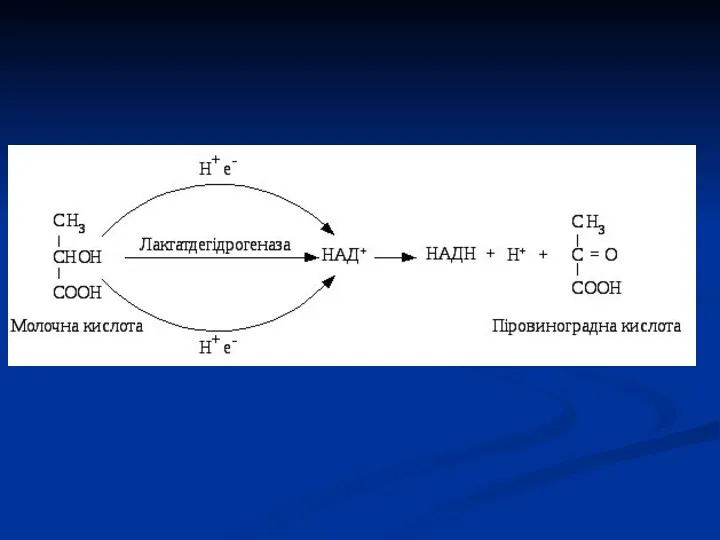
- 41. Піридинзалежні дегідрогенази (двохкомпонентні) Специфічний білок (апофермент) + кофермент НАД або НАДФ. Механізм дії:
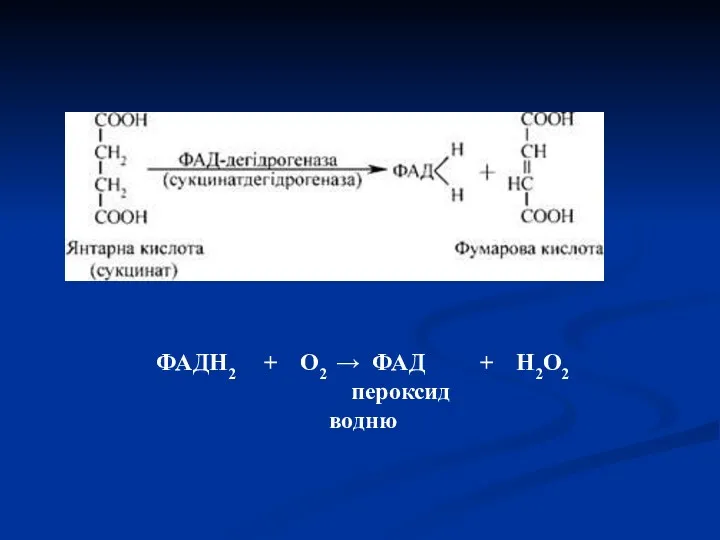
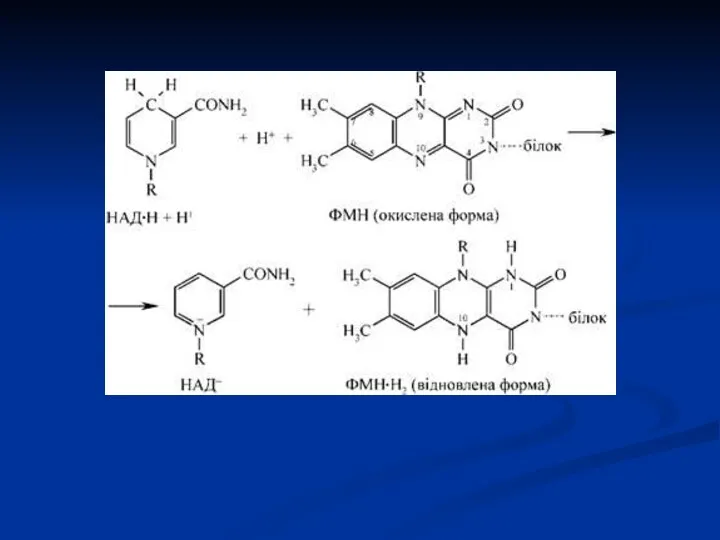
- 44. Флавінзалежні дегідрогенази (двохкомпонентні) Специфічний білок (апофермент) + кофермент ФМН або ФАД. Механізм дії:
- 45. ФАДН2 + О2 → ФАД + Н2О2 пероксид водню
- 47. Цитохроми За хімічною природою відносяться до хромопротеїнів (гемовмісних). Їх простетичною групою (коферментом) є гем, атом заліза
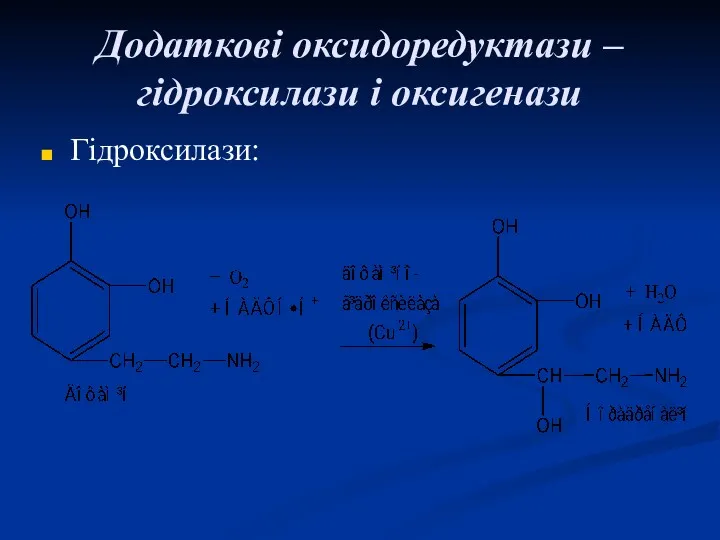
- 48. Додаткові оксидоредуктази – гідроксилази і оксигенази Гідроксилази:
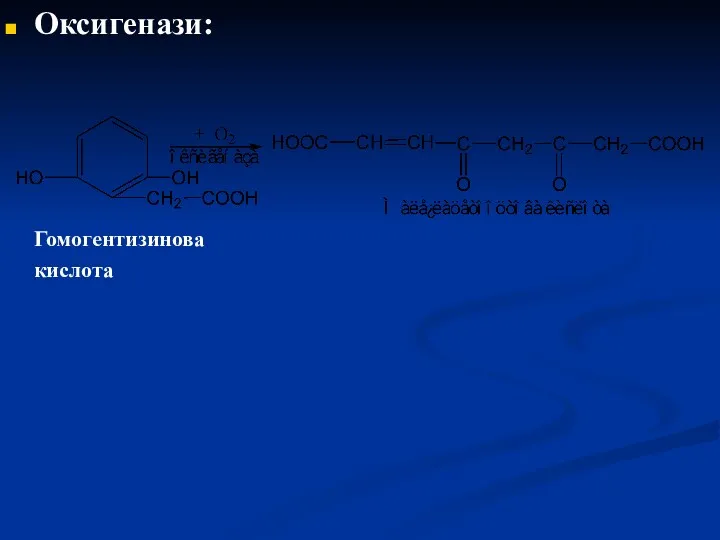
- 49. Оксигенази: Гомогентизинова кислота
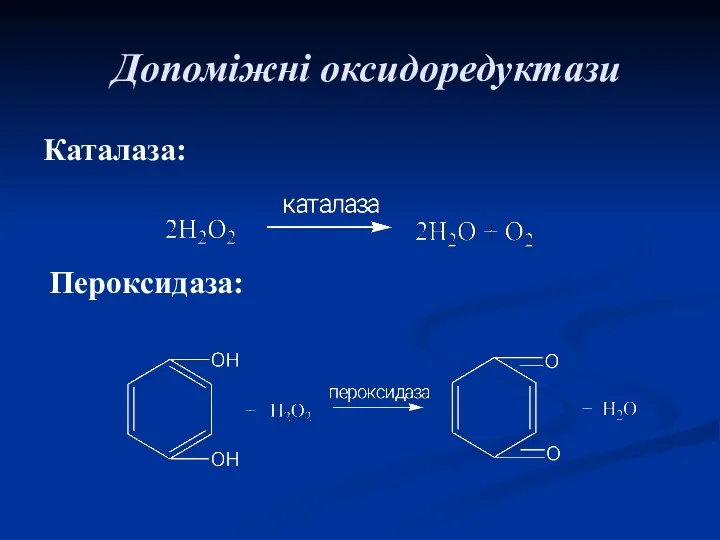
- 50. Допоміжні оксидоредуктази Каталаза: Пероксидаза:
- 51. Трансферази Амінотрансферази (апофермент + ФП), Ацилтрансферази (апофермент + НS-КоА), Метилтрансферази (апофермент + В12), Формілтрансферази (апофермент +
- 52. Амінотрансферази (двохкомпонентні) Склад: специфічний білок + фосфопіридоксаль (ФП), тобто фосфорильований вітамін В6. α
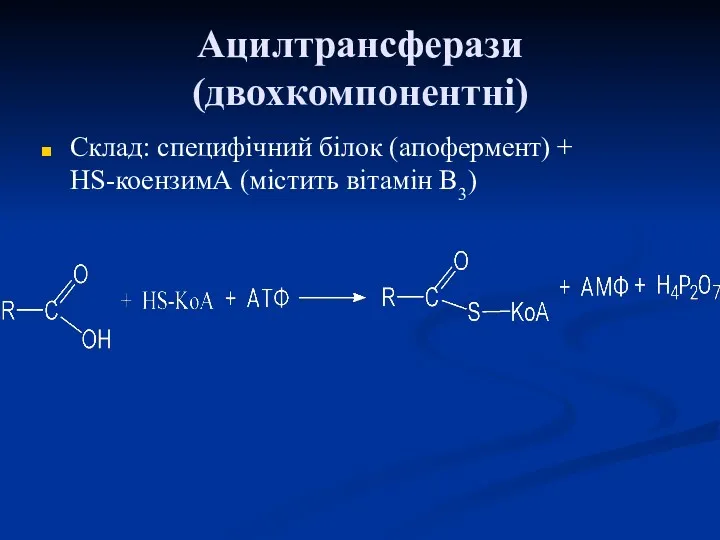
- 53. Ацилтрансферази (двохкомпонентні) Склад: специфічний білок (апофермент) + НS-коензимА (містить вітамін В3)
- 54. Метилтрансферази (двохкомпонентні) Склад: специфічний білок (апофермент) + вітамін В12 та Вс
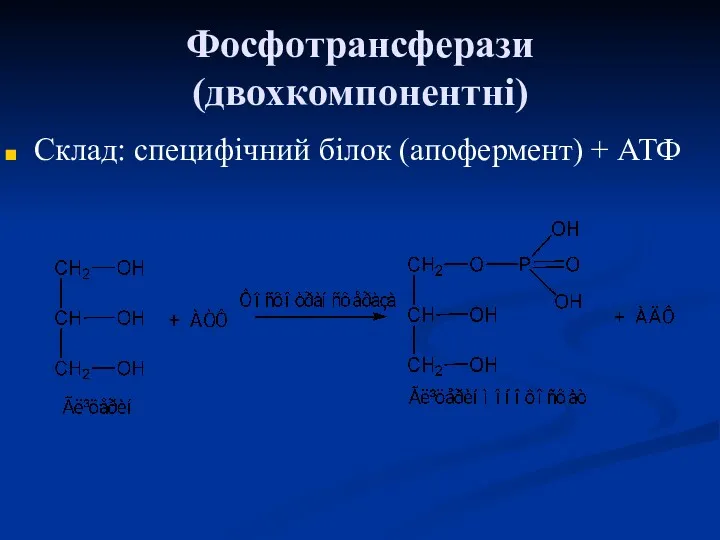
- 55. Фосфотрансферази (двохкомпонентні) Склад: специфічний білок (апофермент) + АТФ
- 56. Гідролази (однокомпонентні) Каталізують розрив хімічних зв'язків в молекулах складних речовин шляхом приєднання води. Найбільш часто гідролази
- 57. Підкласи пептидази, глікозидази, естерази, тіолази, амідази та ін.
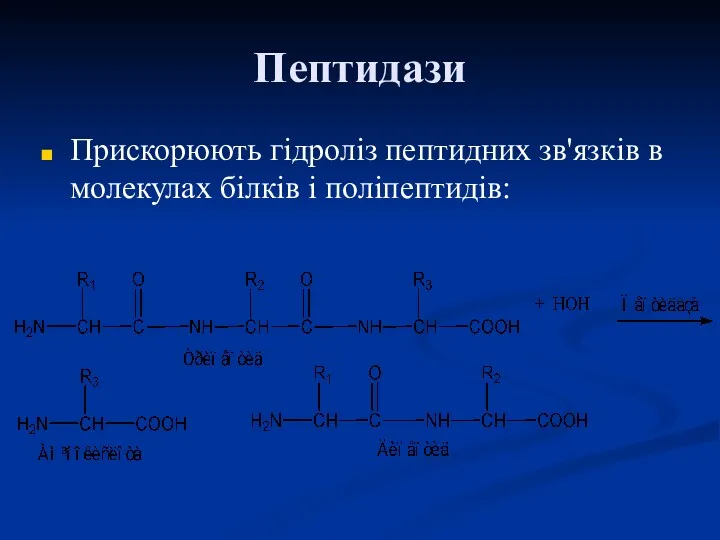
- 58. Пептидази Прискорюють гідроліз пептидних зв'язків в молекулах білків і поліпептидів:
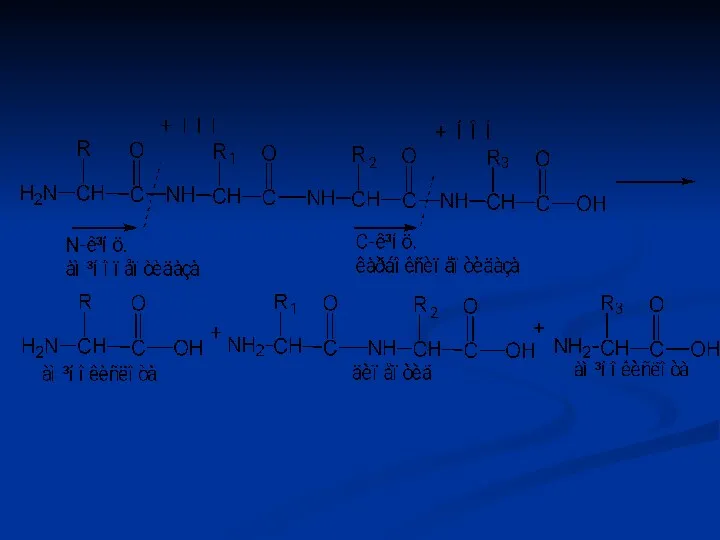
- 59. Ендопептидази Ендопептидази гідролізують пептидні зв'язки в середині поліпептидного ланцюга та розщеплюють її на декілька більш коротких
- 60. Екзопептидази При дії цих ферментів від поліпептидного ланцюга відщеплюються окремі амінокислоти, тобто екзопептидази гідролізують кінцеві пептидні
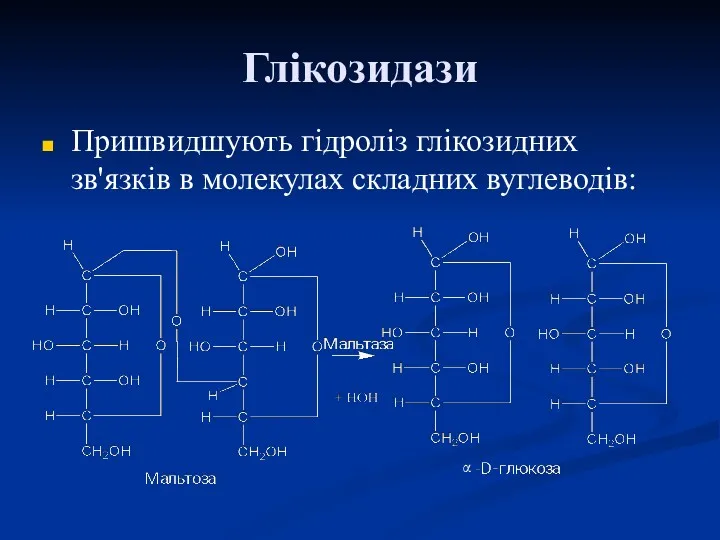
- 62. Глікозидази Пришвидшують гідроліз глікозидних зв'язків в молекулах складних вуглеводів: α
- 64. Естерази Прискорюють гідроліз різних складних ефірів. Залежно від кислоти, що бере участь в утворенні складно-ефірного зв'язку,
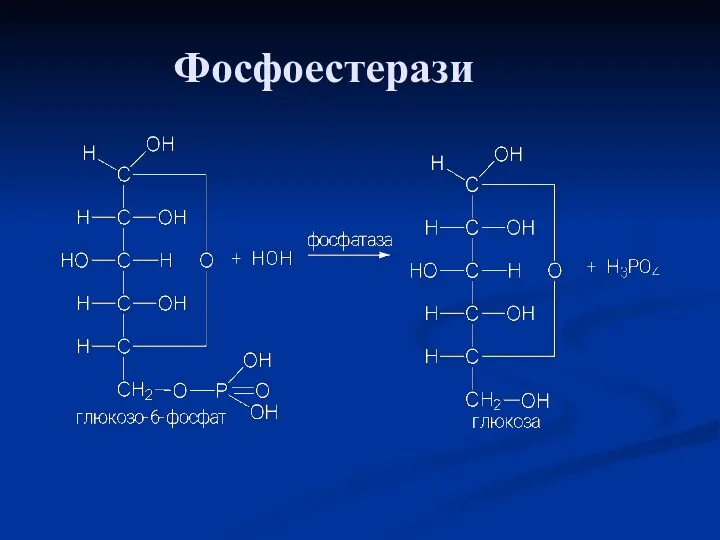
- 65. Фосфоестерази
- 66. Ліази Це ферменти, які можуть обернено приєднувати або відщепляти атомні групи по подвійним зв'язкам. По своїй
- 69. Ізомерази Ферменти цього класу каталізують реакції ізомерних перебудов невеликих молекул, а також реакції перенесення окремих груп
- 71. Лігази (синтетази) Каталізують синтез органічних речовин з двох більш простих молекул. При цьому обов'язково використовується енергія
- 73. Скачать презентацию











































 Медициналық тәжірибедегі потенциометриялар
Медициналық тәжірибедегі потенциометриялар Степень окисления ОВР
Степень окисления ОВР Топливо. Загрязнения воздуха, способы его предотвращения. Химия. 8 класс
Топливо. Загрязнения воздуха, способы его предотвращения. Химия. 8 класс Реакция обменного разложения веществ водой - гидролиз
Реакция обменного разложения веществ водой - гидролиз Галогены. Свойства галогенов
Галогены. Свойства галогенов Открытие хлора
Открытие хлора Типичные окислители
Типичные окислители Свойства кислот и оснований в свете теории электролитической диссоциации
Свойства кислот и оснований в свете теории электролитической диссоциации Растворы
Растворы 20230306_oni_byli_pervymi
20230306_oni_byli_pervymi ПВХ
ПВХ Оксид серы (VI). Серная кислота. 9 класс
Оксид серы (VI). Серная кислота. 9 класс Полипропилен
Полипропилен Строение атома углерода. Валентные состояния атома углерода
Строение атома углерода. Валентные состояния атома углерода Строение атома. Лекция 2
Строение атома. Лекция 2 Ізомерія. Структурна ізомерія
Ізомерія. Структурна ізомерія Относительная атомная масса. Знаки химических элементов
Относительная атомная масса. Знаки химических элементов Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель
Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель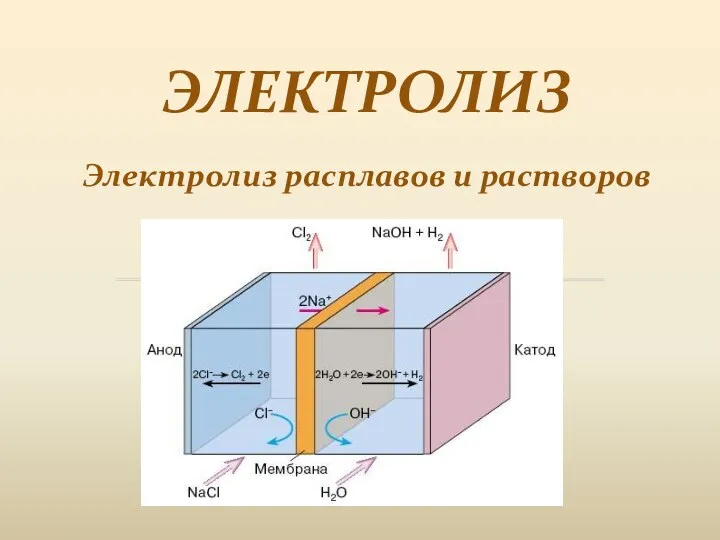 Электролиз. Электролиз расплавов и растворов
Электролиз. Электролиз расплавов и растворов Магматические и метаморфические горные породы. (Лекция 7)
Магматические и метаморфические горные породы. (Лекция 7) Серная кислота. 9 класс
Серная кислота. 9 класс Кремний и его соединения
Кремний и его соединения Теоретическая электрохимия
Теоретическая электрохимия Методы исследования гидрохимического режима водоемов
Методы исследования гидрохимического режима водоемов Химиялық қауіптілер. Нитраттар
Химиялық қауіптілер. Нитраттар Reactors for catalytic alkylation
Reactors for catalytic alkylation Iron Oxide
Iron Oxide Аммиак. Образование молекулы аммиака
Аммиак. Образование молекулы аммиака