Содержание
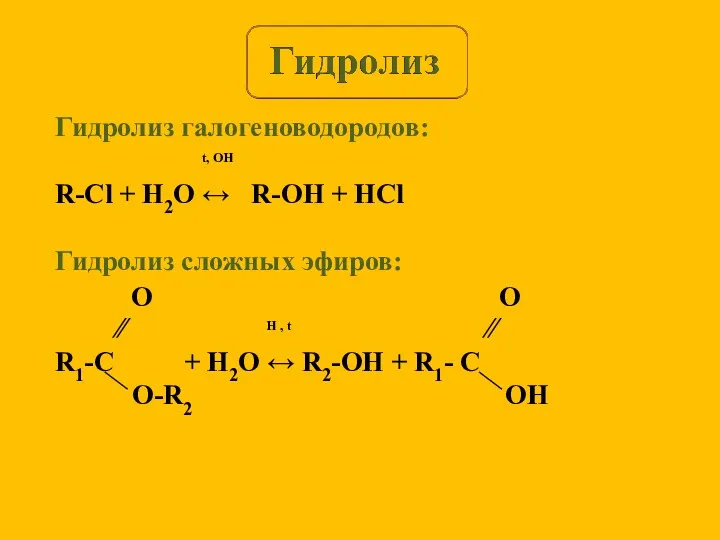
- 4. Гидролиз галогеноводородов: t, OH R-Cl + H2O ↔ R-OH + HCl Гидролиз сложных эфиров: ∕∕ H
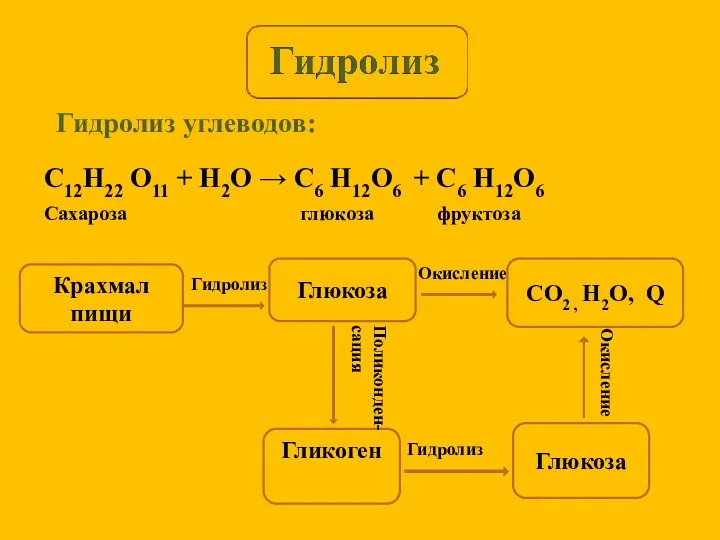
- 5. Гидролиз углеводов: Крахмал пищи Глюкоза CO2 , H2O, Q Гликоген Глюкоза Гидролиз Окисление Поликонден- сация Гидролиз
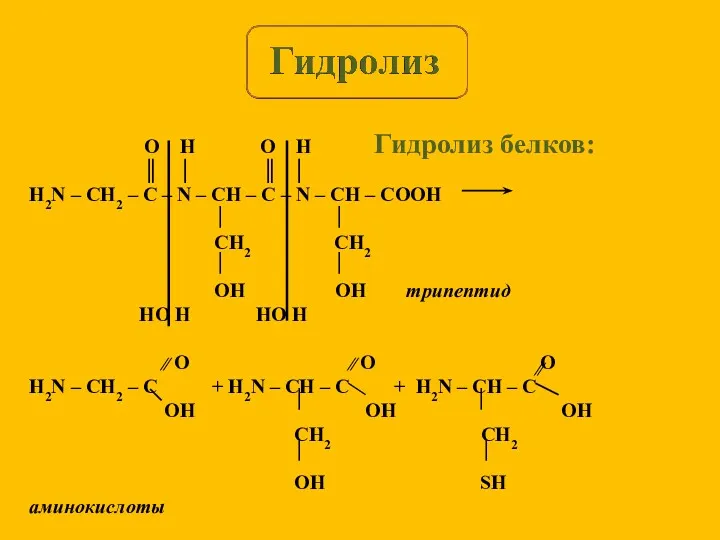
- 6. Гидролиз белков: O H O H ║ │ ║ │ H2N – CH2 – C –
- 7. Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате
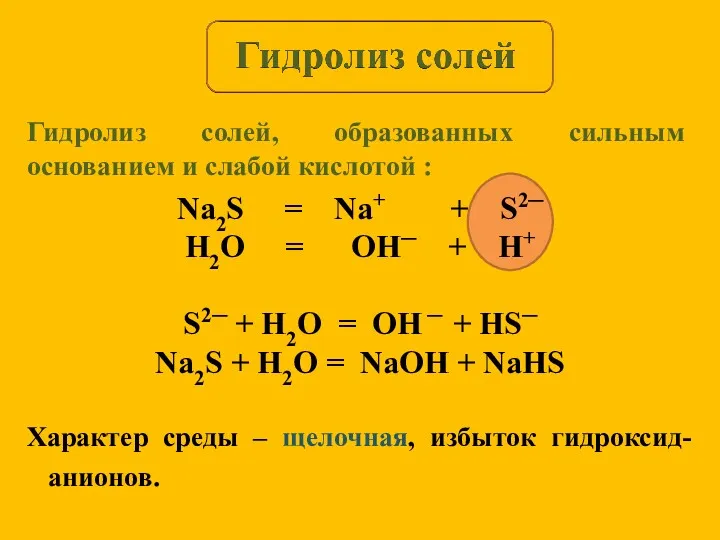
- 9. Na2S = Na+ + S2─ H2O = OH─ + H+ S2─ + H2O = OH ─
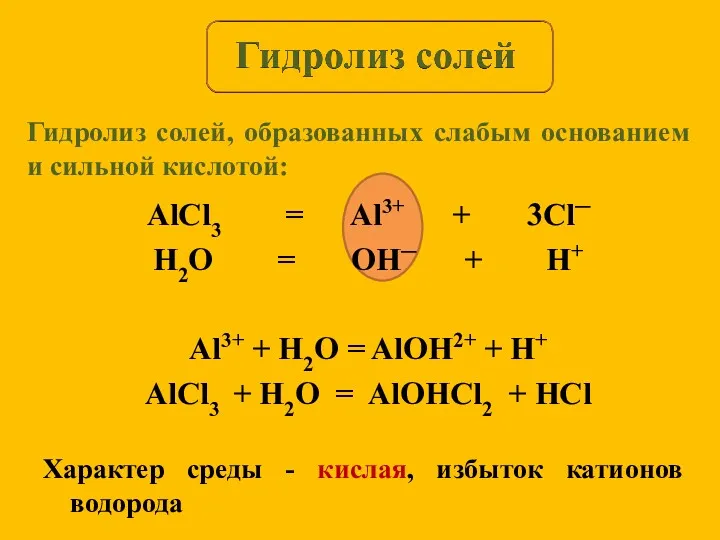
- 10. AlCl3 = Al3+ + 3Cl─ H2O = OH─ + H+ Al3+ + H2O = AlOH2+ +
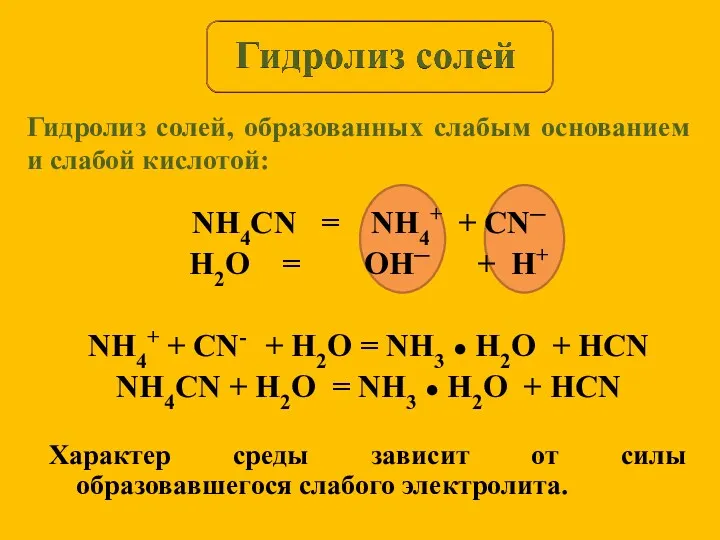
- 11. NH4CN = NH4+ + CN─ H2O = OH─ + H+ NH4+ + CN- + H2O =
- 12. Необратимый гидролиз солей, образованных слабым основанием и слабой кислотой: Например, соли, которые нельзя получить реакцией обмена
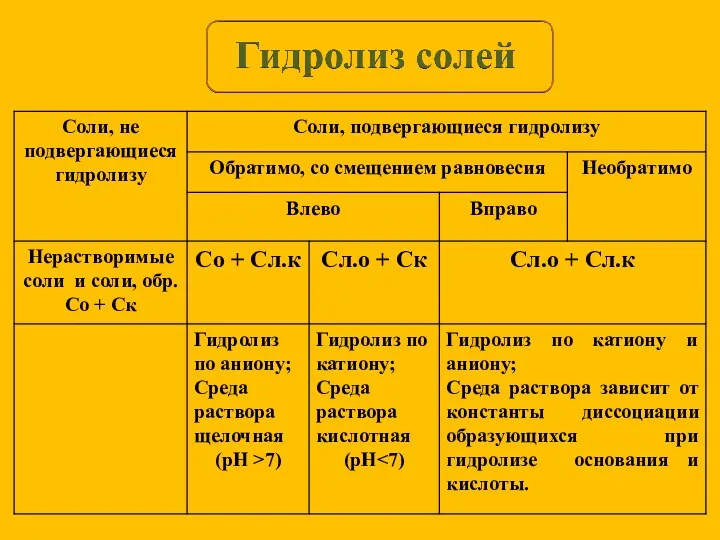
- 13. KCl = K+ + Cl- Слабых ионов нет, гидролиз не идет, среда нейтральная. Гидролиз солей, образованных
- 15. Условия смещения реакций обратимого гидролиза (согласно принципу Ле Шателье). Усилить гидролиз соли можно следующими способами: Добавить
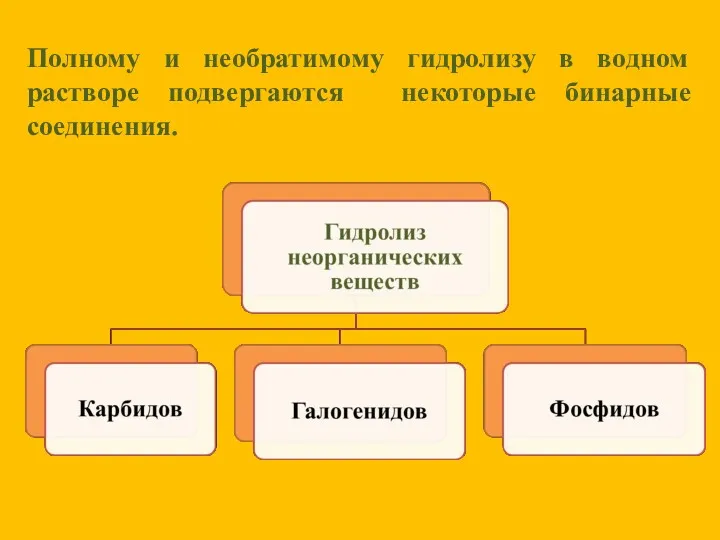
- 16. Полному и необратимому гидролизу в водном растворе подвергаются некоторые бинарные соединения.
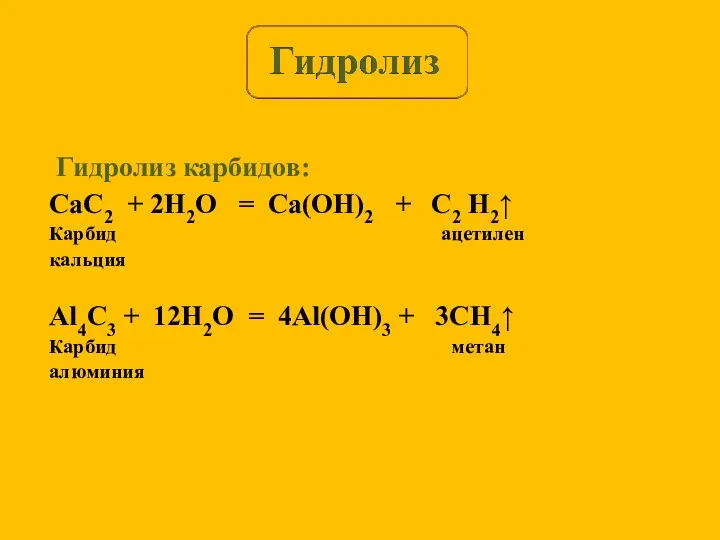
- 17. Гидролиз карбидов: CaC2 + 2H2O = Ca(OH)2 + C2 H2↑ Карбид ацетилен кальция Al4C3 + 12H2O
- 18. Гидролиз галогенидов: SiCl4 + 3H2O = H2SiO4↓ + 4HСl хлорид кремниевая кремния (+4) кислота Гидролиз фосфидов:
- 20. Скачать презентацию







 Полімери, Їх властивості та застосування
Полімери, Їх властивості та застосування Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Органика – 4 галогенпроизводные
Органика – 4 галогенпроизводные Реакции элиминирование галогеналканов
Реакции элиминирование галогеналканов Макро- и микроэлементы
Макро- и микроэлементы Rate of reactions. (Chapter 2)
Rate of reactions. (Chapter 2) Железо, его физические и химические свойства. Урок химии в 9 классе
Железо, его физические и химические свойства. Урок химии в 9 классе Синтез и химические модификации индиго
Синтез и химические модификации индиго Общая характеристика халькогенов. Кислород
Общая характеристика халькогенов. Кислород Хімічне виробництво сталі
Хімічне виробництво сталі Реакции SR в ряду алканов
Реакции SR в ряду алканов Полиамиды. Классификация по методу получения
Полиамиды. Классификация по методу получения Электротехнический фарфор – разновидность твердого фарфора
Электротехнический фарфор – разновидность твердого фарфора Степень окисления
Степень окисления Кто хочет стать миллионером? Дидактическая игра по органической химии (для 10, 11 кл)
Кто хочет стать миллионером? Дидактическая игра по органической химии (для 10, 11 кл) Сероводород
Сероводород Начала органической химии
Начала органической химии Твердые вещества
Твердые вещества Классификация химических реакций в неорганической химии
Классификация химических реакций в неорганической химии Металлы. Общая характеристика
Металлы. Общая характеристика Электролитическая диссоциация
Электролитическая диссоциация Період як особлива синтаксична конструкція
Період як особлива синтаксична конструкція Профілактика захворювань незбалансованого харчування. Харчові добавки
Профілактика захворювань незбалансованого харчування. Харчові добавки Электроотрицательность химических элементов
Электроотрицательность химических элементов Закон сохранения массы веществ
Закон сохранения массы веществ Поливинилхлорид. Общие сведения
Поливинилхлорид. Общие сведения Анализ жидких средств для мытья посуды
Анализ жидких средств для мытья посуды Особенности органических веществ. Теория химического строения А.М.Бутлерова
Особенности органических веществ. Теория химического строения А.М.Бутлерова