Содержание
- 2. Ознакомиться с электролитической диссоциацией , её особенностями , рассмотреть примеры. Цель:
- 3. -Определение -Особенности -Тип кристаллической решетки -Схемы образования -Примеры -Тест -Вывод -Литература Содержание:
- 4. Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении. Определение:
- 6. Диссоциация на ионы в растворах происходит вследствие взаимодействия растворённого вещества с растворителем. Диссоциация в растворах
- 7. Под действием высоких температур ионы кристаллической решётки начинают совершать колебания, кинетическая энергия повышается, и наступит такой
- 8. -Процессу диссоциации подвержены все вещества, имеющие ионный и ковалентный полярный тип химических связей. -Все вещества в
- 9. Сильные электролиты Слабые электролиты Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью
- 10. Электроли́ты — вещества, которые проводят электрический ток вследствие диссоциации на ионы, что происходит в растворах и
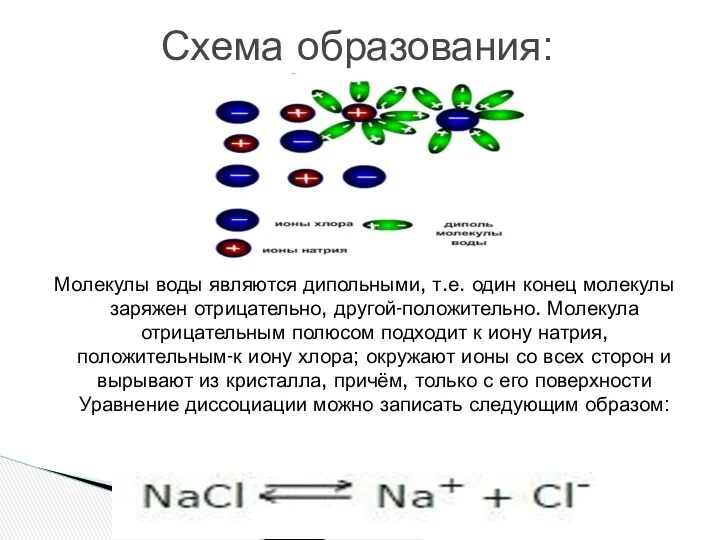
- 11. Молекулы воды являются дипольными, т.е. один конец молекулы заряжен отрицательно, другой-положительно. Молекула отрицательным полюсом подходит к
- 12. Электролиты: -Кислоты (HCl;HNO3;H2SO4) -Щелочи( NaOH; KOH; Ba(OH)2) -Соли(NaCl; CuSO4; Al(NO3)3) Неэлектролиты: -Органические вещества(сахар, ацетон,бензин, керосин, глицерин,
- 13. Электролитическая диссоциация это..? А)Сливание жидкости с отстоявшегося осадка. Б) Получение сложных эфиров из кислот и спиртов.
- 16. 2.Верны ли следующие суждения об электролитах: 1)Растворы и расплавы электролитов проводят электрический ток. 2) Электролитами являются
- 19. 3.Все вещества в растворах делят на...? А)Электролиты и неэлектролиты Б)Летучие и нелетучие В)Растворимые и нерастворимые Г)Горючие
- 22. 4.Вещества растворы которых проводят электрический ток называют? А)Неэлектролитами Б)Электролитами
- 25. 5.На что распадаются электролиты при растворение или расплавление? 1)Анионы 2) Катионы А) Верно только 1 Б)
- 28. 6.К электролитам относят: А) Сахар Б) Оксид меди( 2) В)Оксид углерода(4) Г)Соляная кислота
- 31. 7.К неэлектролитам относят: А)Гидрооксид натрия Б)Оксид углерода(4) В) Хлорид натрия Г) Серная кислота
- 34. 8.Все за исключением одного относятся к электролитам ,лишнее в списке ? А)Кислоты Б)Оксиды В)Соли Г)Щелочи
- 37. Ознакомилась с электролитической диссоциацией и её особенностями , рассмотрела примеры. Вывод:
- 39. Скачать презентацию



































 Хімічні формули речовин
Хімічні формули речовин Водород
Водород Химиялық қауіптілер. Нитраттар
Химиялық қауіптілер. Нитраттар Кислоты в свете теории электролитической диссоциации (ТЭД)
Кислоты в свете теории электролитической диссоциации (ТЭД) Кристаллическое строение и свойства металлов
Кристаллическое строение и свойства металлов Материаловедение промышленного производства. Особенности строения твердых тел
Материаловедение промышленного производства. Особенности строения твердых тел Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Понятия про синтетические лекарственные средства
Понятия про синтетические лекарственные средства Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію Акцепторы катионов и анионов. Краун-эфиры и близкие структурные аналоги: поданды, лариатэфиры. Супрамолекулярная фотоника
Акцепторы катионов и анионов. Краун-эфиры и близкие структурные аналоги: поданды, лариатэфиры. Супрамолекулярная фотоника Химия в Великую Отечественную войну
Химия в Великую Отечественную войну Массовая доля вещества в растворе
Массовая доля вещества в растворе Строение атома. Периодический закон и периодическая система элементов
Строение атома. Периодический закон и периодическая система элементов Современные химические технологии
Современные химические технологии Каталитический риформинг
Каталитический риформинг Получение, собирание, распознавание газов. (Практическая работа 2)
Получение, собирание, распознавание газов. (Практическая работа 2) Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы
Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы Простые вещества
Простые вещества Незвичайна вода
Незвичайна вода Фазовое равновесие
Фазовое равновесие Химия в повседневной жизни человека
Химия в повседневной жизни человека Химическая очистка сточных вод. Окисление и восстановление
Химическая очистка сточных вод. Окисление и восстановление Растворы: состав и их коллигативные свойства
Растворы: состав и их коллигативные свойства Щелочные и щелочноземельные металлы
Щелочные и щелочноземельные металлы Относительная молекулярная масса вещества. Задачи
Относительная молекулярная масса вещества. Задачи Химические свойства карбокатионов
Химические свойства карбокатионов Тіршілік процесіне қатысатын гетерофункционалды қосылыстар
Тіршілік процесіне қатысатын гетерофункционалды қосылыстар Скорость химических реакций
Скорость химических реакций